基态原子的核外电子排布)
- 格式:ppt
- 大小:2.33 MB
- 文档页数:7

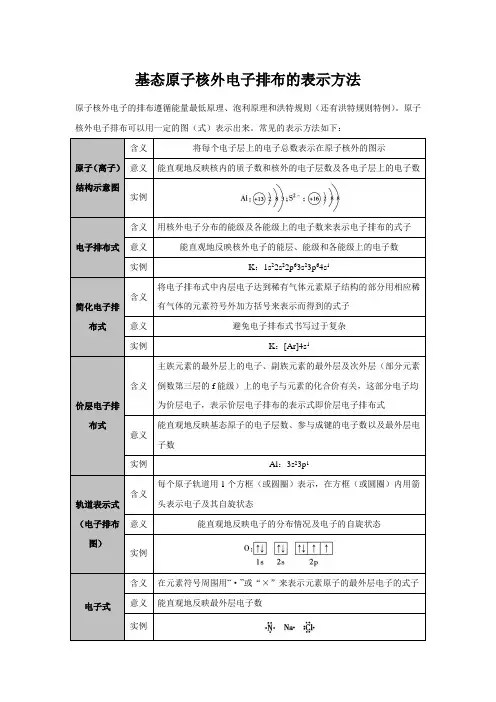
基态原子核外电子排布的表示方法
原子核外电子的排布遵循能量最低原理、泡利原理和洪特规则(还有洪特规则特例)。
原子核外电子排布可以用一定的图(式)表示出来。
常见的表示方法如下:
注意
对这些图(式)的应用,要根据实际需要适当选择。
同时要知道可将这些图(式)应用于表示与某原子相对应的离子的核外电子排布。
典例详析
例6-25
下列表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
A.∶He B.C.1s2D.
解析◆A项只表示出最外层电子数,B项只表示出核外电子的分层排布情况,C项具体到能层、能级以及能级上的电子数,而D项包含了能层、能级以及原子轨道上电子的自旋状态。
答案◆D
点评◆电子式、原子结构示意图、电子排布式、价层电子排布式、轨道表示式均能反映原子结构,其中轨道表示式不仅能表示出原子的核外电子排布的能层、能级和原子轨道,还能表示出这些电子的自旋状态,对电子运动状态四个方面都进行了描述,最为详尽。
例6-26
下列电子排布式或轨道表示式正确的是
A.C的核外电子轨道表示式:
B.Ca的电子排布式:1s22s22p63s23p63d2
C.O的核外电子轨道表示式:
D.Br-的电子排布式:[Ar]3d104s24p6
解析◆A项中C的核外电子轨道表示式违背洪特规则,B项中Ca的电子排布式违背能量最低原理,C项中O的核外电子轨道表示式违背泡利原理,故选D。
答案◆D。


基态原子电子排布式1-36原子电子排布是指某一原子或原子核及其围绕着它的电子被分布在空间某一准确的位置上,它是原子结构中稳定状态的表现。
原子电子排布是一种量子统计学理论,通过能量状态对原子作用,被证明有可能实现量子状态下的原子的最低能量状态的基态,从而形成特定的电子排布。
以一种基态的电子排布来说,该竖向横向由子层,内子层和外子层组成,一般可以分为十字形和十字形的电子排布式。
一种基态的电子排布,可以从下表中得知:|主子层(K)| 1s²|| 2s²2p³||内子层(L)| 3s²3p³|| 4s²3d¹⁰||外子层(M)| 5s²4p⁴|| 6s²4d¹⁰5p⁶||7s²5d¹⁰6p⁶|这就是1-36元素基态原子电子排布式:1. H:1s¹2. He:1s²3. Li:[He]2s¹4. Be:[He]2s²5. B:[He]2s²2p¹6. C:[He]2s²2p²7. N:[He]2s²2p³8. O:[He]2s²2p⁴9. F:[He]2s²2p⁵10. Ne:[He]2s²2p⁶11. Na:[Ne]3s¹12. Mg:[Ne]3s²13. Al:[Ne]3s²3p¹14. Si:[Ne]3s²3p²15. P:[Ne]3s²3p³16. S:[Ne]3s²3p⁴17. Cl:[Ne]3s²3p⁵18. Ar:[Ne]3s²3p⁶19. K:[Ar]4s¹20. Ca:[Ar]4s²21. Sc:[Ar]3d¹4s²22. Ti:[Ar]3d²4s²23. V:[Ar]3d³4s²24. Cr:[Ar]3d⁴4s²25. Mn:[Ar]3d⁵4s²26. Fe:[Ar]3d⁶4s²27. Co:[Ar]3d⁷4s²28. Ni:[Ar]3d⁸4s²29. Cu:[Ar]3d⁹4s²30. Zn:[Ar]3d¹⁰4s²31. Ga:[Ar]3d¹⁰4s²4p¹32. Ge:[Ar]3d¹⁰4s²4p²33. As:[Ar]3d¹⁰4s²4p³34. Se:[Ar]3d¹⁰4s²4p⁴35. Br:[Ar]3d¹⁰4s²4p⁵36. Kr:[Ar]3d¹⁰4s²4p⁶以上就是1-36元素基态原子电子排布式,它是由不同能级上的子层来组成,包含主子层(K)、内子层(L)和外子层(M),每个子层中都有自己特有的分级电子排布式。



《基态原子的核外电子排布原则》知识清单在化学的微观世界里,原子是构成物质的基本单元。
而基态原子的核外电子排布遵循着一系列特定的原则,这些原则对于理解原子的结构、性质以及元素周期表的规律都具有至关重要的意义。
一、能量最低原理能量最低原理是核外电子排布的首要原则。
简单来说,就是电子在排布时会优先占据能量较低的轨道,以使整个原子的能量处于最低状态。
就像一个人在选择座位时,总是倾向于先坐空着的、更舒适的位置。
为什么要遵循这个原理呢?这是因为处于能量最低状态的原子更加稳定。
想象一下,一个不稳定的原子就像一个摇摇欲坠的建筑,随时可能发生变化,而处于能量最低状态的原子则像是坚固的大厦,结构稳定。
在多电子原子中,轨道的能量是不同的。
一般来说,离原子核越近的轨道能量越低。
比如,1s 轨道的能量低于 2s 轨道,2s 轨道的能量又低于 2p 轨道。
二、泡利不相容原理泡利不相容原理指出,在同一个原子中,不可能有两个电子具有完全相同的四个量子数。
量子数是描述电子状态的一组参数,包括主量子数、角量子数、磁量子数和自旋量子数。
这就好比在一个教室里,每个座位都有其独特的坐标(行、列、楼层等),不可能有两个同学占据完全相同的座位。
由于泡利不相容原理的存在,每个轨道最多只能容纳两个电子,而且这两个电子的自旋方向必须相反。
自旋可以简单理解为电子的一种内禀属性,就像人的左右手一样,要么是“左手”,要么是“右手”。
三、洪特规则洪特规则进一步补充了电子在等价轨道(能量相同的轨道)上的排布方式。
当电子排布在等价轨道上时,会优先以相同的自旋状态分别占据不同的轨道,而且全充满、半充满和全空的状态相对更加稳定。
例如,对于氮原子(N),其电子排布式为 1s² 2s² 2p³。
2p 轨道有三个等价轨道,按照洪特规则,三个电子会分别占据三个 2p 轨道,并且自旋相同。
再比如,铬原子(Cr)的电子排布式为 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁵ 4s¹,而不是 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁴ 4s²。

ni基态核外电子排布式
Ni(单质号28) 的核外电子排布式为[Ar]3d8 4s2,当只考虑价外电子时,Ni
的原子结构属于非常典型的d8框架,这表明Ni元素具有高度的相对化学稳定性。
该核外电子排布式表明Ni有8个外面电子,其分别位于3d轨道中。
每个3d
轨道容下最多6个电子,但Ni原子只有8个外面电子,因此d轨道只有半填充。
此外,Ni还有2个4s轨道电子,由于4s轨道在能量上比3d轨道低,因此,4s轨道电子在d-轨道电子围绕原子核非常外围,构成“过渡”格式。
另外,Ni的外面电子能够以自由正电子的形式存在,因此具备界面离子反应
的特性。
而d轨道的差空结构由于空间对称性的原因,可以使Ni能更好地与其它
物质发生反应,周围的分子或另一个Ni元素容易与Ni发生化学键的形成,进而能够很好的催化反应的过程。
因此,Ni的核外电子排布式[Ar]3d8 4s2 ,既保证了Ni的高度可化学归属性,又拥有许多特殊性质,对Ni在各种物理和化学上的应用具有重要意义。

基态原子的核外电子排布式现代化学的发展,赋予了人们更强大的能力来理解原子,其中主要表现在基态原子的核外电子排布式(Electron Configuration of Ground State Atoms)。
为了理解基态原子的核外电子排布式,首先需要介绍原子模型。
原子模型是对原子结构的简单抽象。
根据原子模型,原子由核心和核外电子组成。
核心由质子和中子组成,而核外电子则以不同的层次存在于最外层的能级(energy levels)。
原子的基态是指核外电子具有最低的能量时的构型。
基态原子的核外电子排布式,也就是欧拉模型(Euler model)。
欧拉模型的基本原理是,原子的基态是由核外电子依据欧拉法则(Euler rules)所组成并分配到最大数量各不相同的能级(energy levels)中。
欧拉法则概述如下:(1)原子的基态中最多有2n2个电子,其中n是能级的数量。
(2)具有半不可见(half-filled)能级的原子拥有最低的能量状态,例如具有4个能级的原子,其最低能量状态应拥有8个电子。
(3)每个能级只能容纳有限数量的电子。
基于欧拉模型,原子的基态可以通过轨道标记(orbital notation)表示。
轨道标记是一种结构式表示法,可以简洁而清晰地显示原子的基态构型。
轨道标记的基本结构如下:原子标记:子序数轨道标记:径r,(n,, m),电子数其中原子标记指原子序数,轨道标记指半径(Radius)、量子数(Quantum Number)和电子数,其中半径表示由核到轨道的距离,量子数表示轨道的大小和形状,而电子数表示轨道内电子的个数。
欧拉模型是一种比较简单的原子模型,可以用来表示基态原子的核外电子排布式。
但它有一些局限性,亦即欧拉模型只能用来描述原子的基本构型,而不能满足原子在分子和化学反应中的行为描述。
因此,必须根据轨道类型来建立高级模型,才能更好地描述原子在分子和化学反应中的行为。
综上所述,基态原子的核外电子排布式是现代化学研究的重要组成部分。

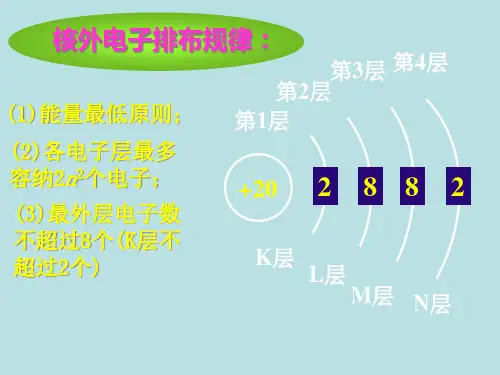
第3课时 原子核外电子排布规则[目标定位] 知道原子核外电子排布的“两原理一规则”,会正确书写原子的电子排布式和电子排布图。
一、基态原子核外电子的排布原则 1.能量最低原理原子核外的电子应优先排布在能量最低的能级里,然后由里到外,依次排布在能量逐渐升高的能级里。
能级的能量高低顺序如构造原理所示(对于1~36号元素来说,应重点掌握和记忆“1s →2s →2p →3s →3p →4s →3d →4p ”这一顺序)。
2.泡利原理(1)在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,这一原理被称为泡利原理。
(2)因为每个原子轨道最多只能容纳 2个电子且自旋方向相反,所以从能层、能级、原子轨道、自旋方向四个方面来说明电子的运动状态是不可能有两个完全相同的电子的。
如氟原子的电子排布可表示为1s 22s 22p 2x 2p 2y 2p 1z ,由于各原子轨道中的电子自旋方向相反,所以9个电子的运动状态互不相同。
3.洪特规则(1)在相同能量的原子轨道上,电子的排布将尽可能占据不同的轨道,而且自旋方向相同,这就是洪特规则。
(2)通俗地说,洪特规则可以表述为电子总是尽量自旋平行地分占不同的轨道。
如碳原子的电子排布图是,而不是。
(3)洪特规则的特例在等价轨道(同一能级)上的电子排布处于全充满、半充满和全空状态时,具有较低的能量和较大的稳定性。
相对稳定的状态⎩⎪⎨⎪⎧全充满:p 6、d 10、f 14全空:p 0、d 0、f 0半充满:p 3、d 5、f 7如24Cr 的电子排布式为1s 22s 22p 63s 23p 63d 54s 1,为半充满状态,易错写为1s 22s 22p 63s 23p 63d 44s 2。
原子核外电子排布“两原理一规则”(1)能量最低原理:电子在原子轨道上的分布要尽可能地使原子的能量最低。
(2)泡利原理:每个原子轨道最多容纳两个电子且自旋方向必须相反。
(3)洪特规则:当电子排布在同一能级(能量相同)的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相同。
基态原子的核外电子排布式一、原子核外电子排布1. 原子核外电子排布是指原子核和原子外围电子之间的排布关系。
根据简单的假设,这种排布使原子和混合物等具有平衡状态,具有固定的室温和压力,这也是物质结构、性质及属性的形成和总体行为由来。
2. 原子核外电子排布按照要素研究分为基态排布、禁忌排布和衍生排布3类,其中基态排布是原子能够处于最稳定的电子排布方式。
3. 基态原子的核外电子排布是指原子外围存在最少数量的电子,使它能够大致保持势能最低的形态,处于势能或受能的最低状态,从而达到极稳定的状态。
4. 基态原子的核外电子排布是由原子核周围使用电子能量谱所对应的轨道构成的,它们中每一个轨道中都只可以存在有限数量的电子,而轨道中电子的数量和其他能级的邻近有很大的关系。
5. 基态原子的核外电子排布是根据原子核电荷和电子数目规律以及原子表规律来确定的,它是由电子能量级所确定,表现出量子数的层次和空间排列关系。
6. 根据Gustav Heesterman的原子理论,基态原子的核外电子排布是由原子的零能级和其他质量级确定的,因此,原子的基态排布在原子结构中是十分重要的。
7. 基态原子的核外电子排布可通过X射线衍射、电子构像、原子内荷电特性以及反射性等方法进行实验测定,以此来确定原子的基态排布安排。
二、基态排布的特征1. 基态排布的最重要的特征在于,它是原子处于最稳定的电子排布形式,即多数情况下原子与相邻原子的位置与受能不变,从而形成一种稳定的排布方式。
2. 由于原子的基态排布受到原子核的影响,所以它也受到核外电子与原子核的重力作用,从而产生了一种原子结构,形成了各种物质形态。
3. 原子基态排布与原子各种能量级有关系,比如说在原子基态排布时,原子核与外围电子的能量在一定程度上取决于外围电子的排布安排,因此基态排布也可以用来调节原子的能量级。
4. 在原子的基态排布中,原子中的电子处于极低能级,而原子核却处于最高能级,这也导致基态排布具有较低的热稳定性,所以它在热力学反应中非常具有重要性,其作用也特别强大。
基态 cr 原子的核外电子排布式
铬元素(Chrome,Cr)是一种由原子序数为24的半金属
元素。
这种元素的原子结构是由24个外电子组成的,它们分
布在3d、4s和4p电子层中。
其中,3d层有5个电子,4s层
有2个电子,4p层有7个电子。
铬的基态原子的核外电子排布可以把它的电子分为3个层:1s、2s和2p。
这三个层分别拥有2、2和6个电子,因此,铬元素的原子的核外电子排布式可以表述为1s2 2s2 2p6。
铬元素的1s2 2s2 2p6的排布式,允许铬原子之间发生
范德华力。
与其它有4个氧原子的元素一起,铬可以以连接二次方程式形成不同的化合物,比如CrO2、Cr2O3等等。
除此之外,铬元素在冶金制造中也常被使用,它可以增加钢的硬度和耐热性。
在化学领域,铬的核外电子排布式1s2 2s2 2p6是非常
重要的,它可以阐明铬原子的电子占据模式、原子核之间的作用力以及铬原子能够与其他元素的反应。
总的来说,原子的核外电子排布式是揭示元素自身性质
的基础,其研究也极为重要,以便了解它们之间的电子作用以及能量以及物质学有关的物理性质和化学性质有何关系。
铬元素的基态原子的核外电子排布式1s2 2s2 2p6拥有这样的作用,为我们深入研究原子结构提供了重要的参考。
基态se原子的核外电子排布式
1、Se原子的原子性质:
Se原子是一种化学元素,其原子序数为34,原子量为78.96,熔点为222.15℃,沸点为451.4℃,是元素周期表中第六组十六族的硫元素,是金属性元素,拥有高度化学活性,有橙黄色表面熔融态,有着强烈的气味,能被水和酸性物质腐蚀,在焙烧后可以出现纯净的红灰色。
2、Se原子的核外电子排布式:
Se原子的核外电子排布式为[Ar]3d10 4s2 4p4,它有34个电子,以的Shell层次分别排布如下:
K 层:2个电子
L 层:8个电子
M 层:18个电子
N 层:6个电子。
Se原子的能级可分为2s,2px,2py,2pz,3dxy,3dxz,3dyz 共六层,分别排布34个电子,2s层排布2个电子,2px,2py,2pz每个层都排布2个电子,3dxy,3dxz,3dyz每个层排布5个电子,共计 34个电子,2s层只能排布2个电子,3d层只能排布15个电子,4p层只能排布6个电子。
3、Se原子的化学性质:
Se原子具有极强的氧化性、还原性和毒性等化学性质,并且已经被应用于地质勘查、矿业开采以及农业等领域。
它属于金属元素,其耐腐蚀性强,主要用于制造许多金属产品,比如低温軸承、柴油机部件、工业电灯和陶瓷涂敷粉末等。
此外,它也被广泛用于玻璃抛光机和涂料,以增强玻璃反射功能和防护涂层的高度性质。
写出下列元素基态原子的电子排布式:
(1)O
(2)Ne
(3)S
(4)Cr
(5)Cu
(6)Ge
考点:原子核外电子排布
专题:原子组成与结构专题
分析:根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写.
解答:解:(1)O元素为8号元素,原子核外有8个电子,所以核外电子排布式为:1s22s22p4,故答案为:1s22s22p4;
(2)Ne元素为10号元素,原子核外有10个电子,所以核外电子排布式为:1s22s22p6,故答案为:
1s22s22p6;
(3)S元素为16号元素,原子核外有16个电子,所以核外电子排布式为:1s22s22p63s23p4,故答案为:1s22s22p63s23p4;
(4)Cr元素为24号元素,原子核外有24个电子,所以核外电子排布式为:1s22s22p63s23p63d54s1,故答案为:1s22s22p63s23p63d54s1;
(5)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(6)Ge元素为32号元素,原子核外有35个电子,所以核外电子排布式为:1s22s22p63s23p63d104s24p2,故答案为:1s22s22p63s23p63d104s24p2.
点评:本题考查了基态原子的核外电子排布式,根据核外电子排布规律来写,题目难度一般.。