基态电子排布
- 格式:ppt
- 大小:429.00 KB
- 文档页数:25
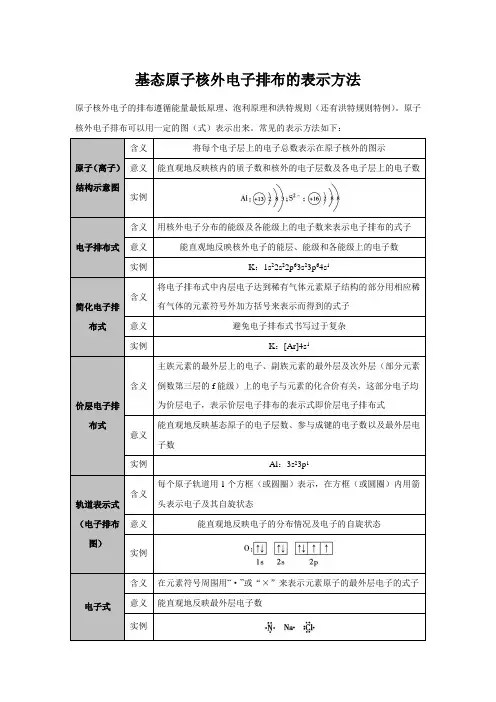
基态原子核外电子排布的表示方法
原子核外电子的排布遵循能量最低原理、泡利原理和洪特规则(还有洪特规则特例)。
原子核外电子排布可以用一定的图(式)表示出来。
常见的表示方法如下:
注意
对这些图(式)的应用,要根据实际需要适当选择。
同时要知道可将这些图(式)应用于表示与某原子相对应的离子的核外电子排布。
典例详析
例6-25
下列表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
A.∶He B.C.1s2D.
解析◆A项只表示出最外层电子数,B项只表示出核外电子的分层排布情况,C项具体到能层、能级以及能级上的电子数,而D项包含了能层、能级以及原子轨道上电子的自旋状态。
答案◆D
点评◆电子式、原子结构示意图、电子排布式、价层电子排布式、轨道表示式均能反映原子结构,其中轨道表示式不仅能表示出原子的核外电子排布的能层、能级和原子轨道,还能表示出这些电子的自旋状态,对电子运动状态四个方面都进行了描述,最为详尽。
例6-26
下列电子排布式或轨道表示式正确的是
A.C的核外电子轨道表示式:
B.Ca的电子排布式:1s22s22p63s23p63d2
C.O的核外电子轨道表示式:
D.Br-的电子排布式:[Ar]3d104s24p6
解析◆A项中C的核外电子轨道表示式违背洪特规则,B项中Ca的电子排布式违背能量最低原理,C项中O的核外电子轨道表示式违背泡利原理,故选D。
答案◆D。



《基态原子的核外电子排布原则》讲义在探索物质世界的微观奥秘时,理解基态原子的核外电子排布原则是至关重要的。
这不仅是化学学科的基础,也是我们深入认识物质性质和化学反应的关键。
一、能量最低原理能量最低原理是核外电子排布的首要原则。
简单来说,电子总是优先占据能量最低的轨道,以使整个原子的能量处于最低状态。
这就好比我们在日常生活中,总是倾向于选择最省力、最舒适的方式来做事。
原子中的电子轨道具有不同的能量级别。
例如,1s 轨道的能量低于2s 轨道,2s 轨道的能量又低于 2p 轨道。
当原子中的电子进行排布时,它们会先填满能量较低的轨道,然后再依次进入能量较高的轨道。
为什么要遵循能量最低原理呢?这是因为处于能量最低状态的原子更加稳定。
就像一个物体在低处比在高处更稳定一样,原子也倾向于处于能量最低的状态,以保持自身的稳定性。
举个例子,氢原子只有一个电子,这个电子会优先占据 1s 轨道。
对于多电子原子,如碳原子,其 6 个电子会先填满 1s 和 2s 轨道,然后再排布在 2p 轨道上。
二、泡利不相容原理泡利不相容原理指出,在同一个原子中,不可能有两个电子的四个量子数完全相同。
这意味着每个轨道最多只能容纳两个电子,且这两个电子的自旋方向必须相反。
量子数是描述电子状态的一组参数,包括主量子数、角量子数、磁量子数和自旋量子数。
主量子数决定了电子所在的电子层,角量子数决定了电子所在的亚层,磁量子数决定了电子在亚层中的具体轨道,自旋量子数则描述了电子的自旋方向。
想象一下每个轨道就像一个小房间,房间里最多只能住两个“人”,而且这两个人必须“背靠背”,自旋方向相反。
如果有两个电子的量子数完全相同,就会违反泡利不相容原理。
例如,在 1s 轨道中,最多只能容纳两个电子,一个自旋向上,一个自旋向下。
三、洪特规则洪特规则是核外电子排布的另一个重要原则。
它指出,在等价轨道(相同能量的轨道)上,电子总是尽可能分占不同的轨道,且自旋平行。

基态原子电子排布式1-36原子电子排布是指某一原子或原子核及其围绕着它的电子被分布在空间某一准确的位置上,它是原子结构中稳定状态的表现。
原子电子排布是一种量子统计学理论,通过能量状态对原子作用,被证明有可能实现量子状态下的原子的最低能量状态的基态,从而形成特定的电子排布。
以一种基态的电子排布来说,该竖向横向由子层,内子层和外子层组成,一般可以分为十字形和十字形的电子排布式。
一种基态的电子排布,可以从下表中得知:|主子层(K)| 1s²|| 2s²2p³||内子层(L)| 3s²3p³|| 4s²3d¹⁰||外子层(M)| 5s²4p⁴|| 6s²4d¹⁰5p⁶||7s²5d¹⁰6p⁶|这就是1-36元素基态原子电子排布式:1. H:1s¹2. He:1s²3. Li:[He]2s¹4. Be:[He]2s²5. B:[He]2s²2p¹6. C:[He]2s²2p²7. N:[He]2s²2p³8. O:[He]2s²2p⁴9. F:[He]2s²2p⁵10. Ne:[He]2s²2p⁶11. Na:[Ne]3s¹12. Mg:[Ne]3s²13. Al:[Ne]3s²3p¹14. Si:[Ne]3s²3p²15. P:[Ne]3s²3p³16. S:[Ne]3s²3p⁴17. Cl:[Ne]3s²3p⁵18. Ar:[Ne]3s²3p⁶19. K:[Ar]4s¹20. Ca:[Ar]4s²21. Sc:[Ar]3d¹4s²22. Ti:[Ar]3d²4s²23. V:[Ar]3d³4s²24. Cr:[Ar]3d⁴4s²25. Mn:[Ar]3d⁵4s²26. Fe:[Ar]3d⁶4s²27. Co:[Ar]3d⁷4s²28. Ni:[Ar]3d⁸4s²29. Cu:[Ar]3d⁹4s²30. Zn:[Ar]3d¹⁰4s²31. Ga:[Ar]3d¹⁰4s²4p¹32. Ge:[Ar]3d¹⁰4s²4p²33. As:[Ar]3d¹⁰4s²4p³34. Se:[Ar]3d¹⁰4s²4p⁴35. Br:[Ar]3d¹⁰4s²4p⁵36. Kr:[Ar]3d¹⁰4s²4p⁶以上就是1-36元素基态原子电子排布式,它是由不同能级上的子层来组成,包含主子层(K)、内子层(L)和外子层(M),每个子层中都有自己特有的分级电子排布式。


写出下列元素基态原子的电子排布式:
(1)O
(2)Ne
(3)S
(4)Cr
(5)Cu
(6)Ge
考点:原子核外电子排布
专题:原子组成与结构专题
分析:根据元素符号,判断元素原子的核外电子数,再根据核外电子排布规律来写.
解答:解:(1)O元素为8号元素,原子核外有8个电子,所以核外电子排布式为:1s22s22p4,故答案为:1s22s22p4;
(2)Ne元素为10号元素,原子核外有10个电子,所以核外电子排布式为:1s22s22p6,故答案为:
1s22s22p6;
(3)S元素为16号元素,原子核外有16个电子,所以核外电子排布式为:1s22s22p63s23p4,故答案为:1s22s22p63s23p4;
(4)Cr元素为24号元素,原子核外有24个电子,所以核外电子排布式为:1s22s22p63s23p63d54s1,故答案为:1s22s22p63s23p63d54s1;
(5)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(6)Ge元素为32号元素,原子核外有35个电子,所以核外电子排布式为:1s22s22p63s23p63d104s24p2,故答案为:1s22s22p63s23p63d104s24p2.
点评:本题考查了基态原子的核外电子排布式,根据核外电子排布规律来写,题目难度一般.。



基态原子电子排布原则
⑴能量最低原理:电子在原子轨道中的排布,要尽可能使整个原子系统能量最低。
⑵Pauli不相容原理:同一原子轨道最多容纳两个自选方式相反的电子,或者说同一原子中不可能存在一组四个量子数完全相同的电子。
⑶Hund规则:在相同n或相同l的轨道上分布的电子,将尽可能分占m值不同的轨道且自旋平行医|学教|育网搜集整理。
S层最多容纳2个电子,p层最多容纳6个电子,d层最多容纳10个电子,f层最多容纳14个电子,g层最多容纳18个电子。
⑷全满半满最稳定。

1-36号元素基态原子核外电子排布式1到36号元素核外电子排布式是,H氢1s1,He氦1s2,Li锂1s2,2s1,Be铍1s2,2s2,B硼1s2,2s2,2p1,N氮,1s2,2s2,2p3,O氧,1s2,2s2,2p4,F氟,1s2,2s2,2p5,Ne氖,1s2,2s2,2p6,Na钠,1s2,2s2,2p6,3s1,Mg镁,1s2,2s2,2p6,3s2,Al铝,1s2,2s2,2p6,3s2,3p1,Si硅,1s2,2s2,2p6,3s2,3p2,P磷,1s2,2s2,2p6,3s2,3p3。
S硫,1s2,2s2,2p6,3s2,3p4,Cl氯,1s2,2s2,2p6,3s2,3p5,Ar氩,1s2,2s2,2p6 ,3s2,3p6,K钾,1s2,2s2,2p6,3s2,3p6,4s1,Ca钙,1s2,2s2,2p6,3s2,3p6,4s2,Sc钪,1s2,2s2,2p6,3s2,3p6,3d1,4s2,Ti钛,1s2,2s2,2p6,3s2,3p6,3d2,4s2,V 钒,1s2,2s2,2p6,3s2,3p6,3d3,4s2。
Cr铬,1s2,2s2,2p6,3s2,3p6,3d5,4s1,Mn锰,1s2,2s2,2p6,3s2,3p6,3d5,4s2,Fe铁,1s2,2s2,2p6,3s2,3p6,3d6,4s2,Co钴,1s2,2s2,2p6,3s2,3p6,3d7,4s2,Ni镍,1s2,2s2,2p6,3s2,3p6,3d8,4s2,Cu铜1s2 2s2 2p6 3s2 3p6 3d10 4s1,Zn锌,1s2,2s2,2p6,3s2,3p6,3d10,4s2。
Ga镓,1s2,2s2,2p6,3s2,3p6,3d10,4s2,4p1,Ge锗,1s2,2s2,2p6,3s2,3p6,3d10,4s2,4p2,As砷,1s2,2s2,2p6,3s2,3p6,3d10,4s2,4p3,Se硒,1s2,2s2,2p6,3s2,3p6,3,d10,4s2,4p4,Br溴,1s2,2s2,2p6,3s2,3p6,3d10,4s2,4p5,Kr氪,1s2,2s2,2p6,3s2,3p6,3d10,4s2,4p6。
基态原子价电子排布式
空气是由两种原子构成的–氧和氮。
它们的基态原子价电子排布式由两层电子组成:1s2和2s2 2p4。
两种原子的基态排布式都符合了能量最低的标准,它们各自都有八个电子,一层电子把外层完全填满,这样周围的其他离子和电子更容易结合。
氧的基态电子排布式为1s2 2s2 2p4,它的原子价位为6,所以它在无氧室内产生六个电子,因此所产生的化学物质会是混合性离子,原子团水和多羟基物质等。
总之,氧和氮的基态原子价电子排布式是由两层电子组成的,它们以较低的能量状态结合,在无氧室内可以形成混合性离子,原子团水和多羟基物质等,而在空气中可以形成一氧化氮,硫化氢和硝酸盐等化合物。
基态碳原子的电子排布式
基态碳原子的电子排布式为
A 、 1s 2 2s 2 2p x 2
B 、 1s 2 2s 2 2p y 2
C 、 1s 2 2 s 2 2p z 2
D 、 1s 2 2s 2 2p x 1 2p y 1
基态碳原子的电子排布式为 1s 2 2s 2 2p x 1 2p y 1
基态碳原子的基态电子是1s2 2s2 2p2,杂化时,2S上的两个电子中的1个被激发到2P的最后一个空轨道上,此时2s和2p总共4个轨道上各有一个电子,然后2S和一个2P杂化,形成2个sp杂化轨道,其上各有一个电子,以乙炔为例,这两个电子一个和氢原子形成一个"头对头"的sigma共价键,一个和另一个碳的一个sp杂化轨道上的电子形成一个sigma 共价键,剩下的两个P轨道上的电子与另一个碳的两个P轨道上的电子形成两个肩并肩的pai键.。
基态原子的电子排布式
原子是物质的最小组成单位,它们是由质子、中子和电子组成的,而电子是原子的基本结构。
基态原子的电子排布式就是指一个原子的基本电子排布,也就是电子在原子的外壳中的空间排布。
一般来说,基态原子的电子排布式有两种:一种是自由电子排布式,另一种是结合电子排布式。
自由电子排布式指的是原子中电子可以在任何层次上分布,而结合电子排布式则指电子在原子内部特定层次上分布。
首先,自由电子排布式是指原子中电子在不受外界影响的情况下,可以在任何层次上分布,即原子可以任意携带电子,而不受能量级别的限制。
一般来说,自由电子排布式只存在于稀薄的气体中,高能气体原子才能达到自由电子排布式。
自由电子排布式的原子只能在较低的能量状态中存在,由于它们的低能量,所以它们的电子排布式很稳定,不会改变。
其次,结合电子排布式是指电子在原子内特定层次上分布,这种排布方式是原子的高能状态,这种排布方式的电子排布式不稳定,它可以由外部因素影响而发生改变。
结合电子排布式的原子具有较高的能量,可以在较高的能量状态中存在,这种电子排布式的原子可以获得更多的电子,这些电子可以结合在一起,形成特殊的分子结构。
最后,基态原子的电子排布式是不断发展的,随着能量的改变,电子排布式也会发生改变,这也是原子的分子结构发生改变的原因。
因此,基态原子的电子排布式是一个复杂而重要的现象,对于研究物质结构有着重要的意义。