基态原子的核外电子排布讲解
- 格式:ppt
- 大小:274.00 KB
- 文档页数:22


基态原⼦的核外电⼦排布知识点讲解练习Word含解析第2节原⼦结构与元素周期表第1课时基态原⼦的核外电⼦排布1.了解基态原⼦的核外电⼦在原⼦轨道上的排布顺序。
2.掌握基态原⼦的核外电⼦排布规律,会书写常见元素(1~36号)原⼦的核外电⼦排布。
(重点)3.学会利⽤电⼦排布式、轨道表⽰式正确表⽰核外电⼦排布。
(难点)1.能量最低原则(1)基态原⼦的核外电⼦排布使整个原⼦体系的能量最低。
(2)基态原⼦的核外电⼦在原⼦轨道上的排列顺序:1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s……2.泡利不相容原理(1)⼀个原⼦轨道最多只能容纳两个电⼦,并且这两个电⼦的⾃旋⽅向必须相反;或者说,⼀个原⼦中不存在两个完全相同的电⼦。
(2)在原⼦中,每个电⼦层最多能容纳2n2个电⼦。
3.洪特规则(1)对于基态原⼦,电⼦在能量相同的轨道上排布时,应尽可能分占不同轨道并且⾃旋⽅向相同。
(2)能量相同的原⼦轨道在全充满(如d10)、半充满(如d5)和全空(如d0)状态时,体系的能量较低,原⼦较稳定。
如基态铬原⼦的核外电⼦排布式为1s22s22p63s23p63d54s1,基态铜原⼦的核外电⼦排布式为1s22s22p63s23p63d104s1。
4.电⼦数与电⼦层和能级的关系在原⼦中,每个电⼦层最多容纳2n2个电⼦,每个能级最多能容纳的电⼦数为其所包含的原⼦轨道数的2倍。
(1)原⼦轨道能量的相对⼤⼩为:E4s>E3d>E3p>E3s。
(×)(2)基态O原⼦电⼦排布式为:1s22s22p4。
(√)(3)Al原⼦核外有1个未成对电⼦。
(√)(4)2p能级上有2个未成对电⼦的元素只有碳。
(×)(5)基态铜原⼦:①1s22s22p63s23p63d94s2(×)②1s22s22p63s23p63d104s1(√)[合作·探究]原⼦核外电⼦排布规律[探究背景]根据基态原⼦核外电⼦排布原则可知每⼀层上的电⼦排布有⼀定的数值或数值范围。
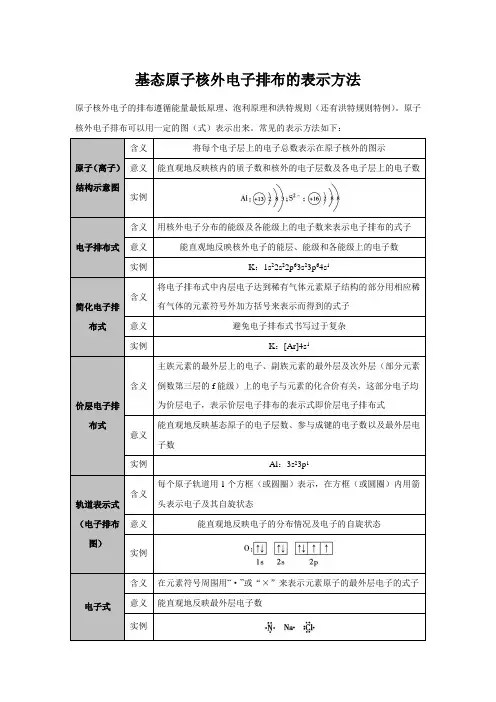
基态原子核外电子排布的表示方法
原子核外电子的排布遵循能量最低原理、泡利原理和洪特规则(还有洪特规则特例)。
原子核外电子排布可以用一定的图(式)表示出来。
常见的表示方法如下:
注意
对这些图(式)的应用,要根据实际需要适当选择。
同时要知道可将这些图(式)应用于表示与某原子相对应的离子的核外电子排布。
典例详析
例6-25
下列表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是
A.∶He B.C.1s2D.
解析◆A项只表示出最外层电子数,B项只表示出核外电子的分层排布情况,C项具体到能层、能级以及能级上的电子数,而D项包含了能层、能级以及原子轨道上电子的自旋状态。
答案◆D
点评◆电子式、原子结构示意图、电子排布式、价层电子排布式、轨道表示式均能反映原子结构,其中轨道表示式不仅能表示出原子的核外电子排布的能层、能级和原子轨道,还能表示出这些电子的自旋状态,对电子运动状态四个方面都进行了描述,最为详尽。
例6-26
下列电子排布式或轨道表示式正确的是
A.C的核外电子轨道表示式:
B.Ca的电子排布式:1s22s22p63s23p63d2
C.O的核外电子轨道表示式:
D.Br-的电子排布式:[Ar]3d104s24p6
解析◆A项中C的核外电子轨道表示式违背洪特规则,B项中Ca的电子排布式违背能量最低原理,C项中O的核外电子轨道表示式违背泡利原理,故选D。
答案◆D。


核外电子的分层排布规律:1、第一层不超过2个,第二层不超过8个;2、最外层不超过8个。
每层最多容纳电子数为2n2个(n代表电子层数),即第一层不超过2个,第二层不超过8个,第三层不超过18个;3、最外层电子数不超过8个(只有1个电子层时,最多可容纳2个电子)。
4、最低能量原理:电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。
5、泡利原理:每个原子轨道里最多只能容纳2个电子,且自旋状态相反。
6、洪特规则:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。
扩展资料一、核外电子排布与元素性质的关系1、金属元素原子的最外层电子数一般小于4,较易失去电子,形成阳离子,表现出还原性,在化合物中显正化合价。
2、非金属元素原子的最外层电子数一般大于或等于4,较易获得电子,活泼非金属原子易形成阴离子。
在化合物中主要显负化合价。
3、稀有气体元素的原子最外层为8电子(氦为2电子)稳定结构,不易失去或得到电子,通常表现为0价。
4、核外电子排布的几条规律之间既相互独立又相互统一,不能孤立地应用其中一条,如当M层不是最外层时,最多排布的电子数为2×32=18个,而当M 层是最外层时,则最多只能排布8个电子。
5、书写原子结构示意图时要注意审题和书写规范:看清是原子还是离子结构示意图,勿忘记原子核内的“+”号。
二、1~18号元素原子结构的特征1、原子核中无中子的原子:H。
2、最外层有1个电子的元素:H、Li、Na。
3、最外层有2个电子的元素:Be、Mg、He。
4、最外层电子数等于次外层电子数的元素:Be、Ar。
5、最外层电子数是次外层电子数2倍的元素:C;是次外层3倍的元素:O;是次外层4倍的元素:Ne。
6、电子层数与最外层电子数相等的元素:H、Be、Al。
7、电子总数为最外层电子数2倍的元素:Be。
8、次外层电子数是最外层电子数2倍的元素:Li、Si。

原子的核外电子的排布规律
人类对于原子的核外电子的排布有了非常深入的研究,科学家们发现,原子的核外电子有特定的排布规律。
下文将就这一规律进行论述。
首先,原子的核外电子有两个很重要的排布规则:电子层次规则和电子构型规则。
电子层次规则指的是电子按照能级从低到高排布,即最外层的电子能级最低,往里深入,能级渐高。
电子构型规则则是指每一层的电子的排布有一定的规则,这又叫做电子云模型。
电子云模型主要分为三类:s、p、d型电子云模型。
s型电子云模型最简单,只有s轨道,可以容纳最多2个电子;p型和d型电子云模型会有由3s、3p、3d、4s、4p、4d等共6条轨道组成,并有8个电子容纳。
此外,为了避免相互碰撞,电子必须满足hund规则,即同一层的电子按照MSM规则排布,M指单电子,S指双电子,M排在S前面,轨道上的电子会尽量把能级填满。
最后,当某个原子的电子层数超过6层时,开始出现f型电子云模型,f型电子云模型共有7条轨道,并有18个电子容纳,遵循同样的hund规则,满足不发生碰撞的原则。
综上所述,原子的核外电子排布有其独特的规律,包括电子层次规则、电子构型规则,以及hund规则。
这些规律是由不同的核外电子模型、每个轨道可以容纳电子的数量及能级决定的。
深入研究原子的核外电子排布规律,有利于深入洞察物质的本质,为进一步研究物
质性质及其行为带来启发。
总之,原子的核外电子的排布规律具有重要的科学意义。
只要深入的去研究,我们就可以更好地了解物质的本质,以及物质之间的相互作用。



第2课时基态原子的核外电子排布原子轨道1.知道原子的基态和激发态的含义。
2.初步知道原子核外电子的跃迁、吸收和发射光谱,了解其简单应用。
3.了解电子云和原子轨道的含义。
4.知道原子核外电子的排布遵循能量最低原理。
5.了解泡利原理和洪特规则。
基态与激发态、光谱[学生用书P4]1.基态原子与激发态原子2.原子光谱不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱。
3.光谱分析:在现代化学中,利用原子光谱上的特征谱线来鉴定元素的分析方法。
1.下列关于同一原子中的基态和激发态说法中,正确的是()A.基态时的能量比激发态时高B.激发态时比较稳定C.由基态转化为激发态过程中吸收能量D.电子仅在激发态跃迁到基态时才会产生原子光谱解析:选C。
同一原子处于激发态时能量较高,较不稳定,A、B不正确。
电子从能量较低的基态跃迁到能量较高的激发态时,也会产生原子光谱,D不正确。
2.电子由3d能级跃迁至4p能级时,可通过光谱仪直接摄取()A.电子的运动轨迹图像B.原子的吸收光谱C.电子体积大小的图像D.原子的发射光谱解析:选B。
能量E(3d)<E(4p),故电子由3d能级跃迁至4p能级时,要吸收能量,形成吸收光谱。
光谱与光谱分析1.光谱形成的原因不同元素的原子发生跃迁时会吸收或释放不同的光。
2.光谱的分类发射光谱是暗色背景的明亮谱线,吸收光谱则是明亮背景的暗色谱线,两者谱线一一对应(见教材光谱图)。
3.光谱分析不同元素的原子光谱都是特定的,光谱图就像“指纹辨人”一样,可以辨别形成光谱的元素。
人们已用光谱分析方法发现了许多元素,如铯、铷、氦、镓、铟等元素。
下列说法中正确的是()A.焰色反应是化学变化B.基态碳原子的电子排布式是1s22s12p3C.焰色反应中观察到的特殊焰色是金属原子在电子从基态跃迁到激发态时产生的光谱谱线的颜色D.同一原子处于激发态时的能量一定大于其处于基态时的能量[解析]基态碳原子的电子排布式为1s22s22p2,B项不正确;焰色反应中观察到的特殊焰色是金属原子在电子从激发态跃迁到基态时产生的光谱谱线的颜色,焰色反应是物理变化,A、C项不正确。


《基态原子的核外电子排布原则》讲义在化学的世界里,理解基态原子的核外电子排布原则是探索物质性质和化学反应的基础。
这一知识领域不仅对于深入理解化学原理至关重要,也在众多实际应用中发挥着关键作用。
首先,我们来谈谈能量最低原理。
这个原理就像是在为电子们找“最舒服”的位置。
简单来说,电子总是优先占据能量较低的轨道,就好比我们在生活中总是倾向选择更轻松、更省力的方式做事。
为什么会这样呢?这是因为能量越低的状态越稳定。
想象一下,一个小球在山坡上,它总是会滚到山谷,因为山谷的位置能量更低,更稳定。
对于原子中的电子也是如此,它们会尽可能地占据能量低的轨道,以达到整个原子系统的稳定状态。
泡利不相容原理也是一个关键原则。
每个原子轨道最多只能容纳两个电子,而且这两个电子的自旋方向必须相反。
可以把原子轨道想象成一个小房间,这个房间最多只能住两个人,而且这两个人还得“背靠背”睡,这样才能保证房间的秩序和稳定。
如果违反了这个原理,就会导致电子排布的混乱,进而影响原子的性质和化学反应。
洪特规则则进一步细化了电子在等价轨道上的排布方式。
当电子排布在等价轨道上时,它们会尽量分占不同的轨道,并且保持自旋相同。
这就好比一群小朋友在玩抢座位的游戏,大家都想自己有个单独的座位,而不是挤在一起。
这样的排布方式能够使原子的能量更低,更加稳定。
我们通过具体的例子来更好地理解这些原则。
以碳原子为例,其原子序数为 6,核外有 6 个电子。
按照能量最低原理,电子会先填充 1s轨道,然后是 2s 轨道。
1s 轨道能容纳 2 个电子,2s 轨道也能容纳 2 个电子,此时还剩下 2 个电子。
根据洪特规则,这 2 个电子会分别填充到两个 2p 轨道中,并且自旋相同。
再来看铬原子,原子序数为 24。
按照正常的填充顺序,应该是先填充 4s 轨道,然后再填充 3d 轨道。
但实际上,铬原子的电子排布是 3d轨道半充满,即 1 个 4s 电子跃迁到了 3d 轨道,形成了 3d⁵4s¹的排布方式。
第3课时 原子核外电子排布规则[目标定位] 知道原子核外电子排布的“两原理一规则”,会正确书写原子的电子排布式和电子排布图。
一、基态原子核外电子的排布原则 1.能量最低原理原子核外的电子应优先排布在能量最低的能级里,然后由里到外,依次排布在能量逐渐升高的能级里。
能级的能量高低顺序如构造原理所示(对于1~36号元素来说,应重点掌握和记忆“1s →2s →2p →3s →3p →4s →3d →4p ”这一顺序)。
2.泡利原理(1)在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋状态相反,这一原理被称为泡利原理。
(2)因为每个原子轨道最多只能容纳 2个电子且自旋方向相反,所以从能层、能级、原子轨道、自旋方向四个方面来说明电子的运动状态是不可能有两个完全相同的电子的。
如氟原子的电子排布可表示为1s 22s 22p 2x 2p 2y 2p 1z ,由于各原子轨道中的电子自旋方向相反,所以9个电子的运动状态互不相同。
3.洪特规则(1)在相同能量的原子轨道上,电子的排布将尽可能占据不同的轨道,而且自旋方向相同,这就是洪特规则。
(2)通俗地说,洪特规则可以表述为电子总是尽量自旋平行地分占不同的轨道。
如碳原子的电子排布图是,而不是。
(3)洪特规则的特例在等价轨道(同一能级)上的电子排布处于全充满、半充满和全空状态时,具有较低的能量和较大的稳定性。
相对稳定的状态⎩⎪⎨⎪⎧全充满:p 6、d 10、f 14全空:p 0、d 0、f 0半充满:p 3、d 5、f 7如24Cr 的电子排布式为1s 22s 22p 63s 23p 63d 54s 1,为半充满状态,易错写为1s 22s 22p 63s 23p 63d 44s 2。
原子核外电子排布“两原理一规则”(1)能量最低原理:电子在原子轨道上的分布要尽可能地使原子的能量最低。
(2)泡利原理:每个原子轨道最多容纳两个电子且自旋方向必须相反。
(3)洪特规则:当电子排布在同一能级(能量相同)的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相同。
基态原子的核外电子排布式一、原子核外电子排布1. 原子核外电子排布是指原子核和原子外围电子之间的排布关系。
根据简单的假设,这种排布使原子和混合物等具有平衡状态,具有固定的室温和压力,这也是物质结构、性质及属性的形成和总体行为由来。
2. 原子核外电子排布按照要素研究分为基态排布、禁忌排布和衍生排布3类,其中基态排布是原子能够处于最稳定的电子排布方式。
3. 基态原子的核外电子排布是指原子外围存在最少数量的电子,使它能够大致保持势能最低的形态,处于势能或受能的最低状态,从而达到极稳定的状态。
4. 基态原子的核外电子排布是由原子核周围使用电子能量谱所对应的轨道构成的,它们中每一个轨道中都只可以存在有限数量的电子,而轨道中电子的数量和其他能级的邻近有很大的关系。
5. 基态原子的核外电子排布是根据原子核电荷和电子数目规律以及原子表规律来确定的,它是由电子能量级所确定,表现出量子数的层次和空间排列关系。
6. 根据Gustav Heesterman的原子理论,基态原子的核外电子排布是由原子的零能级和其他质量级确定的,因此,原子的基态排布在原子结构中是十分重要的。
7. 基态原子的核外电子排布可通过X射线衍射、电子构像、原子内荷电特性以及反射性等方法进行实验测定,以此来确定原子的基态排布安排。
二、基态排布的特征1. 基态排布的最重要的特征在于,它是原子处于最稳定的电子排布形式,即多数情况下原子与相邻原子的位置与受能不变,从而形成一种稳定的排布方式。
2. 由于原子的基态排布受到原子核的影响,所以它也受到核外电子与原子核的重力作用,从而产生了一种原子结构,形成了各种物质形态。
3. 原子基态排布与原子各种能量级有关系,比如说在原子基态排布时,原子核与外围电子的能量在一定程度上取决于外围电子的排布安排,因此基态排布也可以用来调节原子的能量级。
4. 在原子的基态排布中,原子中的电子处于极低能级,而原子核却处于最高能级,这也导致基态排布具有较低的热稳定性,所以它在热力学反应中非常具有重要性,其作用也特别强大。
基态原子的核外电子运动状态原子核外电子运动状态是指原子核外电子的能量和动量分布。
它是一个重要的物理概念,广泛应用于化学和物理学中。
在化学反应过程中,原子核外电子的运动状态是决定化学性质的关键因素。
原子核外电子的运动状态可以用量子力学来表示,它可以被划分为基态,也可以被划分为激发态。
基态是由最低能量组成的原子核外电子状态,它是原子核外电子最安静的状态,也是最常见的状态。
激发态是指原子核外电子脱离基态,由更高能量组成的状态,它是原子核外电子最活跃的状态,是化学反应的关键因素。
当原子核外电子的能量高于基态时,它们就处在激发态。
激发态的电子能量一般分布在原子核外部,而基态的电子能量则偏向原子核内部。
此外,激发态的电子动量要大于基态,因此它们拥有更多的运动能量,可以更快地进行化学反应。
原子核外电子的运动状态影响着原子核外电子在化学反应中的能量转移状态。
当原子核外电子以激发态显示时,它们可以与其他原子核外电子靠近,从而改变原子核外电子的能量分布,从而影响化学反应的结果。
原子核外电子的运动状态是化学反应的关键因素,但是,它们的运动状态也受到原子核外电子的粒子属性的影响,如质量、电荷和自旋等。
这些粒子属性决定了原子核外电子的运动状态,从而影响化学反应的特性。
由于原子核外电子的运动状态受到许多因素的影响,因此,在研究化学反应时,必须综合考虑原子核外电子的运动状态。
总之,原子核外电子的运动状态是一个重要的物理概念,它可以用量子力学来表示,并可以被划分为基态和激发态。
原子核外电子的运动状态和粒子属性都决定了其在化学反应中的能量转移状态,因此,在研究化学反应时,必须综合考虑原子核外电子的运动状态。
钠基态原子核外电子排布式
《钠基态原子核外电子排布式》
钠是一种金属元素,原子序数为11,其原子核外电子排布式为1s2 2s2 2p6 3s1,其中1s2表示钠原子核外有2个电子排布在1s轨道上,2s2表示钠原子核外有2个电子排布在2s轨道上,2p6表示钠原子核外有6个电子排布在2p轨道上,3s1表示钠原子核外有1个电子排布在3s轨道上。
由此可知,钠原子核外一共有11个电子,即其原子序数。
钠原子核外电子排布式的完整表示为:1s2 2s2 2p6 3s1,其中1s2表示钠原子核外有2个电子排布在1s轨道上,2s2表示钠原子核外有2个电子排布在2s轨道上,2p6表示钠原子核外有6个电子排布在2p轨道上,3s1表示钠原子核外有1个电子排布在3s轨道上。
因此,钠基态原子核外电子排布式为1s2 2s2 2p6 3s1,其中1s2表示2个电子排布在1s轨道上,2s2表示2个电子排布在2s轨道上,2p6表示6个电子排布在2p轨道上,3s1表示1个电子排布在3s轨道上,共11个电子,即其原子序数。