最新化疗药物常见心脏毒性
- 格式:pdf
- 大小:3.15 MB
- 文档页数:16

氮芥:1.该药胃肠道反应和骨髓抑制症状较明显,眩晕、耳聋、皮疹、脱发等症状少见。
2.注意注射时防止外溢出静脉,不成静脉滴注。
3.孕妇、肝肾功能不良及血象低下者慎用。
环磷酰胺(环磷氮芥、癌得星、CTX):1.较罕见的不良反应为骨髓抑制、脱发、口腔炎、及胃肠道反应,少数患者可出现过敏性皮炎、视力模糊、可逆性精子低下等;剂量过大时可引起心肌病变和肾毒型;肝肾功能不良可加重该药毒性。
2.巴比妥类、皮质激素、别嘌醇等药物对该药代谢、活性和毒性均有影响。
3.肝肾功能不良者慎用;明显恶液质者、孕妇忌用。
4.注意用药期间严密观察血象。
一般不必于腹腔内注射。
5.该药应防止高热及日光照射。
氮甲:注意用药期间严密观察血象。
苯丙氨酸氮芥(马法兰、美法仑):1.不良反应主要有消化道反应和骨髓抑制;动脉灌注会引起水肿、神经毒性、皮肤起疱等。
2.注意用药期间严密观察血象,根据血象调整剂量。
硝卡芥(消瘤芥):注意用药期间严密观察血象。
塞替派(三胺硫磷、TSPA、TESPA):1.不良反应为骨髓抑制、消化道反应、男性无精子、女性无月经、发热、皮疹等。
2.与琥珀胆碱合用可引起呼吸困难;与尿激酶合用可提高该药治疗膀胱癌的作用;该药可增加血尿酸水平。
3.有痛风病史、肝肾功能损害、泌尿系结石患者慎用。
孕妇禁用。
4.注意用药期间严密观察血象,稀释后如发现混浊不得使用。
白消安(马利兰、二甲磺酸丁酯、白血福恩、米埃罗生):1.不良反应为消化道反应、骨髓抑制;偶有肺纤维化、头昏、面红、男性乳房发育、女性闭经、皮肤色素沉着、甚至出现畸形胎儿,大剂量可引起再生障碍性贫血。
2.注意用药期间严密观察血象。
急性白血病和再生障碍性贫血或出血性疾病患者忌用,孕妇禁用,肾上腺皮质功能不全患者慎用。
司莫司汀(甲环亚硝脲、甲基-CCNU):1.不良反应为消化道反应、迟发性骨髓抑制、肝肾毒性(长期大剂量使用可致肾脏萎缩)。
2.用药期间严格检查血象,药物应在8ºC以下保管。

2023年高危险药物一览高危险药物是指在生产、使用、处理或处置过程中可能对人员、设备或环境造成严重伤害或破坏的药物。
这些药物通常具有毒性、腐蚀性、感染性、易燃性、爆炸性或放射性等特点。
本文档旨在提供一个关于2023年高危险药物的详细列表,以帮助医疗机构、药品管理人员和医务人员更好地了解和管理这些药物。
高危险药物列表以下是一些常见的高危险药物及其特性:1. 阿霉素(Doxorubicin):一种放射性化疗药物,具有心脏毒性和骨髓抑制作用。
2. 环磷酰胺(Cyclophosphamide):一种化疗药物,具有骨髓抑制和生殖系统毒性。
3. 甲氨蝶呤(Methotrexate):一种化疗药物,具有骨髓抑制和生殖系统毒性。
4. 5-氟尿嘧啶(5-Fluorouracil, 5-FU):一种化疗药物,具有骨髓抑制和皮肤毒性。
5. 替加氟(Tegafur):一种化疗药物,具有骨髓抑制和胃肠道毒性。
6. 卡莫氟(Carboplatin):一种化疗药物,具有肾脏毒性和骨髓抑制作用。
7. 顺铂(Cisplatin):一种化疗药物,具有肾脏毒性和耳毒性。
8. 阿糖胞苷(Ara-C):一种化疗药物,具有骨髓抑制和口腔溃疡毒性。
9. 白消安(Busulfan):一种化疗药物,具有骨髓抑制和生殖系统毒性。
10. 马利兰(Melphalan):一种化疗药物,具有骨髓抑制和生殖系统毒性。
以上药物仅为高危险药物的一部分,实际上还有更多其他药物也具有类似的危险特性。
安全管理措施由于高危险药物的特殊性质,因此在生产和使用过程中需要采取严格的安全管理措施。
以下是一些建议的安全措施:1. 储存:将高危险药物储存在通风良好的独立专用房间内,并设置适当的温湿度条件。
2. 包装:使用符合国家相关标准的包装材料,确保药物在运输和储存过程中的安全。
3. 标签:在高危险药物的包装上粘贴明显的安全警示标签,提醒使用者注意药物的危险性。
4. 操作:在操作高危险药物时,应穿戴适当的个人防护装备,如防护服、手套、护目镜等。

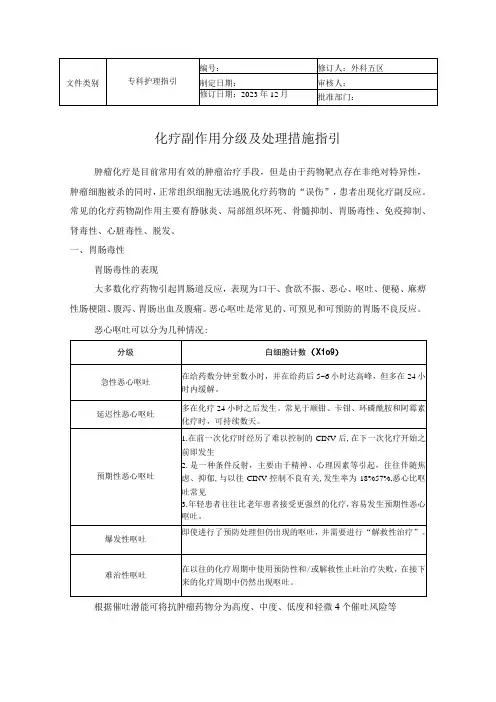
化疗副作用分级及处理措施指引肿瘤化疗是目前常用有效的肿瘤治疗手段,但是由于药物靶点存在非绝对特异性,肿瘤细胞被杀的同时,正常组织细胞无法逃脱化疗药物的“误伤”,患者出现化疗副反应。
常见的化疗药物副作用主要有静脉炎、局部组织坏死、骨髓抑制、胃肠毒性、免疫抑制、肾毒性、心脏毒性、脱发。
一、胃肠毒性胃肠毒性的表现大多数化疗药物引起胃肠道反应,表现为口干、食欲不振、恶心、呕吐、便秘、麻痹性肠梗阻、腹泻、胃肠出血及腹痛。
恶心呕吐是常见的、可预见和可预防的胃肠不良反应。
恶心呕吐可以分为几种情况:根据催吐潜能可将抗肿瘤药物分为高度、中度、低度和轻微4个催吐风险等级,是指不予预防处理呕吐发生率分别为>90%、30%~90%、10%~30%和<10%。
不同的化疗药物催吐效应不同,医生和患者都应该提前了解药物的催吐潜能,根据病情和患者自身情况,选择有效且能耐受的化疗方案。
恶心呕吐的药物恶心呕吐的治疗方案除了恶心呕吐,化疗相关性腹泻(Chemotherapyinduceddiairhea,CID)也是一种常见胃肠毒副反应。
C1D会导致水电紊乱、脱水、感染,严重可致休克、死亡。
氟尿喀咤、伊立替康,羟基喜树碱、卡培他滨等是常见导致C1D的药物。
国际抗癌协会将C1D 分为0-5级,相应的治疗方案见下表:如果使用伊立替康,可在使用前检测UGTIA1基因致预测腹泻的发生率,纯合子突变型UGT1AI7/7、杂合子UGTIAI6/7、野生型UGTIA16/6导致3〜4级迟发性腹泻的发生率分别为27.6%、18.5%、6.9%o二、骨髓抑制骨髓抑制的表现分级骨髓抑制在早期可表现为白细胞减少,严重时血小板、红细胞、血红蛋白都有不同程度的降低,大多数患者会表现为乏力、抵抗力下降、出血等表现。
根据临床血液学检查,骨髓抑制由轻到重分为4级,如下表:骨髓抑制的影响因素不同药物或化疗方案引起骨髓抑制的程度不同,患者因素如高龄且接受全量化疗、骨髓受侵、肝肾功能异常、免疫抑制状态、近期进行手术、既往放化疗等都是出现骨髓移植的高危因素。

曲妥珠单抗心脏毒性管理
1.曲妥珠单抗联合化疗药物,尤其是蒽环类化疗药物会增加心肌损害,严重者会发生心力衰竭。
所以复发转移乳腺癌患者不推荐曲妥珠单抗联合蒽环类化疗,辅助治疗曲妥珠单抗要在蒽环类化疗后使用,新辅助治疗可以在严密观察下,曲妥珠单抗同步联合4周期内短程蒽环类化疗。
2.尽管临床研究观察心脏毒性事件发生率不高且多数可以恢复,但应该注意临床研究入选的病例是化疗后经过心脏功能的安全筛选。
所以,临床实践中要对既往史、体格检查、心电图、超声心动图左心射血分数(LVEF)基线评估后再开始应用曲妥珠单抗,使用期间应该每3个月监测心功能。
若患者有无症状性心功能不全,监测频率应更高(如每6~8周1次)。
3.当出现LVEF较治疗前绝对数值下降≥16%,或LVEF低于该检测中心正常范围并且LVEF较治疗前绝对数值下降≥10%时,应暂停曲妥珠单抗治疗至少4周,并每4周检测1次LVEF,4~8周内LVEF回升至正常范围,或LVEF较治疗前绝对数值下降≤15%,可恢复使用曲妥珠单抗。
4.但LVEF持续下降超过8周,或者3次以上因心脏问题而中断曲妥
珠单抗治疗,应永久停止使用曲妥珠单抗。




肺脏的毒性出现缓慢和延迟,表现为干咳和呼吸急促。
多数出现在化疗药物应用后数月的时间。
引起肺脏毒性作用的常见药物包括:博来霉素、白消安、丝裂霉素等。
对于肺脏的毒性作用目前没有有效的治疗方法。
化疗药物对于心脏的毒性作用是非特异性的,这些毒性作用包括心肌病、心电图改变、心律失常、心肌的缺血性改变甚至心肌梗死。
最常见的引起心脏毒性作用的药物是阿霉素一类的药物。
因此阿霉素在进行癌症的化疗时有严格的剂量限制。
现在已经有很多阿霉素的改进药物,这些药物对于心脏的毒性作用明显降低。
心脏毒性的预防措施包括应用心肌保护剂、慎重选择适应证、密切观察患者的反应等。
在化疗前必须进行心电图检查和了解患者既往的心脏病史。
化疗药物对于肝脏的毒性作用最常见的是肝功能损害,由药物本身或者药物的体内代谢产物引起,因为绝大多数化疗药物都要经过肝脏进行代谢或者经过血液循环通过肝脏。
因此这种损害在临床是非常常见的。
肝功能损害是一个急性过程,表现为转氨酶的升高和血清胆红素的升高。
在应用大剂量药物的情况下可以出现肝脏的纤维化。
预防和治疗方面包括在化疗时应用保肝药。
化疗的肾脏毒性作用:所有的化疗药物需要经过肾脏排出体外,所以肾脏是化疗药物的一个非常重要的毒性作用器官。
肾脏的损害在实验室检查方面表现为血清肌酐、尿素氮的升高、蛋白尿等。
严重病例可以出现肾功能衰竭。
出现肾脏毒性作用频率最高的药物是顺铂,在应用时需要进行水化。
化疗药物对膀胱的毒性作用:化疗药物经过肾脏从输尿管进入膀胱:在膀胱中的存留可以损伤膀胱黏膜引起化学性膀胱炎。
最常见的药物是环磷酰胺和异环磷酰胺。
病人可以出现尿频、尿急和排尿困难等不适症状。
偶尔有血尿的情况。
预防和治疗方面包括应用保护剂巯已黄酸钠,并且进行水化和利尿。
化疗对性机能的影响:许多化疗药物可以影响生殖细胞的产生和内分泌功能,可以对生殖细胞产生致突变作用以及对胎儿有致畸作用。
化疗药物对于男性而言可以引起精子减少或缺乏导致不育,这些药物包括:瘤可宁、环磷酰胺、氮芥、白消安和甲基苄肼。


抗肿瘤药物心血管毒性发生机制和临床表现总结一、抗肿瘤治疗相关的心脏毒性分为两种类型:I型心脏毒性、II型心脏毒性。
I型心脏毒性:多伴有不可逆的心肌损伤,呈剂量依赖性,更易导致心力衰竭的发生,多见于传统化疗药物如懑:环类、烷化剂、抗微血管药物治疗后。
Ⅱ型心脏毒性:可导致心肌收缩力的暂时性丧失但无超微结构异常,呈非剂量依赖性,多数为可逆性,多见于曲妥珠单抗治疗后,VEGF抑制剂、酪氨酸激酶抑制剂等其他靶向药物治疗后也可发生。
二、抗肿瘤药物的心血管并发症分为九大类:心肌功能障碍与心力衰竭、冠心病、瓣膜病、心律失常、高血压、血栓栓塞性疾病、外周血管疾病与卒中、肺动脉高压、心包疾病。
抗肿瘤药物心血管毒性三、发生机制和临床表现(一)意:环类:多柔比星、伊达比星、表柔比星、米托惠能发生机制:1.氧自由基引起的DNA损伤2.铁代谢和钙信号的变化3.心肌细胞受损,抑制心肌细胞拓扑异构酶2-β临床表现:心力衰竭和冠状动脉疾病(3%-48%);心动过缓;窦性心动过速;房室传导阻滞;心房颤动;室上性心动过速;室性心动过速/心室颤动;急性心肌炎。
(二)烷化剂:环磷酰胺、异环磷酰胺、顺箱、美法仑发生机制:1.直接引起内皮损伤、氧化应激、线粒体损伤2.谷胱甘肽疏基转移酶缺乏3.肉毒碱棕桐酰转移酶缺乏4.心脏脂肪酸结合蛋白的表达减少5.血小板活化和聚合临床表现:心力衰竭;心动过缓;房室传导阻滞;心房颤动;室上性心动过速;室性心动过速/心室颤动;肺静脉阻塞性疾病(环磷酰胺);急性心包炎;冠状动脉疾病;缺血性卒中(顺钻I);高血压。
(三)抗代谢药物:5-氟尿喀咤、卡培他滨、吉西他滨、阿糖胞昔发生机制:1.内皮细胞功能损害,一氧化氮释放减少,内皮素增加,血小板聚集和纤维蛋白形成,冠状动脉痉挛,心肌缺血2.红细胞形态改变,携氧能力下降3.氧化磷酸化减少,三磷酸腺昔减少,氧自由基增加,抗氧化酶减少,二氢咯唬脱氢酶突变,5-FU代谢产物所致的心肌毒性4.儿茶酚胺引起的心功能障碍(TakOtSUbo心肌病)5.血栓性微血管病(吉西他滨)临床表现:心肌梗死;心肌病;心律失常;心源性休克;心包疾病(阿糖胞昔);高血压(吉西他滨)。
依那普利美托洛尔预防蒽环类药物心脏毒性所致心律失常的临床研究1. 引言1.1 研究背景蒽环类药物是一类广泛应用于治疗癌症的化疗药物,如柔红霉素、表柔比星等。
由于其心脏毒性作用,使用时常会引起心律失常等严重并发症。
蒽环类药物通过干扰心肌细胞内的代谢和结构变化,导致心脏功能异常,易诱发心律失常甚至心力衰竭。
寻找一种有效的方法来预防蒽环类药物引起的心律失常至关重要。
依那普利美托洛尔是一种联合应用的药物,其通过降低心脏负荷和降低心脏的收缩力来保护心脏免受蒽环类药物的损伤。
依那普利美托洛尔被广泛应用于临床实践中,用于预防蒽环类药物引起的心律失常及其他心脏毒性作用。
对于依那普利美托洛尔的预防效果以及临床应用前景还有待进一步研究和探索。
本研究旨在通过临床研究,探讨依那普利美托洛尔对预防蒽环类药物心脏毒性所致心律失常的效果,并评价其安全性和副作用情况,为临床实践提供参考依据。
1.2 研究目的研究目的是探讨依那普利美托洛尔在预防蒽环类药物引起的心脏毒性所致心律失常中的作用机制和临床效果。
具体而言,本研究旨在通过对依那普利美托洛尔的应用进行观察和分析,评估其对蒽环类药物引起的心律失常的预防效果,探讨其对心脏毒性的保护作用,为临床实践提供科学依据和指导。
通过对依那普利美托洛尔的副作用和安全性进行评价,探讨其在临床应用中的可行性和安全性。
通过本研究的开展,旨在为进一步优化蒽环类药物的临床应用提供新的思路和方法,保障患者的治疗效果和安全性。
2. 正文2.1 蒽环类药物的心脏毒性蒽环类药物是一类常用的抗肿瘤药物,如阿霉素、柔红霉素等,它们通过干扰DNA转录和复制的过程来抑制癌细胞的生长。
蒽环类药物在治疗肿瘤的也会对心脏产生一定的毒性作用。
研究表明,蒽环类药物可以导致心肌细胞的损伤和心肌肥厚,进而引发心脏毒性反应,如心律失常、心力衰竭等。
蒽环类药物的心脏毒性主要是由于其对心肌细胞的直接损害和心肌细胞代谢的影响。
具体来说,蒽环类药物会导致心肌细胞内钙离子的累积,进而导致心肌细胞的肿胀和损伤。
抗肿瘤药物也会对人体正常组织细胞造成损伤,导致多种毒副反应。
这种毒副反应已引起广泛关注,尤其是心血管不良反应,近年来越来越引起人们的重视。
抗肿瘤药物的心血管不良反应,其确切的机制尚未明了。
严重的心血管毒性可危及患者生命甚至造成死亡,了解肿瘤内科治疗导致的心血管不良反应、可能的发生机制及药物治疗安全范围,有助于临床医生合理用药,尽可能避免或降低这类不良反应的发生,并能进行及时有效的处理。
靶向药物心血管不良反应:多种药物可发生,表现多样化目前,靶向治疗药物已在临床上得到广泛应用。
虽然相对于细胞毒性药物而言,靶向治疗药物不良反应发生率较少,程度较轻,但心血管不良反应已经引起肿瘤学界的关注。
2008年美国临床肿瘤学会(ASCO)年会上,靶向治疗药物的心血管不良反应成为大会讨论的专题之一。
美国学者Swain在题为“治疗肿瘤-保护心脏:现代肿瘤治疗的心血管毒性”的演讲中,对已经发表的各类相关文献进行总结后指出,各种靶向药物导致的心功能不全发生率不同,其中贝伐单抗为3%,舒尼替尼为19%~28%,索拉非尼为3%。
因此,Swain强调,靶向治疗药物的心脏毒性应引起临床医生的重视。
心血管不良反应可发生于多种靶向药物,包括曲妥珠单抗、贝伐单抗和一些与血管内皮生长因子(VEGF)相关的酪氨酸激酶抑制剂(TKI),甚至已成为一些多靶点药物最常见的不良反应。
靶向药物心血管不良反应主要包括:高血压,心肌缺血/梗死(MI)、左室射血分数(LVEF)下降/慢性心力衰竭(HF)、QT间期延长等。
曲妥珠单抗曲妥珠单抗是靶向作用于人表皮生长因子受体2(HER2)的单克隆抗体,也是最早获美国FDA 批准用于HER2过表达乳腺癌的靶向药物。
心脏毒性是曲妥珠单抗最主要的不良反应。
有报告表明,曲妥珠单抗心功能障碍和HF的发生率比预期高,尤其当与其他有心脏毒性的化疗药物联合应用时。
此外,既往心脏病史、高龄、既往心脏毒性药物治疗史、胸部放疗史等可增加曲妥珠单抗心脏毒性的发生率。