化疗药物心脏毒性监测OK
- 格式:docx
- 大小:17.30 KB
- 文档页数:1

氮芥:1.该药胃肠道反应和骨髓抑制症状较明显,眩晕、耳聋、皮疹、脱发等症状少见。
2.注意注射时防止外溢出静脉,不成静脉滴注。
3.孕妇、肝肾功能不良及血象低下者慎用。
环磷酰胺(环磷氮芥、癌得星、CTX):1.较罕见的不良反应为骨髓抑制、脱发、口腔炎、及胃肠道反应,少数患者可出现过敏性皮炎、视力模糊、可逆性精子低下等;剂量过大时可引起心肌病变和肾毒型;肝肾功能不良可加重该药毒性。
2.巴比妥类、皮质激素、别嘌醇等药物对该药代谢、活性和毒性均有影响。
3.肝肾功能不良者慎用;明显恶液质者、孕妇忌用。
4.注意用药期间严密观察血象。
一般不必于腹腔内注射。
5.该药应防止高热及日光照射。
氮甲:注意用药期间严密观察血象。
苯丙氨酸氮芥(马法兰、美法仑):1.不良反应主要有消化道反应和骨髓抑制;动脉灌注会引起水肿、神经毒性、皮肤起疱等。
2.注意用药期间严密观察血象,根据血象调整剂量。
硝卡芥(消瘤芥):注意用药期间严密观察血象。
塞替派(三胺硫磷、TSPA、TESPA):1.不良反应为骨髓抑制、消化道反应、男性无精子、女性无月经、发热、皮疹等。
2.与琥珀胆碱合用可引起呼吸困难;与尿激酶合用可提高该药治疗膀胱癌的作用;该药可增加血尿酸水平。
3.有痛风病史、肝肾功能损害、泌尿系结石患者慎用。
孕妇禁用。
4.注意用药期间严密观察血象,稀释后如发现混浊不得使用。
白消安(马利兰、二甲磺酸丁酯、白血福恩、米埃罗生):1.不良反应为消化道反应、骨髓抑制;偶有肺纤维化、头昏、面红、男性乳房发育、女性闭经、皮肤色素沉着、甚至出现畸形胎儿,大剂量可引起再生障碍性贫血。
2.注意用药期间严密观察血象。
急性白血病和再生障碍性贫血或出血性疾病患者忌用,孕妇禁用,肾上腺皮质功能不全患者慎用。
司莫司汀(甲环亚硝脲、甲基-CCNU):1.不良反应为消化道反应、迟发性骨髓抑制、肝肾毒性(长期大剂量使用可致肾脏萎缩)。
2.用药期间严格检查血象,药物应在8ºC以下保管。

cTnT-hs、CK、CK-MB评价乳腺癌患者术后化疗药物的心肌毒性发表时间:2018-03-14T10:17:51.360Z 来源:《中国误诊学杂志》2017年第28期作者:杨晓芳杨宇杨伟通讯作者周友全[导读] cTnT-hs、CK、CK-MB可以用来监测化疗后患者的心肌损伤,但是是在正常参考范围内的监测。
云南省肿瘤医院检验科云南昆明 650118摘要:目的:探讨cTnT-hs、CK、CK-MB评价乳腺癌患者术后化疗药物的心肌毒性。
方法:检测云南省肿瘤医院114例乳腺癌术后化疗患者化疗前、化疗四周期后、化疗八周期后的血清cTnT-hs、CK、CK-MB值的变化,比较研究来判断乳腺癌化疗对心肌损伤生化标志物的影响以及三种不同化疗方案对心肌损伤程度的区别,筛选评价乳腺癌患者术后化疗药物心肌毒性监测的最佳指标。
结果:乳腺癌术后化疗患者血清cTnT-hs、CK、CK-MB均较化疗前明显升高(P<0.05),且随化疗剂量的累积,CK-MB变化不明显,cTnT-hs、CK有明显变化。
但三项指标均未超过正常参考范围。
不同化疗方案所致cTnT-hs、CK、CK-MB的变化无明显差异(P>0.05)。
结论:cTnT-hs、CK、CK-MB可以用来监测化疗后患者的心肌损伤,但是是在正常参考范围内的监测。
三种不同的化疗方案对于心肌损伤的程度无明显不同。
关键词:乳腺癌;心肌毒性;cTnT-hs;CK;CK-MBThe myocardial toxicity of cTnT-hs,CK and CK-MB to evaluate the postoperative chemotherapy drugs in patients with breast cancer.YANG Xiao-fang,YANG Yu,YANG WeiCommunication author,ZHOU You-quan(Department of Clinical Laboratory,Tumor Hospital of Yunnan Province,Kunming,Yunnan 650118,China)Abstract:Objectives To discusses the myocardial toxicity of cTnT-hs,CK and CK-MB to evaluate the postoperative chemotherapy drugs in patients with breast cancer.Methods Detection of tumor hospital of yunnan province,114 cases of postoperative chemotherapy in patients with breast cancer before and after four cycles,eight cycles of chemotherapy cTnT-hs,CK,CK-MB value change,comparative study to judge the breast cancer chemotherapy effect on biochemical markers of myocardial injury and three different chemotherapy regimens on myocardial damage degree of distinction,screening assessment of postoperative chemotherapy drug in patients with breast cancer the best indicator of myocardial toxicity monitoring. Results The concentration of cTnT-hs,CK and CK-MB were signification higher than before treatment in postoperative chemotherapy of breast cancer patients(P < 0.05),and with the accumulation of chemotherapy doses,There was no obvious change in CK-MB,and there was a significant change in CK and cTnT-hs.But three indicators are not higher than normal reference range. There are no significant differences in the changes of the cTnT-hs,CK and CK-MB in different chemotherapy regimens(P>0.05).Conclusions CTnT-hs,CK,CK-MB can be used to monitor the myocardial injury of patients after chemotherapy,but it is monitored within normal reference range.Three different chemotherapy regimens have no obvious difference in the degree of myocardial injury.Key words breast cancer;cardiac toxicity;cTnT-hs;CK;CK-MB乳腺癌现已成为导致女性癌症死亡的首要原因。


蒽环类药物心脏毒性防治指南(word版)蒽环类药物心脏毒性防治指南(2013年版) 中国临床肿瘤学会中华医学会血液学分会1 前言蒽环类药物,包括阿霉素、表阿霉素、柔红霉素和阿克拉霉素等广泛地用于治疗血液系统恶性肿瘤和实体肿瘤,如急性白血病、淋巴瘤、乳腺癌、胃癌、软组织肉瘤和卵巢癌等。
蒽环类药物可以与其他化疗药物及分子靶向药物联合应用,以蒽环类药物为基础的联合治疗通常是一线治疗的标准方案。
蒽环类药物的抗瘤谱广,抗瘤作用强,疗效确切,不可或缺,但是可以引起脱发、骨髓抑制和心脏毒性等毒副反应。
针对骨髓抑制可采用造血刺激因子(G-CSF、EPO和TPO 等)进行防治,而心脏毒性是蒽环类药物最严重的毒副作用。
临床研究和实践观察都显示蒽环类药物导致的心脏毒性往往呈进展性和不可逆性,特别是初次使用蒽环类药物就可能造成心脏损伤,因此早期监测和积极预防蒽环类药物引起的心脏毒性显得尤为重要,巳经引起临床上的高度重视。
为此,我们组织国内血液病科、肿瘤科和心脏内科等领域的专家,对蒽环类药物心脏毒性的特点、机理、诊断和防治等问题进行了认真研论,在原有的专家共识的基础上形成了本指南,提供临床医师参考。
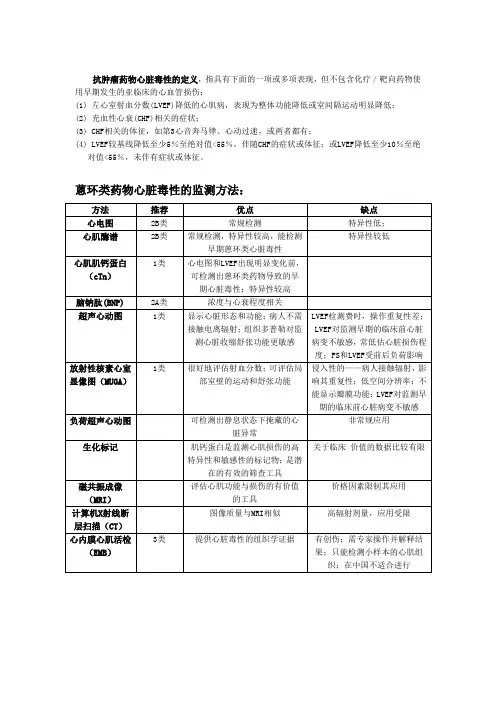
2 蒽环类药物心脏毒性的临床表现和特征按照出现的时间进行分类,蒽环类药物导致的心脏毒性可以分成急性、慢性和迟发性心脏毒性(图1)。
多数患者在蒽环类药物给药后可较快地发生心肌损伤,且随着时间的延长愈加明显。
在给予蒽环类药物的数年后,超过50%的患者可发生左心室组织和功能亚临床心脏超声变化,例如后负荷的增加或收缩能力的下降。
蒽环类药物的慢性和迟发性心脏毒性与其累积剂量呈正相关(表1、表2)。
常用蒽环类药物导致心脏毒性的剂量可以进行换算(表3)。
蒽环类药物心脏毒急慢迟给药后的几小时或几天内发生,常表现为心内传导紊乱和心律失常,极少在化疗的1年内发生,表现为左心室功能障碍,最终可在化疗后数年发生,可表现心衰、心肌病及心律失常米托蒽醌(MIT) l60 mg/m2(用过ADM等药物,< 120 mg/m2)表2阿霉素累积剂量与心衰发生的关系阿霉素累积剂量心衰发生率(%)Von Hoff DD Swain SM400 mg/m2 3 5 550 mg/m27 26 700 mg/m218 48表3 蒽环类药物剂量换算表蒽环类药物转换系数5%发生心脏毒性的蒽环累积剂量阿霉素 1 450 mg/m2表阿霉素0.5 900 mg/m2柔红霉素0.5 935 mg/m2去甲氧柔红霉素 2 225 mg/m2米托蒽醌 2.2 200 mg/m23 蒽环类药物心脏毒性的机理蒽环类药物导致心脏毒性的机制仍未完全明了,现有的证据揭示与产生的自由基直接有关。

化疗药物所致心脏毒性的研究进展张永飞;崔久嵬【摘要】随着抗肿瘤治疗方法的不断发展以及肿瘤患者预后的改善,化疗药物所致心脏毒性日渐凸显.以蒽环类药物为主的传统化疗药物对心脏产生不同程度直接或间接的损伤,所致心脏毒性的发生甚至在治疗结束后数年,部分新型抗肿瘤药物的出现,使得心脏毒性的发生更加复杂,限制肿瘤患者治疗方案的选择,对其生存及预后也有重要影响.了解化疗药物所致心脏毒性的病理生理机制,风险评估,早期监测系统管理及合理的药物治疗对于减少化疗药物所致心脏毒性的发生和改善肿瘤患者预后十分重要.【期刊名称】《中国肿瘤临床》【年(卷),期】2018(045)024【总页数】5页(P1243-1247)【关键词】肿瘤;化疗;蒽环类;心脏毒性【作者】张永飞;崔久嵬【作者单位】吉林大学第一医院肿瘤中心长春市130021;吉林大学第一医院肿瘤中心长春市130021【正文语种】中文随着肿瘤治疗方法的不断发展,肿瘤患者预后得到极大改善,与肿瘤治疗药物相关的并发症日渐凸显,成为影响患者生存的重要问题。
化疗目前仍是多种肿瘤的主要治疗方法,其直接或间接地对心脏产生不同程度的损伤,即心脏毒性,所致心脏毒性的发生甚至在治疗结束后数年,限制了肿瘤患者治疗方案的选择,对患者生存及预后也有重要影响。
新兴学科-心脏肿瘤病学涉及化疗药物所致心脏毒性的机制、临床表现、如何监测和防治,对于改善肿瘤患者预后及延长生存期至关重要。
1 流行病学近年来,随着肿瘤患者生存期的延长,抗肿瘤治疗相关的并发症发病率和死亡率均有所增加,心血管疾病在肿瘤幸存者中的发病率和死亡率位居第二位,仅次于肿瘤复发[1-2]。
一项有关乳腺癌患者的综合分析发现,乳腺癌患者10年后因心脏疾病所致死亡的风险,已超过肿瘤本身的影响[3]。
有研究发现,化疗所致亚临床心脏毒性的发病率为临床心脏毒性的3倍,更应得到关注[4]。
有关儿童肿瘤患者的研究发现,在肿瘤诊断的15~25年后,儿童肿瘤患者的心脏死亡发生风险为正常人的8.2倍,充血性心力衰竭的发生风险增加15倍,心血管疾病的发生风险增加10倍,中风的发生风险增加9倍[1,5]。

曲妥珠单抗心脏毒性管理
1.曲妥珠单抗联合化疗药物,尤其是蒽环类化疗药物会增加心肌损害,严重者会发生心力衰竭。
所以复发转移乳腺癌患者不推荐曲妥珠单抗联合蒽环类化疗,辅助治疗曲妥珠单抗要在蒽环类化疗后使用,新辅助治疗可以在严密观察下,曲妥珠单抗同步联合4周期内短程蒽环类化疗。
2.尽管临床研究观察心脏毒性事件发生率不高且多数可以恢复,但应该注意临床研究入选的病例是化疗后经过心脏功能的安全筛选。
所以,临床实践中要对既往史、体格检查、心电图、超声心动图左心射血分数(LVEF)基线评估后再开始应用曲妥珠单抗,使用期间应该每3个月监测心功能。
若患者有无症状性心功能不全,监测频率应更高(如每6~8周1次)。
3.当出现LVEF较治疗前绝对数值下降≥16%,或LVEF低于该检测中心正常范围并且LVEF较治疗前绝对数值下降≥10%时,应暂停曲妥珠单抗治疗至少4周,并每4周检测1次LVEF,4~8周内LVEF回升至正常范围,或LVEF较治疗前绝对数值下降≤15%,可恢复使用曲妥珠单抗。
4.但LVEF持续下降超过8周,或者3次以上因心脏问题而中断曲妥
珠单抗治疗,应永久停止使用曲妥珠单抗。




2023抗肿瘤药物,心血筐毒性及真相关凤险评估研究避展(全文)近年来,随着抗肿瘤药物研发的不断发展及综合诊治水平的提高,肿瘤患者的生存时间明显延长,但随之而来的是抗肿瘤药物相关心血管毒性发生率和致死率显著增高[1]。
另外,生活方式的改变和人口老龄化出现,患者在原萄心血管疾病基础上并发肿瘤也明显增多,导致抗肿瘤药物相关心血筐毒性更为常见[2]。
药物中目关心血管毒性可影响抗肿瘤药物的治疗疗效,降低患者总体预后及生存质量。
因此,抗肿瘤治疗前应对患者进行药物相关心血管毒性风险评估,并在治疗过程中应严密监测。
本文墓于国内外相关抗肿瘤药物心血管毒性及真相关凤险评估的近期研究,注重当前临床常用的抗肿瘤药物导致的心血筐毒性类型、11面床特点及真易患凤险因素,再助于临床合理选捧与使用药物提高抗肿瘤疗效同时,避免抗肿瘤药物导致的1心血管毒性发生。
1抗肿瘤药物心血筐毒性及类型抗肿瘤药物心血管毒性是指肿瘤治疗药物导致心室功能不全、心力衰竭、高血压、血管崖李、血栓栓塞性疾病及各种心律失常等症状及疾病的总称[1]。
2016年欧洲|心脏病学会(ESC)发布《2016癌症治疗与心血管毒性立场声明》[坷,根据心血管毒性发生部位与特点,将心血管毒性分:1 )心室功能不全和心衰;2)冠状动脉疾病;3)心律失常;4)高血压;5 )血栓栓塞;6)肺动脉病变;7)心包疾病;8)周围血筐病与卒中;9)心脏瓣膜病。
临床常根据心血管毒性发病急缰可分为急性、亚急性或慢性[4]。
急性心血筐毒性是在用药期间或治疗后14天内发生,持续时间较短;亚急性心血筐毒性常发生在治疗1-2个疗程后或在完成疗程1年内发生,慢性心脏毒性则在治疗1年后发生,甚至数年后出现。
急性或亚急性心血管毒性临床特点是(1 )心室复极异常,心电图QT间期变化和室性心律失常�2) 急性冠状动脉综合征和心包炎和/或心肌炎样综合征;(3 )新出现的高血压或原高高血压加重。
慢性心血管毒性事件常见是无症状收缩手日/BJ,舒张性左心室功能不全、高血压、心律失常,重者则呈扩张性心肌病样改变,表现为左I心衰或全IL,\衰。
蒽环类抗肿瘤药物的心脏毒性及防治研究高甫;耿翠芝【摘要】蒽环类抗肿瘤药是上世纪70年代发展起来的一类重要抗癌药物,阿霉素及柔红霉素是该类药物的代表,是一类细胞周期非特异性化疗药.目前该类药物已广泛应用于临床,对肺癌、乳腺癌、淋巴瘤等多种恶性肿瘤患者,均具有抗瘤谱广、临床疗效高、对乏氧细胞同样有效等显著特点,是多种化疗方案的核心.无论在乳癌术前新辅助化疗、复发转移治疗和早期乳癌术后辅助化疗中都占有非常重要的位置.为提高治疗效果,化疗方案中蒽环类药物的剂量通常较大,其化疗不良反应呈现出明显的剂量-效应线性关系.故随着应用剂量的增加,不良反应也相应增多,尤其是对心脏的毒性作用,一旦出现明显的心肌病变,往往患者预后较差,有时病死率高达48%,故在某些方面限制了其在临床上的应用[1].【期刊名称】《临床荟萃》【年(卷),期】2012(027)002【总页数】5页(P178-182)【关键词】抗肿瘤药;蒽环类;药物毒性【作者】高甫;耿翠芝【作者单位】河北医科大学第四医院外一科,河北石家庄 056000;河北医科大学第四医院外一科,河北石家庄 056000【正文语种】中文【中图分类】R916.696蒽环类抗肿瘤药是上世纪70年代发展起来的一类重要抗癌药物,阿霉素及柔红霉素是该类药物的代表,是一类细胞周期非特异性化疗药。
目前该类药物已广泛应用于临床,对肺癌、乳腺癌、淋巴瘤等多种恶性肿瘤患者,均具有抗瘤谱广、临床疗效高、对乏氧细胞同样有效等显著特点,是多种化疗方案的核心。
无论在乳癌术前新辅助化疗、复发转移治疗和早期乳癌术后辅助化疗中都占有非常重要的位置。
为提高治疗效果,化疗方案中蒽环类药物的剂量通常较大,其化疗不良反应呈现出明显的剂量效应线性关系。
故随着应用剂量的增加,不良反应也相应增多,尤其是对心脏的毒性作用,一旦出现明显的心肌病变,往往患者预后较差,有时病死率高达48%,故在某些方面限制了其在临床上的应用[1]。
淋巴瘤化疗前后心电图变化的对比评价【摘要】:目的:研究分析淋巴瘤患者化疗前后的心电图变化情况,探讨心电图对于淋巴瘤患者化疗后心脏毒性反应的检测效果。
方法:样本收集时间为2019年1月至2021年12月,收集这一时间段内在医院接受CHOP化疗方案治疗的50例淋巴瘤患者作为研究样本。
在患者化疗前、化疗后,采用常规心电图、动态心电图对患者是否发生心脏毒性反应进行监测,以临床综合诊断结果作为诊断金标准,对比常规心电图、动态心电图对于淋巴瘤患者化疗后心脏毒性反应的检测灵敏度、特异度、准确率、阳性预测值、阴性预测值,分析常规心电图、动态心电图与诊断金标准之间的一致性,并对比常规心电图与动态心电图对于心肌缺血、心律失常的诊断符合率。
结果:对于淋巴瘤患者化疗后心脏毒性反应,动态心电图检测的灵敏度、特异度、准确率、阳性预测值、阴性预测值均比常规心电图更高(P<0.05)。
对于淋巴瘤患者化疗后心脏毒性反应监测时,常规心电图监测结果与诊断金标准结果之间具有中度一致性,而动态心电图监测结果与诊断金标准结果之间具有高度一致性。
在化疗后发生心脏毒性反应的淋巴瘤患者中,动态心电图对于心肌缺血、心律失常的诊断符合率均高于常规心电图(P<0.05)。
结论:心电图在淋巴瘤患者化疗后会发生改变,可检出淋巴瘤化疗后的心脏毒性反应,尤其是动态心电图,其对心脏毒性反应的诊断价值良好,对于心肌缺血和心律失常均可准确判断。
【关键词】:淋巴瘤;化疗;心脏毒性反应;常规心电图;动态心电图淋巴瘤是临床上常见的恶性肿瘤类型,主要起源于淋巴结、淋巴组织,包括霍奇金淋巴瘤、非霍奇金淋巴瘤,具有高发病率。
化疗是对于淋巴瘤开展治疗的主要手段,其一线化疗方案为CHOP化疗方案,可在一定程度上控制肿瘤进展[1],但化疗药物会对患者产生心脏毒性作用,化疗后患者容易发生心脏毒性反应,影响到其化疗效果,还会导致患者死亡风险增高[2],因此,临床上主张对淋巴瘤患者化疗后的心脏毒性反应进行监测,以免影响到其近期疗效和远期预后。