第二章:表面吸附与表面反应
- 格式:doc
- 大小:1.01 MB
- 文档页数:14


第二章:表面吸附与表面反应•吸附和脱附是催化反应中不可缺少的两步•是催化剂对反应施加作用的基本步骤,可以说,没有反应物吸附就不可能存在催化剂发生催化作用的问题。
•吸附理论是催化作用理论的基础理论§1、吸附现象1、吸附产生的原因2、基本术语图2-1:气体在致密无孔固体表面上的吸附(物理吸附模型)•吸附:气体或液体在固体表面上,或气体在液体表面上的富集过程,这种现象也称之为吸附现象。
•脱附:吸附的逆过程•固体表面层:与吸附物产生相互作用的表面层,一般只有几个原子层厚度。
•吸附量:•吸附物:流体中能被吸附的物质,也称吸附质。
•吸附态:吸附质在表面吸附后的状态。
•吸附剂:能起吸附作用的物质。
•吸附中心:吸附是发生在吸附剂表面上的局部位置•表面吸附络合物:指得是吸附中心与吸附质共同构成的结合体。
3、吸附热效应吸附物在吸附剂上的吸附所产生的热效应。
•表面吸附常常是放热的,这是吸附的必然结果,因为,吸附物在吸附剂上的吸附过程都是自发过程,即:自由能ΔG吸<0而ΔG吸=ΔH吸—TΔS吸即ΔH吸—TΔS吸<0所以ΔH吸<TΔS吸换句话说,若ΔS吸为负值,则ΔH吸也必为负值。
此时,吸附为放热过程。
•吸附物在吸附剂表面上形成了一个更为有序的体系,吸附物分子的自由度数必然减少,所以ΔS吸<0是这种吸附的必然结果,即ΔH吸<0。
•对物理吸附来说,被吸附的分子一定不发生解离,物理吸附一定是放热的。
•对化学吸附来说,被吸附的分子会有两种情况:解离与不解离。
不解离的化学吸附,有ΔS吸<0,吸附过程一定是放热的解离化学吸附,可能有ΔS吸<0或ΔS吸>0,这样,吸附过程就可能为吸热的,也可能是放热的。
如:在适当的温度下,H2在Fe上的吸附:H2+Fe(受S污染)──→H2分子被解离为两个氢原子,且可在Fe表面上作二维自由运动。
被吸附的氢原子的自由度= 2(二维运动)+ 2(振动)= 4两个氢原子的自由度= 4×2 = 8氢分子= 3(三维运动)+ 3(振动+转动)= 6 所以:ΔS吸>0出现H2在Fe上的化学吸附为吸热。


化学反应机理中的表面反应化学反应是物质发生变化的过程,其中包括了各种各样的反应类型和机理。
表面反应是其中一种重要的反应机理,涉及到物质在表面或者界面上的相互作用和转化。
本文将探讨化学反应机理中的表面反应及其在实际应用中的重要性。
一、表面反应的基本概念表面反应是指反应物分子在物理表面上发生接触反应并转化为产物的过程。
在反应过程中,反应物分子与表面的相互作用导致化学键的重构和分子结构的改变,从而产生新的化学物质。
表面反应通常发生在固体表面、液体表面以及气体界面上,具有很高的反应速率和特殊的反应动力学行为。
二、表面反应的种类及特点1. 吸附反应吸附反应是表面反应中最常见的一种类型。
吸附反应的过程包括吸附、表面扩散、反应和解吸等多个步骤。
吸附反应通常发生在固体表面或者液体表面上,吸附物质通过物理或化学吸附与表面发生相互作用。
2. 反应速率与表面积的关系表面反应的速率与反应物在表面上的接触面积密切相关。
反应物分子在表面上的吸附与反应,表面积越大,反应速率越快。
因此,在工业生产和科研实验中,常常采取增大反应器内表面积的方法来提高反应速率和效率。
三、表面反应实际应用举例1. 催化剂的应用表面反应在催化剂的应用中起着重要的作用。
催化剂可以提供更多的表面积,增加反应物在表面上的吸附和反应机会,从而加速反应速率。
常见的催化反应包括有机合成、汽车尾气净化等。
2. 表面涂层技术表面涂层技术利用表面反应原理,将一层薄薄的功能性材料覆盖在基础材料的表面上。
这种涂层可以提供额外的保护、改变表面性质或者实现特殊的功能,如防腐蚀、增加光泽度等。
3. 电化学反应电化学反应是指在电解质溶液中由于电子转移而发生的化学反应。
在电极与电解质溶液的接触界面上,会发生一系列的表面反应,涉及到电荷转移、氧化还原和析气等过程。
四、表面反应的研究方法为了深入了解表面反应的机理和过程,科学家们开发了很多研究表面反应的方法和技术。
其中包括:1. 表面敏感技术表面敏感技术通过探测表面反应物或产物的组成和结构,来研究表面反应的过程和机理。


催化剂的表面吸附与反应性能催化剂是一种能够促进化学反应速率的物质,而催化剂的表面吸附与反应性能密切相关。
在化学反应中,催化剂通过与反应物发生表面吸附,并引发分子键的断裂和重组,从而降低活化能,加快反应速率。
催化剂的表面吸附特性直接影响其反应性能的提高和稳定性。
催化剂的表面吸附是指反应物与催化剂表面发生相互作用,形成化学键或吸附态。
表面吸附可分为物理吸附和化学吸附两种类型。
物理吸附是指反应物分子与催化剂表面之间的范德华力相互作用,接触时间短,易于解吸。
而化学吸附则是指反应物分子与催化剂表面的原子或离子之间发生键合。
化学吸附具有较强的键能,接触时间长,难以解吸。
催化剂的表面吸附类型直接决定了吸附后的反应物在催化剂表面上的位置和构型,进而影响反应的进程和效果。
催化剂的表面吸附态可以分为不同的吸附模式,例如物理吸附、化学吸附和中间态吸附等。
物理吸附和化学吸附是吸附态的两个极端。
物理吸附相对较弱,吸附和解吸过程可以在常温下快速发生,而化学吸附则是不可逆的。
中间态吸附则是物理吸附和化学吸附之间的过渡态,具有介于两者之间的吸附能力和解吸速度。
催化剂的表面吸附态决定了反应物在催化剂表面上的活性中心和反应路径。
催化剂的表面吸附与反应性能之间存在着紧密的关系。
一方面,催化剂的表面吸附决定了反应物在催化剂表面上的有效接触程度。
吸附强度较弱的物理吸附能够提供充分的接触机会,但吸附强度过弱可能导致反应物容易解吸,降低反应效果。
吸附强度较强的化学吸附能够促进反应物在催化剂表面上的定向吸附,但吸附强度过强可能导致反应物难以脱附,降低催化剂的活性。
中间态吸附则可以在一定程度上平衡吸附强度和解吸速度,提供适当的反应机会。
另一方面,催化剂的表面吸附还决定了反应物在催化剂表面上的反应途径和产物选择性。
吸附态不同的反应物具有不同的活性,选择性和稳定性。
通过调控催化剂表面吸附态,可以实现对反应途径和产物选择性的调控。
例如,在氢氧化钠催化剂表面上,CO气体的化学吸附能够引发CO氧化反应,但在CO气体的物理吸附态下,其反应性能较差。


第二章吸附作用一、概述凡气固多相催化反应,都包含吸附步骤.在反应过程中,至少有一种反应物参与吸附过程.多相催化反应的机理与吸附的机理不可分割.固体表面是敞开的,表面原子所处的环境与体相不同,配位不饱和,它受到了一个不平衡力的作用,当气体与清洁固体表面接触时,将与固体表面发生相互作用,气体在固体表面上出现了累积,其浓度高于气相,这种现象称吸附现象( adsorption).与吸收(absorption)不同,吸收发生在体相. 吸附气体的固体物质称为吸附剂.被吸附的气体称为吸附质.吸附质在表面吸附以后的状态称为吸附态.吸附发生在吸附剂表面的局部位置上,这样的位置就叫吸附中心或吸附位.吸附中心与吸附的物质共同构成表面吸附络合物.当固体表面上的气体浓度由于吸附而增加时,称吸附过程,反之,当气体在表面上的浓度减小时,则为脱附过程.二、物理吸附与化学吸附吸附可以分为物理吸附与化学吸附两种.它们的作用力不同.物理吸附是由分子间作用力,即van der W alls 力所产生.由于这种力较弱,故对分子结构影响不大,所以可把物理吸附类比为凝聚现象.化学吸附的作用力属于化学键力(静电与共价键力).由于此种力作用强,涉及到吸附分子和固体间的电子重排、化学键的断裂或形成,所以对吸附分子的结构影响较大.吸附质分子与吸附中心间借此种力形成吸附化学键.化学吸附类似化学反应.由于产生吸附的作用力不同,两种吸附有不同的特征,两者主要特征比较见表2.1.表2.1物理吸附与化学吸附主要特征比较化学吸附物理吸附.(A) 吸附热≥80kJ·mol-10-40kJ·mol-1这是化学吸附的充分,但不是必要的条件(B) 吸附速率常常需要活化,所以速率慢因不需活化,速率快(C) 脱附活化能≥化学吸附热凝聚热(D) 发生温度常常在高温下(高于气体的液化点)接近气体的液化点(E) 选择性有选择性,与吸附质、吸附剂的本性有关无选择性,任何气体可在任何吸附剂上吸附(F) 吸附层单层多层(G) 可逆性可逆或不可逆可逆表2.2和表2.3提供了某些气体的液化潜热、物理吸附热与化学吸附热,以供比较.表2.2某些气体的液化潜热和最大物理吸附热[4]Gas H2O2N2CO CO2CH4C2H4C2H2NH3H2O Cl2 q(kJ/mol) 0.92 6.69 5.61 6.02 25.10 9.12 14.64 24.01 23.26 44.22 18.41 q max(kJ/mol) 8.4 20.9 20.9 25.1 37.7 20.9 33.5 37.7 37.7 58.6 35.6表2.3某些气体的化学吸附热Q(kJ/mol)[4]气体Ti Ta Nb W Cr Mo Mn Fe Co Ni Rh Pt H2188 188 167 71 134 117O2720 494 293 N2586 293CO 640 192 176CO2682 703 552 456 339 372 222 225 146 184NH3301 188 155C2H4577 427 427 285 243 209三、吸附位能曲线吸附过程中,吸附体系(吸附质—吸附剂)的位能变化可以用吸附位能图表示.对大多数物理吸附而言,其位能变化原则上可以使用Lennard-Jones曲线来描述,该曲线原来是用以描述两个气体分子质点在相互靠近时的位能变化.当然在吸附场合就不单单是两个质点间的相互作用,而是吸附分子与表面上的许多原子间的相互作用.这种相互作用的总位能是吸附分子与每一个表面原子作用能量的加合.对这种加合,Lennard-Jones曲线给出的描述基本上是正确的.图2.1是表示分子物理吸附中位能变化的Lennard-Jones图,其中的X表示分子A2距表面无限远位能取作零时与表面的距离.随着分子与表面的接近,位能下降,到Y时发生了物理吸附,放出吸附热Q p,这是物理吸附热.当分子再靠近表面,因排斥作用增强、吸引作用相对减弱,使体系位能上升,由于稳定性原因,体系不能在这样的状态稳定存在.图2.1 A2分子在固体表面S上的物理吸附位能曲线[6]描述活性原子在固体表面上化学吸附的位能变化可用Morse公式近似计算得到,见图2.2的曲线.对大多数化学吸附来说,这种图给出的形状也是类似的.图2.2 活性原子A在固体表面S上的吸附位能曲线[6]X表示活性原子A与表面相距很远时的体系位能。


化学表面化学练习题表面吸附和界面现象化学表面化学练习题:表面吸附和界面现象表面吸附和界面现象是化学中重要的概念,对于理解材料的特性及其应用具有重要意义。
本文将围绕表面吸附和界面现象展开论述,探讨相关练习题,旨在帮助读者进一步理解和应用相关知识。
1. 吸附现象是指气体、液体或固体在与表面接触的情况下,被物质的表面吸附或附着的现象。
根据吸附力的强弱,可以将吸附分为物理吸附和化学吸附。
2. 物理吸附主要由范德华力引起,其吸附速度快,吸附热较低;化学吸附则需要化学键的形成和断裂,吸附速度较慢,吸附热较高。
3. 表面活性剂是一类能够降低液体表面或液-固界面的表面张力的物质。
常见的表面活性剂包括阴离子表面活性剂、阳离子表面活性剂、非离子表面活性剂和两性表面活性剂。
4. 表面活性剂具有乳化、分散、润湿等特性,被广泛应用于液体洗涤剂、乳化剂、润滑剂等领域。
5. 分散系统中,存在两种无序排列的结构,即胶束结构和微乳液结构。
胶束结构是表面活性剂在溶液中形成的球形结构,其中疏水基团聚集在内,疏水基团聚集在外;微乳液结构是指表面活性剂和一定量的溶剂形成的连续的液滴结构。
6. 界面张力是液体与气体或液体与液体交界面上的单位长度所受的力,常用符号为γ。
根据界面上的液体种类不同,可以将界面张力分为气液界面张力和液液界面张力。
7. 洗涤剂对界面张力有明显影响,能够降低液体表面的张力,使表面张力减小,达到润湿和乳化的效果。
8. 表面活性剂的胶束结构对其性能具有重要影响。
胶束的大小与表面活性剂的浓度有关,随着浓度的增加,胶束的大小逐渐增大,直至形成连续的液滴。
9. 色散系统中的分散相通常是固体微粒,而分散介质可以是气体、液体或固体。
颗粒的大小和分散体系的粘度都会影响分散体系的流变性质。
10. 界面活性剂的添加对分散系统的流变性质有重要影响,可以改变其黏度、流变曲线的形状和流动特性。
总结起来,表面吸附和界面现象是化学中不可忽视的重要现象。
分子在金属表面的吸附与反应机制一、引言金属表面的吸附和反应机制是材料科学和表面化学研究领域中至关重要的问题之一。
因为它们直接关系到多种现象的产生,如催化反应、腐蚀、氧化等。
随着科技的不断发展,研究人员发现了越来越多的分子在金属表面的吸附和反应机制。
本文将就此进行探讨,希望为广大读者提供一些有益的信息。
二、分子在金属表面的吸附机制分子在金属表面的吸附机制包括电子、原子和离子的吸附。
其中,电子吸附是指分子与金属表面的电子相互作用,而原子和离子吸附则是涉及到分子与金属表面的原子或离子相互作用。
电子吸附是分子在金属表面的最常见的吸附方式。
它通常发生在分子的氧化还原过程中,从而导致电子从分子到金属表面的迁移。
这种吸附不仅可以改变金属表面的特性,还可以影响分子的催化反应和电化学反应。
原子和离子的吸附则是指分子中的原子或离子与金属表面中的原子或离子发生相互作用。
这种吸附方式通常发生在气相和固相的反应中,从而使分子中的原子或离子与金属表面中的原子或离子产生键合。
三、分子在金属表面的反应机制分子在金属表面的反应机制主要包括物理吸附途径和化学吸附途径两种。
物理吸附途径是一种较为简单的吸附方式,它主要通过分子与金属表面之间的范德华相互作用来实现。
这种吸附方式一般是可逆的和表面吸附的,反应时需要较大的分子速度和表面温度。
化学吸附途径则属于一种更为复杂的吸附方式,其中包括物种表面反应和物种气相反应两种。
物种表面反应通常发生在分子和金属表面之间的键合区,既涉及到分子的原子与金属表面的原子的相互作用。
而物种气相反应则是指分子中的物质与金属表面中的原子或分子发生化学反应。
四、结论研究分子在金属表面的吸附和反应机制一直是材料科学和表面化学领域的热点。
随着科技的发展和研究的不断深入,人们对这些问题的理解也在不断加深。
通过对分子在金属表面的吸附和反应机制的研究,可以更好地了解分子与金属表面之间的相互作用,并为材料科学和表面化学领域提供更多的理论基础。
材料科学中的表面反应机理表面反应机理是材料科学中的一个重要领域,它关注材料表面与周围环境发生的化学反应,探索这些反应的机制和特性。
表面反应机理被广泛应用于材料科学的各个领域,如材料合成、催化、腐蚀、防护等,因此,对于表面反应机理的深入了解和研究,对于推进材料科学领域的发展非常重要。
一、表面反应机理的基础概念表面反应是指发生在材料表面与周围环境之间的化学反应,涉及材料表面的化学性质和反应动力学等方面。
表面反应与体积反应不同,它发生在表面上的有限区域内,受到表面状态、气体分子的吸附和扩散、原子扩散等因素的限制。
表面反应机理包括三个基本步骤:吸附、反应和解离(脱附)。
在吸附阶段,参与反应的气体分子会被表面上的吸附位点吸附,并沿表面扩散;在反应阶段,被吸附的分子在表面上进行反应,形成新的化学键;在解离阶段,反应生成物脱离吸附位点离开表面。
表面反应机理的研究包括表面反应中的反应物吸附、化学键形成与解离、表面活性位点的形成与反应动力学等方面,要深入理解表面反应的基本机理和规律,需建立一套完善的表面反应理论。
二、表面反应机理在材料合成中的应用表面反应机理是材料合成过程中不可或缺的重要机制,主要包括两类:化学气相沉积和溶胶-凝胶法。
1. 化学气相沉积化学气相沉积是指将气态前体物质转化成固态薄膜的一种过程。
它利用材料表面反应机理中的表面吸附与表面扩散等机制,在薄膜基底表面上沉积出所需材料。
该方法具有以下特点:1) 可以在较低温度下制备高质量的薄膜;2) 可以制备较大尺寸的晶体薄膜;3) 可以制备多组分复合膜。
2. 溶胶-凝胶法溶胶-凝胶法是指通过溶胶液中物质的相互作用形成胶体颗粒并凝胶固化成固体材料的过程。
在这个过程中,利用表面反应机理形成的胶体颗粒可以从液相到固相的过程中形成不同形式的结构,并形成复杂的材料结构。
包括纳米材料、多相材料、薄膜等。
三、表面反应机理在催化领域中的应用催化技术是一种通过加速化学反应速率、提高选择性和稳定性的方法来改善化学过程的技术。
催化剂表面反应机理解析催化剂是一种物质,在化学反应中起到加速反应速率的作用。
催化剂的表面反应机理是指催化剂表面上发生的化学反应的具体过程和机理。
在催化剂表面上,反应物分子吸附到催化剂表面上的活性位点,并发生一系列的反应步骤,最终生成产物。
本文将对催化剂表面反应机理进行深入解析。
1. 催化剂活性位点催化剂表面上的活性位点是催化剂上具有催化活性的部位。
活性位点可以是催化剂表面上的特定晶面、缺陷位点或者金属离子等。
活性位点可以吸附反应物分子,调整反应物分子的结构、电荷和空间排布,从而降低反应物分子与其他物质的反应能垒,促进化学反应的进行。
2. 反应物吸附在催化剂表面反应中,反应物分子必须首先吸附到催化剂活性位点上。
反应物的吸附是通过吸附位点与反应物之间的物理或化学作用力完成的。
吸附过程可分为物理吸附和化学吸附两种形式。
物理吸附是由于分子之间的范德华力而产生的吸附作用,吸附强度较弱;化学吸附则是通过键结和电荷转移等强化学作用力实现的吸附作用,吸附强度较强。
3. 反应步骤一旦反应物分子被吸附在催化剂活性位点上,催化剂表面的反应就开始了。
催化剂表面反应可以包括多个步骤,其中可能存在中间产物的生成和消耗等复杂过程。
初级反应:催化剂表面上最简单的反应步骤是初级反应,也称为基元反应。
初级反应是指单个或几个反应物分子在催化剂表面上发生的化学反应,如吸附、解吸和分子间反应等。
中间产物:在催化剂表面反应中,中间产物是指在初级反应中生成的但不直接参与最终产物生成的物质。
中间产物在反应过程中可能会经历进一步的变化,最终生成最终产物或再生催化剂。
表面扩散:在催化剂表面反应中,表面扩散是指吸附在催化剂表面上的物质在表面上进行扩散运动的过程。
表面扩散可以影响吸附物质与活性位点之间的相互作用,进而影响整个反应过程的进行。
- 反应产物:最后,通过一系列的反应步骤,催化剂表面上的反应物分子将转化为产物。
产物可以在活性位点上解吸,进入系统其他区域进行再次反应或离开催化剂表面。
界面化学反应动力学过程解析界面化学反应动力学是研究界面中发生的化学反应的速率和机理的科学领域。
它研究平面、界面化学反应的反应速率随温度、浓度以及其他因素的变化规律,以及反应机理。
本文将对界面化学反应动力学过程进行详细解析。
界面化学反应动力学的研究对象主要包括气液界面、液液界面和固液界面等。
其中,气液界面的研究最为广泛,因为大多数化学反应在气体和液体接触的表面上发生。
在气液界面中,吸附和表面反应是界面化学反应的两个主要过程。
吸附是指气体或液体分子在表面附近发生吸附,形成一个吸附层。
吸附可分为物理吸附和化学吸附。
物理吸附通常发生在弱相互作用力作用的情况下,如范德华力和静电作用力。
化学吸附则需要更强的相互作用力,化学键的形成或断裂是化学吸附的重要特征。
表面反应是指吸附分子在表面上发生化学反应,形成新的化学物种。
表面反应速率受到吸附速率和反应速率的共同影响。
吸附速率受到吸附动力学常数和吸附活化能的影响,而反应速率受到反应物浓度、温度和催化剂等的影响。
界面化学反应动力学过程的解析需要建立适当的数学模型来描述反应速率的变化规律。
常用的数学模型包括表面反应速率方程、Langmuir-Hinshelwood模型和Eley-Rideal模型等。
表面反应速率方程是描述表面反应速率与吸附物浓度之间关系的数学表达式。
根据分子碰撞理论,表面反应速率与吸附物浓度的幂函数关系最为常见。
依据实验数据,可以通过拟合确定各个反应物的反应级数和速率常数。
Langmuir-Hinshelwood模型是描述两个吸附物在表面上反应的数学模型。
它考虑了反应物吸附平衡的影响,并将表面反应速率与吸附物浓度的乘积作为反应速率的表达式。
Eley-Rideal模型是指表面吸附物与气体相中的反应物在表面上直接反应的模型。
它将表面吸附物作为催化剂,参与气体相反应物的反应过程。
除了数学模型,界面化学反应动力学的解析还需要实验手段来确定模型中的参数。
常用的实验方法包括光谱分析、电化学技术、原位反应动力学等。
表面反应与化学吸附的关系嘿,你问表面反应与化学吸附的关系呀,那咱就来唠唠。
表面反应和化学吸附呀,它们俩就像是一对亲密的小伙伴,在化学的世界里经常一起玩耍,互相影响呢。
你看啊,化学吸附就像是一个“小媒人”。
它能让气体或者其他物质分子紧紧地贴在固体表面上,就好像两个人手拉手一样亲密。
而且这种吸附不是随随便便的,是有化学反应参与其中的哦。
分子们到了固体表面,会和表面的原子发生一些化学反应,形成一种特殊的结合。
这就为后面的表面反应打下了基础呢。
比如说,氧气分子吸附在金属表面,它和金属原子有了某种“化学反应的小互动”,然后就安安静静地待在那里,等着下一步的“热闹”。
而表面反应呢,就是在这个基础上开始的一场“派对”啦。
有了化学吸附把那些分子拉到表面上,表面反应就有了“主角”们。
这些吸附在表面的分子们开始相互作用,或者和表面的原子进一步反应,发生各种各样的变化。
就像在一个小舞台上,演员们开始表演精彩的节目一样。
比如一氧化碳在催化剂表面发生氧化反应,就是因为一氧化碳先通过化学吸附在催化剂表面,然后和氧气等其他物质在表面上进行反应,变成二氧化碳之类的其他物质。
它们俩的关系可紧密啦。
化学吸附为表面反应提供了场所和反应物,没有化学吸附,那些分子们可能就在空气中飘来飘去,不会乖乖地在表面上发生反应。
而表面反应呢,又会影响化学吸附的情况。
如果表面反应进行得很顺利,可能会让表面的状态发生改变,从而影响后续分子的吸附。
就好像一个派对结束后,场地变了样,下一批来参加派对的人感受也会不一样哦。
我给你举个例子吧。
就像我们在生活中擦黑板,黑板表面就相当于一个固体表面。
粉笔灰吸附在黑板上,这有点像化学吸附。
然后当我们用黑板擦去擦的时候,黑板擦和粉笔灰在黑板表面发生的一些摩擦、清扫的动作,就可以想象成是表面反应。
如果粉笔灰吸附得太牢(化学吸附很强),我们擦起来就会费劲一些,这就说明化学吸附会影响表面反应(擦黑板这个动作)的难易程度。
而我们擦黑板的过程,又会改变黑板表面的干净程度等情况,下次粉笔灰再吸附上去的时候(新的化学吸附),可能也会有所不同哦。
多孔性吸附剂的吸附过程与限速步骤多孔性吸附剂是一种能够通过吸附作用去除气体或液体中某些组分的材料。
吸附过程涉及多种分子间相互作用,包括物理吸附和化学吸附。
在吸附过程中,可能存在一些限速步骤,影响整个吸附过程的速率和效率。
吸附过程通常可以分为以下几个步骤:扩散传质:在吸附过程开始时,待吸附物质从气体或液体相传递到多孔吸附剂的表面,这是一个扩散传质的过程。
在气相吸附中,待吸附分子从气相扩散到吸附剂表面;在液相吸附中,待吸附物质从液相扩散到吸附剂表面。
吸附:一旦待吸附分子到达吸附剂表面,它们会与吸附剂表面上的活性位点发生相互作用,并被吸附在表面上。
这个过程可以是物理吸附(凡得瓦尔斯力为主)或化学吸附(化学键形成为主)。
表面扩散:吸附到表面上的分子在吸附剂表面进行扩散,以便在吸附剂内部找到更稳定的位置。
传质到孔隙内:吸附到表面的分子继续向多孔吸附剂的内部孔隙扩散,以便在孔隙内形成更稳定的吸附态。
孔隙扩散:在孔隙内,分子继续扩散,以寻找更多的吸附位点并与孔隙内表面相互作用。
在整个吸附过程中,可能存在限速步骤,即决定吸附速率和效率的关键步骤。
通常,限速步骤取决于吸附剂的性质、待吸附物质的性质以及吸附条件等。
常见的限速步骤包括:扩散传质:在某些情况下,特别是在低浓度下,扩散传质可能是整个吸附过程的限速步骤。
如果待吸附物质很难从气相或液相传递到吸附剂的表面,吸附过程将受到扩散传质的限制。
表面反应:对于化学吸附,表面反应可能是限速步骤。
如果表面反应速率较慢,那么整个吸附过程将受到表面反应的限制。
孔隙扩散:在高浓度下,吸附剂内部的孔隙扩散可能是限速步骤。
如果孔隙内的分子扩散速率较慢,整个吸附过程将受到孔隙扩散的限制。
了解吸附过程中的限速步骤对于优化吸附过程和提高吸附效率非常重要。
根据不同的情况,可以采取相应的措施,例如改变吸附剂的孔隙结构、调整吸附条件或选择适当的吸附剂类型,来优化吸附过程并提高吸附性能。
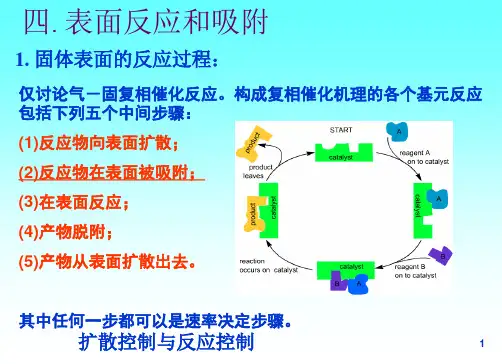
第二章:表面吸附与表面反应•吸附和脱附是催化反应中不可缺少的两步•是催化剂对反应施加作用的基本步骤,可以说,没有反应物吸附就不可能存在催化剂发生催化作用的问题。
•吸附理论是催化作用理论的基础理论§1、吸附现象1、吸附产生的原因2、基本术语图2-1:气体在致密无孔固体表面上的吸附(物理吸附模型)•吸附:气体或液体在固体表面上,或气体在液体表面上的富集过程,这种现象也称之为吸附现象。
•脱附:吸附的逆过程•固体表面层:与吸附物产生相互作用的表面层,一般只有几个原子层厚度。
•吸附量:•吸附物:流体中能被吸附的物质,也称吸附质。
•吸附态:吸附质在表面吸附后的状态。
•吸附剂:能起吸附作用的物质。
•吸附中心:吸附是发生在吸附剂表面上的局部位置•表面吸附络合物:指得是吸附中心与吸附质共同构成的结合体。
3、吸附热效应吸附物在吸附剂上的吸附所产生的热效应。
•表面吸附常常是放热的,这是吸附的必然结果,因为,吸附物在吸附剂上的吸附过程都是自发过程,即:自由能ΔG吸<0而ΔG吸=ΔH吸—TΔS吸即ΔH吸—TΔS吸<0所以ΔH吸<TΔS吸换句话说,若ΔS吸为负值,则ΔH吸也必为负值。
此时,吸附为放热过程。
•吸附物在吸附剂表面上形成了一个更为有序的体系,吸附物分子的自由度数必然减少,所以ΔS吸<0是这种吸附的必然结果,即ΔH吸<0。
•对物理吸附来说,被吸附的分子一定不发生解离,物理吸附一定是放热的。
•对化学吸附来说,被吸附的分子会有两种情况:解离与不解离。
不解离的化学吸附,有ΔS吸<0,吸附过程一定是放热的解离化学吸附,可能有ΔS吸<0或ΔS吸>0,这样,吸附过程就可能为吸热的,也可能是放热的。
如:在适当的温度下,H2在Fe上的吸附:H2+Fe(受S污染)──→H2分子被解离为两个氢原子,且可在Fe表面上作二维自由运动。
被吸附的氢原子的自由度= 2(二维运动)+ 2(振动)= 4两个氢原子的自由度= 4×2 = 8氢分子= 3(三维运动)+ 3(振动+转动)= 6 所以:ΔS吸>0出现H2在Fe上的化学吸附为吸热。
4、吸附平衡是动态平衡从微观的角度来看待吸附过程,就有:V吸= V脱,即吸附与脱附过程是在不断进行着,只是它们的速率相等。
5、化学吸附与物理吸附物理吸附:吸附质是靠它与吸附剂之间的V.D.W.等物理力相互作用而吸附于吸附剂上,这种现象就为物理吸附。
the adsorption energy is typically 5-10 kJ/mol.物理吸附化学吸附•化学吸附:吸附质是靠它与吸附剂表面上吸附中心的剩余自由价相互作用形成一定程度的化学键而吸附于吸附剂上,这种现象就为化学吸附。
Thechemisorptionenergy is 30-70 kJ/mol for molecules and 100-400 kJ/mol for atoms.6、物理吸附,化学吸附与催化(1)、物理吸附与催化I、物理吸附不能活化反应物。
II、用物理吸附来测定催化剂的物理性质,如表面积,孔体积,孔径大小及其分布等。
(2)、化学吸附与催化化学吸附的结果松动了分子内部的化学键,或是完全破裂分子内部的化学键,如•化学吸附在催化中的作用有下面几点:I、化学吸附具有选择性─催化作用具有选择性。
II、化学吸附松动和破裂分子内键─活化反应物。
III、化学吸附用于研究催化剂的活性表面积。
IV、化学吸附对反应物分子化学键的起作用的同时,也影响着吸附剂的电传导性和磁性能。
分析吸附质与吸附剂之间的相互作用程度,可通过分析观测吸附质分子内部化学键和吸附量的变化,吸附剂电传导性能及磁性能的变化。
若与催化性能相关联,可获得最佳催化剂的组成与结构。
化学吸附是催化理论中的基础理论§2、吸附过程的描述1、机理描述用基元步骤表示吸附过程的描述,称为机理描述。
如:2 H2+O2──→2 H2O 在Pt催化剂上低温下发生的反应。
首先进行的是H2和O2在Pt催化剂活性中心上发生吸附,机理为:H2+2Pt──→2H—Pt;O2+2Pt──→2O—Pt;2H—Pt+2O—Pt──→H2O—Pt+Pt;H2O—Pt──→H2O+Pt2、势能曲线(potential energy curve)描述吸附势能(或位能)曲线(或称势能图,位能图)是指吸附物在吸附剂表面上发生吸附或脱附时,吸附体系的能量(势能)随吸附物与吸附剂表面间的距离(d)而变化的曲线。
左图为简单的单分子一维吸附模型,在这个吸附体系中,体系的能量是分子与表面距离的函数,即:E = E(d) 或PE = E(d)(1)、物理吸附当A2距催化剂表面很远时,ER(A-S)=ER(A-S)=∞当A2──→S(催化剂表面)时,ER(A-S)<ER(A-S)=∞当R(A-S)=Rp时,ER(P)最小,出现了最稳定的物理吸附状态,此时所释放的能量就为物理吸附热Qp,一般Rp> 0.3 nm 。
当R(A-S)<Rp时,ER(A-S)能量迅速增大,物理吸附体系不稳定,要么出现物理吸附的脱附,要么出现物理吸附转化为化学吸附。
(2)、物理吸附+分子型化学吸附当R(A-S)<Rp时,ER(A-S)能量逐渐增大,到达X点时,体系极不稳定,要么出现物理吸附的脱附,要么出现物理吸附转化为化学吸附。
如果,此时A2能与吸附中心产生化学作用,则:R(A-S)<Rx时,ER(A-S)能量逐渐减小,直至发生稳定的化学吸附。
物理吸附+分子型化学吸附上述的物理吸附+分子型化学吸附的完整势能曲线吸附能为ΔE(ads),该吸附体系中,吸附物无需活化能,就可转为化学吸附,即Eaads=0。
该吸附体系仍存在脱附活化能Eades,Eades= ΔE (ads)orEades= -ΔH (ads)(3)、物理吸附+分子键断裂的化学吸附在催化剂表面上分子键断裂的化学吸附是常见的一类吸附。
在这种情形中,势能曲线就比前两种要复杂。
以H2在Cu表面上的吸附为例。
实现H2在Cu催化剂表面上产生的化学吸附,有两种方法:(a)气相将H2──→H + H,H再吸附于Cu催化剂表面上。
(b)在有一定外来能量的条件下由物理吸附转化为化学吸附。
(a)(b)(a)气相将H2──→H + H,H再吸附于Cu催化剂表面上。
DH-H≈434kJ/mol ,QC=Qad= ⎢ER(C)-E初⎟=34kJ/mol(b)在有一定外来能量的条件下由物理吸附转化为化学吸附。
首先,H2分子由远而近,接触Cu催化剂表面,产生物理吸附。
由于H2的热运动所致,它可进一步接近Cu表面,即R H-Cu<R P,此时体系能量E H-Cu逐渐上升,H2在Cu表面上的物理吸附不稳定。
当R H-Cu = R J时,体系能量与初始体系的能量一致,H2在Cu表面上不产生物理吸附。
当H2进一步接近Cu表面时,即R H-Cu<R J,E R(H-Cu)>E初。
当到达X点时,即物理吸附势能曲线与热裂解H化学吸附势能曲线的相交点。
在此点,H2与Cu活性中心可形成H2发生化学吸附的过渡态,此过渡态可出现两种情形:情形Ⅰ:沿XCM曲线使体系能量降低,直至H2解离为H原子化学吸附状态H-Cu。
情形Ⅱ:沿XPA曲线,使体系能量增高,直至H2脱附。
X点就为H2在Cu表面上是否发生化学吸附的关键点,与初始体系能量差为:E R(X)-E R(H-Cu)=∞=E ad,称之为化学吸附活化能。
对H2与Cu的体系,E ad=21kJ/mol。
当R H-Cu = R C时,体系的能量E C最小,所释放出的能量为化学吸附热:Q C=Q ad= ⎢E R(C)-E初⎟= 34 kJ/mol 。
当吸附的H从Cu表面上脱附时,沿MCXPA曲线进行。
此时,需要经过X点,吸附的H才能以H2形式脱附。
由C点至X点所需的能量:E R(X)-E R(C)=E des,称之为脱附活化能,上述的物理吸附+分子键断裂的化学吸附的完整势能曲线由于物理吸附热相对于化学吸附热是很小的,一般在化学吸附势能曲线中不画出,如下图:这条势能曲线也可表示吸附物不需经过物理吸附过程,而直接进行化学吸附时体系的势能变化。
从H2在Cu表面上发生化学吸附时体系的势能曲线中,可看到以下几点:Ⅰ、一个分子在催化剂表面上的活化要比气相靠热能活化容易的多。
Ead=21 kJ/mol,解离能DH-H= 434 kJ/mol,两者相差近20倍。
Ⅱ、Edes=QC+Ead这一规律具有普遍性。
在H2-Cu吸附体系中,Edes=55 kJ/mol,Q C=34 kJ/mol,Ead=21 kJ/mol即:QC+Ead=34+21=55 kJ/mol=EdesⅢ、QC>>Qp,在一般的情况下,表面反应动力学过程的势能图中不画出物理吸附势能曲线部分Ⅳ、QC↑,Edes↑,脱附越困难,表面吸附配合物越稳定,吸附质参与反应的性能就越差。
H2在Ni金属表面上的吸附势能曲线O2在金属表面上的吸附势能曲线3、化学吸附势能曲线的几种情况⑴、非活化吸附反应物分子由物理吸附不需活化能而直接进入化学吸附状态,称之为非活化吸附,否则为活化吸附。
如:O2在Pt、Ni、Cu、Ti等金属上的吸附就为非活化吸附。
非活化吸附和活化吸附的势能曲线如下图。
⑵、化学吸附势能曲线与覆盖度(θ)的关系覆盖度(θ):是指吸附剂表面被吸附质占据的程度。
用下式表示:已被反应物占据的表面积/总表面积(可被反应物积占据的)•用势能曲线(位能曲线)来反映整个吸附过程θ0的势能曲线为在覆盖度为零时第一个分子吸附的势能曲线。
θ1>θ0的势能曲线为在θ1下再吸附一个分子时的势能曲线。
θ2>θ1为覆盖度在θ2下再吸附一个分子时的势能曲线。
§3、描述化学吸附强度的指标--吸附热•吸附热反映吸附质与吸附剂之间成键的强度,以及吸附质分子内部结构受破坏的强度。
•吸附热随着θ变化而变化,为催化剂表面的不均匀性造成。
•吸附热作为吸附质与吸附剂之间强弱的量度就是恰当的指标。
•吸附热的表示方法有:微分吸附热、等量吸附热、起始吸附热、积分吸附热。
吸附热的定义及其测定1、积分吸附热定义为:在恒温、恒压下,覆盖度θ由0变至1时,平均吸附1 mol吸附质时所释放的热量。
它反映了吸附物在许多吸附位上吸附时所产生热效应的平均结果。
2、微分吸附热定义为:在某一温度下,覆盖度为θ时,再吸附微量吸附质时所产生的热效应。
如:H2吸附于W丝上时,θ=0 q0= 45kcal/mol;θ=1 q1= 15kcal/mol q微反映了局部吸附位的特征。
•微分吸附热的测定采用安培瓶法直接测定高温、真空下脱气──→冷却至室温──→通入少量氢气──→吸附、并引起金属丝电阻变化──→计算出温升,dT──→由比热计算出,dQ 这种方法的特点是:直接,但准确性差。