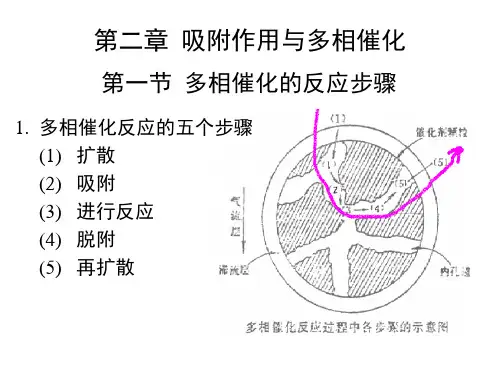
第二章 吸附作用与多相催化
- 格式:pdf
- 大小:7.00 MB
- 文档页数:94








第一节第一节吸吸附附什么是吸附现象当气体液体分子与固体表面接触时由于固体表面与气体相互作用使气体分子附着在固体表面上导致气体在固体表面上的浓度高于它们在体相中的浓度这种现象称吸附现象。
几个需要明确的概念吸附气体或液体的固体称为吸附剂被吸附的气体或液体称为吸附质吸附质在表面吸附后的状态称为吸附态吸附剂表面发生吸附的位置叫吸附中心吸附中心与吸附质共同构成表面吸附物种几个相近的定义几个相近的定义吸附adsorption 气体或液体分子在固相界面层的富集吸收absorption 流体分子渗入固体的体相内吸着sorption 吸附和吸收的集成。
包括表面的吸附、进入物体体相的吸收以及发生在物体孔隙中的毛细管凝结注释日文中的汉字“吸着” 多指吸附。
反应物分子在催化剂表面上吸附和催化过程实际上是发生在反应物分子与固体表面的“活性位”之间的化学作用要了解催化剂表面的活性位首先要了解固体催化剂的表面结构11、固体分类、固体分类结晶体它的结构基元空间是有序的周期的排列。
其特征是短程和长程都有序。
无定形它的结构单元没有形成有序的结构。
其特征是只存在短程有序。
通过XRD来区别结晶体与无定形2、晶体表面的晶面晶体最一般的特点是它具有空间点阵式的结构金属元素的单质有三种典型的结构形式立方体心b.c.c氨合成催化剂α-Fe 立方面心f.c.c金属Pt、Ni 六方密堆积h.c.pLa、α-Ti 金属元素的单质结构模型通常金属催化剂都是由许许多多的微晶组成暴露的晶面是多种多样的影响晶面的暴露比例有热力学和动力学因素晶体在结晶速度很快的条件下成长最终状态受热力学制约。
按热力学能量最低原理晶体表面将形成致密充填的晶面表面能最低其催化活性也最低 3 实际上固体表面不同晶面的暴露比例在很大程度上是取决于晶体长大过程的动力学包括凝聚、扩散、化学反应等过程受外部条件温度、压力、pH值等的影响很大选择合适的制备条件可提高所需晶面在催化剂表面上的比例从而提高催化剂的催化活性。

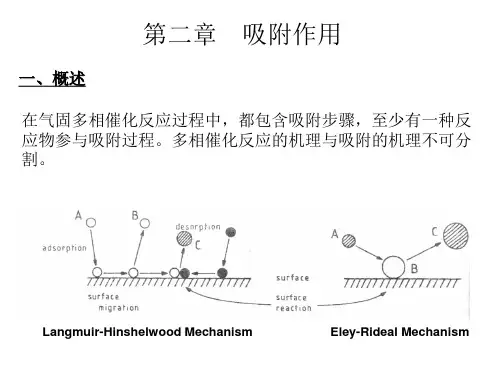
第二章吸附作用一、概述凡气固多相催化反应,都包含吸附步骤.在反应过程中,至少有一种反应物参与吸附过程.多相催化反应的机理与吸附的机理不可分割.固体表面是敞开的,表面原子所处的环境与体相不同,配位不饱和,它受到了一个不平衡力的作用,当气体与清洁固体表面接触时,将与固体表面发生相互作用,气体在固体表面上出现了累积,其浓度高于气相,这种现象称吸附现象( adsorption).与吸收(absorption)不同,吸收发生在体相. 吸附气体的固体物质称为吸附剂.被吸附的气体称为吸附质.吸附质在表面吸附以后的状态称为吸附态.吸附发生在吸附剂表面的局部位置上,这样的位置就叫吸附中心或吸附位.吸附中心与吸附的物质共同构成表面吸附络合物.当固体表面上的气体浓度由于吸附而增加时,称吸附过程,反之,当气体在表面上的浓度减小时,则为脱附过程.二、物理吸附与化学吸附吸附可以分为物理吸附与化学吸附两种.它们的作用力不同.物理吸附是由分子间作用力,即van der W alls 力所产生.由于这种力较弱,故对分子结构影响不大,所以可把物理吸附类比为凝聚现象.化学吸附的作用力属于化学键力(静电与共价键力).由于此种力作用强,涉及到吸附分子和固体间的电子重排、化学键的断裂或形成,所以对吸附分子的结构影响较大.吸附质分子与吸附中心间借此种力形成吸附化学键.化学吸附类似化学反应.由于产生吸附的作用力不同,两种吸附有不同的特征,两者主要特征比较见表2.1.表2.1物理吸附与化学吸附主要特征比较化学吸附物理吸附.(A) 吸附热≥80kJ·mol-10-40kJ·mol-1这是化学吸附的充分,但不是必要的条件(B) 吸附速率常常需要活化,所以速率慢因不需活化,速率快(C) 脱附活化能≥化学吸附热凝聚热(D) 发生温度常常在高温下(高于气体的液化点)接近气体的液化点(E) 选择性有选择性,与吸附质、吸附剂的本性有关无选择性,任何气体可在任何吸附剂上吸附(F) 吸附层单层多层(G) 可逆性可逆或不可逆可逆表2.2和表2.3提供了某些气体的液化潜热、物理吸附热与化学吸附热,以供比较.表2.2某些气体的液化潜热和最大物理吸附热[4]Gas H2O2N2CO CO2CH4C2H4C2H2NH3H2O Cl2 q(kJ/mol) 0.92 6.69 5.61 6.02 25.10 9.12 14.64 24.01 23.26 44.22 18.41 q max(kJ/mol) 8.4 20.9 20.9 25.1 37.7 20.9 33.5 37.7 37.7 58.6 35.6表2.3某些气体的化学吸附热Q(kJ/mol)[4]气体Ti Ta Nb W Cr Mo Mn Fe Co Ni Rh Pt H2188 188 167 71 134 117O2720 494 293 N2586 293CO 640 192 176CO2682 703 552 456 339 372 222 225 146 184NH3301 188 155C2H4577 427 427 285 243 209三、吸附位能曲线吸附过程中,吸附体系(吸附质—吸附剂)的位能变化可以用吸附位能图表示.对大多数物理吸附而言,其位能变化原则上可以使用Lennard-Jones曲线来描述,该曲线原来是用以描述两个气体分子质点在相互靠近时的位能变化.当然在吸附场合就不单单是两个质点间的相互作用,而是吸附分子与表面上的许多原子间的相互作用.这种相互作用的总位能是吸附分子与每一个表面原子作用能量的加合.对这种加合,Lennard-Jones曲线给出的描述基本上是正确的.图2.1是表示分子物理吸附中位能变化的Lennard-Jones图,其中的X表示分子A2距表面无限远位能取作零时与表面的距离.随着分子与表面的接近,位能下降,到Y时发生了物理吸附,放出吸附热Q p,这是物理吸附热.当分子再靠近表面,因排斥作用增强、吸引作用相对减弱,使体系位能上升,由于稳定性原因,体系不能在这样的状态稳定存在.图2.1 A2分子在固体表面S上的物理吸附位能曲线[6]描述活性原子在固体表面上化学吸附的位能变化可用Morse公式近似计算得到,见图2.2的曲线.对大多数化学吸附来说,这种图给出的形状也是类似的.图2.2 活性原子A在固体表面S上的吸附位能曲线[6]X表示活性原子A与表面相距很远时的体系位能。