杂环化合物的碱性顺序总结
- 格式:docx
- 大小:11.89 KB
- 文档页数:1




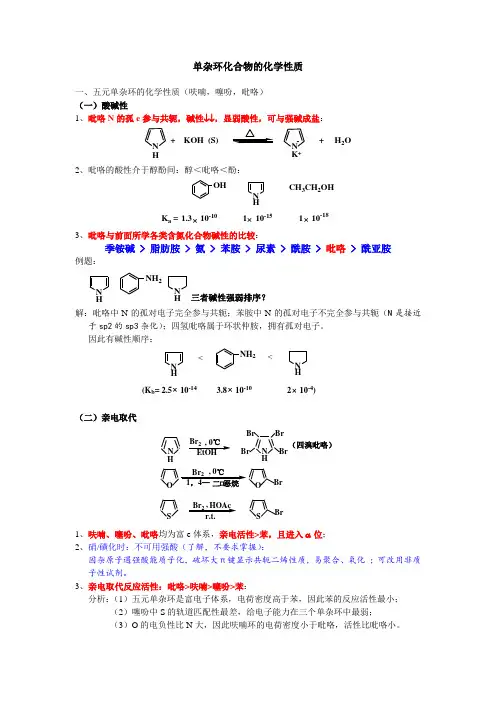
单杂环化合物的化学性质一、五元单杂环的化学性质(呋喃,噻吩,吡咯) (一)酸碱性1、吡咯N 的孤e 参与共轭,碱性↓↓,显弱酸性,可与强碱成盐:+ KOH (S)N K -++ H 2ON H2、吡咯的酸性介于醇酚间:醇<吡咯<酚:N HOHK a =×1.3 10-101 10-181 10-15××CH 3CH 2OH3、吡咯与前面所学各类含氮化合物碱性的比较:季铵碱 > 脂肪胺 > 氨 > 苯胺 > 尿素 > 酰胺 > 吡咯 > 酰亚胺例题:NHN HNH 2三者碱性强弱排序?解:吡咯中N 的孤对电子完全参与共轭;苯胺中N 的孤对电子不完全参与共轭(N 是接近于sp2的sp3杂化);四氢吡咯属于环状仲胺,拥有孤对电子。
因此有碱性顺序:N HNH NH 2<<(K b =×3.8 10-10 2 10-4)2.5 10-14××(二)亲电取代N H O(四溴吡咯)N H Br 2BrBr Br Br, 0℃EtOH Br 2OBrS Br 2HOAcSBr, 0℃,1、呋喃、噻吩、吡咯均为富e 体系,亲电活性>苯,且进入α位;2、硝/磺化时:不可用强酸(了解,不要求掌握):因杂原子遇强酸能质子化,破坏大π键显示共轭二烯性质,易聚合、氧化 ;可改用非质子性试剂。
3、亲电取代反应活性:吡咯>呋喃>噻吩>苯: 分析:(1)五元单杂环是富电子体系,电荷密度高于苯,因此苯的反应活性最小;(2)噻吩中S 的轨道匹配性最差,给电子能力在三个单杂环中最弱;(3)O 的电负性比N 大,因此呋喃环的电荷密度小于吡咯,活性比吡咯小。
(三)加成1、呋喃、噻吩、吡咯芳香性<苯,因此较苯易加成;2、产物失去芳香性,性质类似脂杂环。
N S OHH 2N HH 2H 2H 2H 2N HOS SMoS 2(噻吩能使Pd 中毒)二、六元单杂环的化学性质(吡啶) (一)碱性1、吡啶N 孤e 不参与共轭,因此显碱性:NH Cl -N ++ HCl2、N 孤e 处于sp2杂化轨道,因而碱性↓,碱性介于氨和苯胺之间:CH 3NH 2NH 3NNH 2pK b3.384.768.809.423、与各类含氮化合物碱性比较:季铵碱> 脂胺>氨>吡啶>苯胺>尿素>酰胺>吡咯>酰亚胺(二)亲电取代吡啶属于缺电子体系,环上ρe ↓,因此亲电活性↓,<苯,进入β位:NNBrNO 24SO 3H NN20%71%33%(三)加成(还原)吡啶芳香性<苯,因此比苯易加成(还原),产物为环状仲胺,碱性↑。



含氮杂环化合物碱性排序
新近,有位朋友曾和我提到“氮杂环化合物碱性排序”这个词,对此,我们一
时间都有些不知所措,因为,它让我们感到这个世界之大。
“氮杂环化合物碱性排序”是指由多种氮杂环取代羰基等基团而成的类似化合物,在物理性质和化学反应上,具有一系列重要的特性,因此,有关氮杂环化合物碱性排序的研究得到了广泛的应用和发展,对我们的生活有很大的作用。
“氮杂环化合物碱性排序”的基础上,我们可以运用某种特定的分类办法,将
它们按碱性程度进行排序,是有秩序组织和分析的过程。
这里,主要涉及到以下几种类型:甲基环丙烷、吡咯烷等单环外极碱类,阿拉伯烷基铵等共环外极碱类,吩环烷二胺等芳环碱类,以及芳基事列等混合碱素类。
我们可以大胆设想:此类排序似乎涉及到的学科范围太广,但是,如果能够深
入了解“氮杂环化合物碱性排序”,一定会带给我们很多惊喜;与此同时,它也蕴藏着诸多科学研究的可能性,特别是在生活娱乐方面,它也可以起到不可估量的作用。
综上所述,“氮杂环化合物碱性排序”尚未在我们的日常生活当中被完全把握,但关注它的重要性,让我们有机会去新的领域探索、思考,生活变得有趣而又充实有活力。
杂环化合物的碱性顺序总结
排序应该是:a>c>d>b(吸电子效应,羰基>Cl>OH)。
脂肪胺的碱性强于芳香胺,更强与氮杂芳环的碱性。
所以哌啶的碱性最强。
吡咯的氮的孤对电子参与芳环共轭,但是吡啶类氮原子不参与,有孤对电子,所以吡咯的碱性最弱。
杂环胺碱性比较,应该就是比较氮原子上的那一对孤对电子的活性。
a中N 原子上的孤对电子与共轭双键形成芳香体系,所以,孤对电子的活性最低;b中N原子参与成键了,然后它的那一对孤对电子是在芳香体系外边的,与π键是垂直的关系,基本不受影响。
按碳原子数:
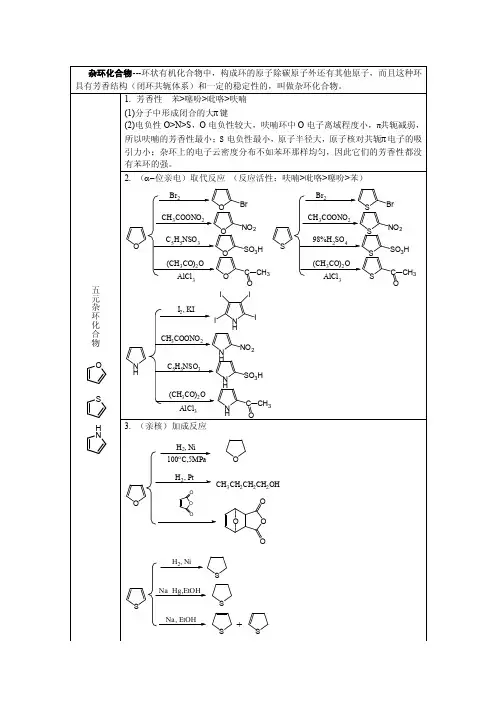
最常见的杂环化合物是五元和六元杂环及苯并杂环化合物等。
五元杂环化合物有:呋喃、噻吩、吡咯、噻唑、咪唑等。
六元杂环化合物有:吡啶、吡嗪、嘧啶、哒嗪等。
稠环杂环化合物有:吲哚、喹啉、蝶啶、吖啶等。
杂环化合物中,最小的杂环为三元环,最常见的是五、六元环,其次是七元环。
杂环的成环规律和碳环一样,最稳定、最常见的杂环也是五元或六元的。
杂环化合物碱性强弱顺序
碱性是指某物质是亲碱性的程度,也就是说,碱性越高,则越容易形成共轭酸基,使溶液变酸,这是由氢离子换离产生的。
在有机化学中,碱性强弱的顺序主要是指杂环化合物的碱性强弱顺序,它定义着在有机化学反应中各类核碱的反应优势。
代表性的杂环化合物的碱性强弱顺序如下,由强到弱:环氧醇>环内酰胺>苯环内酰胺>苯酚>三环内酰胺>环烷基酸>三环酰胺>环烯酰胺>芳香环内酰胺>四环酰胺>四环烯酰胺>四环环烷。
一般来说,碱性越强的物质更容易形成共轭酸基,使溶液变酸,同样也可以用电离常数更好地反映碱性强弱。
结果发现,电离常数与碱性强弱之间有着较好的相关性,即电离常数越大,碱性越高,反之,电离常数越小,碱性越低。
因此,我们可以大致按照以上杂环化合物的电离常数从大到小的顺序归类,以确定各种杂环化合物的碱性强弱顺序。
另外,由于在不同的反应中,物质可能会发生变化,这可能会影响物质的碱性。
比如,某些化学反应会产生活性基团,例如:羟基团或氧基团,而这些活性基团会增强物质的碱性,对此不利的是,当一种化合物中同时含有碱性和酸性活性基团时,比较困难判断它的碱性强弱。
因此,总之,通过研究不同杂环化合物的电离常数可以大致确
定它们的碱性强弱顺序,但是,它们在不同的反应中的碱性强弱可能也不同,应该根据实际情况来判断。
杂环化合物的碱性顺序总结
排序应该是:a>c>d>b(吸电子效应,羰基>Cl>OH)。
脂肪胺的碱性强于芳香胺,更强与氮杂芳环的碱性。
所以哌啶的碱性最强。
吡咯的氮的孤对电子参与芳环共轭,但是吡啶类氮原子不参与,有孤对电子,所以吡咯的碱性最弱。
杂环胺碱性比较,应该就是比较氮原子上的那一对孤对电子的活性。
a中N 原子上的孤对电子与共轭双键形成芳香体系,所以,孤对电子的活性最低;b中N原子参与成键了,然后它的那一对孤对电子是在芳香体系外边的,与π键是垂直的关系,基本不受影响。
按碳原子数:
最常见的杂环化合物是五元和六元杂环及苯并杂环化合物等。
五元杂环化合物有:呋喃、噻吩、吡咯、噻唑、咪唑等。
六元杂环化合物有:吡啶、吡嗪、嘧啶、哒嗪等。
稠环杂环化合物有:吲哚、喹啉、蝶啶、吖啶等。
杂环化合物中,最小的杂环为三元环,最常见的是五、六元环,其次是七元环。
杂环的成环规律和碳环一样,最稳定、最常见的杂环也是五元或六元的。