盐酸法舒地尔标准
- 格式:doc
- 大小:35.00 KB
- 文档页数:6


分类:化学药品类别:3.1【药品名称】通用名:盐酸法舒地尔注射液曾用名:商品名:英文名:Fasudil Hydrochloride Injection汉语拼音:Yansuan Fashudier Zhusheye剂型:注射剂【成分】化学名称:六氢—1—(5—磺酰基异喹啉)—1(H)—1,4—二氮杂卓盐酸盐。
化学结构式:分子式:C14H17N3O2S?HCl分子量:327.83【性状】本品为白色、类白色或微黄色的结晶性粉末。
无臭,味微苦。
有引湿性。
本品在水中极易溶,在甲醇中溶解,在乙醇中略溶,在氯仿中极微溶,在乙醚中几乎不溶。
【药理毒理】盐酸法舒地尔是一种蛋白激酶抑制剂即细胞内钙离子拮抗剂。
血管平滑肌的收缩是由于平滑肌细胞内Ca2+浓度显著增高激活了关键酶的缘故。
当CA2+ 达到一定浓度时,与CA2+结合蛋白钙调素结合,激活肌球蛋白轻链磷酸化酶,将肌球蛋白轻链磷酸化,引起肌肉收缩。
蛛网膜下腔出血时,血管中释放出的各种血管收缩物质参与血管痉挛,最终通过肌球蛋白轻链磷酸化造成血管收缩。
盐酸法舒地尔通过阻断血管收缩过程的最终阶段,肌球蛋白轻链磷酸化,来扩张血管,抑制血管痉挛。
急性毒性:小鼠、大鼠口服给药的LD50分别为:小鼠雄性为273.9 mg/kg;雌性为277.3 mg/kg;大鼠雄性为335 mg/kg;雌性为348 mg/kg。
小鼠静脉给药的LD50 为69.5mg/kg。
亚急性毒性:以大鼠、猴静脉内给药1个月,无毒性剂量为:大鼠12.5mg/kg,猴3.125mg/kg。
慢性毒性:以大鼠、猴静脉内给药6个月,无毒性剂量为:大鼠9mg/kg,猴3.125mg/kg。
致突变性实验:细菌回复突变实验及啮齿类动物微核试验均为阴性。
哺乳类细胞染色体试验证明在体内无致突变性。
生殖毒性试验:妊娠前及妊娠初期的大鼠及大鼠胎仔器官形成期生殖和发育的毒性研究,剂量分别为1.56,6.25,25和1.6,8.0,40mg/kg。
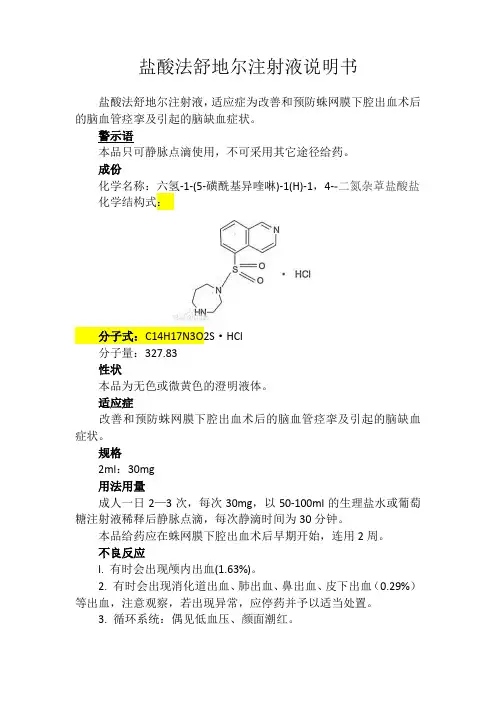
盐酸法舒地尔注射液说明书盐酸法舒地尔注射液,适应症为改善和预防蛛网膜下腔出血术后的脑血管痉挛及引起的脑缺血症状。
警示语本品只可静脉点滴使用,不可采用其它途径给药。
成份化学名称:六氢-1-(5-磺酰基异喹啉)-1(H)-1,4--二氮杂䓬盐酸盐化学结构式:分子式:C14H17N3O2S·HCl分子量:327.83性状本品为无色或微黄色的澄明液体。
适应症改善和预防蛛网膜下腔出血术后的脑血管痉挛及引起的脑缺血症状。
规格2ml:30mg用法用量成人一日2—3次,每次30mg,以50-100ml的生理盐水或葡萄糖注射液稀释后静脉点滴,每次静滴时间为30分钟。
本品给药应在蛛网膜下腔出血术后早期开始,连用2周。
不良反应l. 有时会出现颅内出血(1.63%)。
2. 有时会出现消化道出血、肺出血、鼻出血、皮下出血(0.29%)等出血,注意观察,若出现异常,应停药并予以适当处置。
3. 循环系统:偶见低血压、颜面潮红。
4. 血液系统:偶见贫血、白细胞减少、血小板减少。
5. 有时会出现肝功能异常。
AST(GOT)、ALT(GPT)、ALP、LDH 升高等。
6. 泌尿系统:偶见肾功能异常(BUN、肌酐升高等)、多尿。
7. 消化系统:腹胀、恶心、呕吐等较少见。
8. 过敏症:偶见皮疹等过敏症状。
9. 其他:发热(偶见)、头痛、意识水平低、呼吸抑制(少见)。
禁忌下述患者禁用本品:1.出血患者:颅内出血。
2. 可能发生颅内出血的患者:术中对出血的动脉瘤未能进行充分止血处置的患者。
3. 低血压患者。
注意事项1. 本品只可静脉点滴使用,不可采用其它途径给药(下述患者应慎重用药);(1)术前合并糖尿病的患者、术中在主干动脉有动脉硬化的患者,使用本剂时,应充分观察临床症状及计算机断层摄影,若发现颅内出血,应速停药并予以适当处置;(2)肾功能障碍的患者(例如,1次10 mg);(3)肝功能障碍的患者(有可能延迟代谢,使血药浓度升高而增强作用);(4)严重意识障碍的患者(使用经验少,尚未确立有效性);(5)70岁以上的高龄患者(对预后功能的改善可能无效,尚未确立有效性);(6)蛛网膜下腔出血合并重症脑血管障碍(烟雾病、巨大脑动脉瘤等)的患者(无使用经验,尚未确立有效性及安全性)。




盐酸法舒地尔市场发展现状简介盐酸法舒地尔(化学名:氯化明确尔)是一种抑制胃酸产生的药物,常用于治疗胃溃疡、食道反流性疾病等胃肠道疾病。
本文将重点探讨盐酸法舒地尔在市场中的发展现状。
市场规模自盐酸法舒地尔问世以来,其市场规模逐年增长。
根据行业研究报告,截至2020年底,全球盐酸法舒地尔市场规模已超过数十亿美元。
预计未来几年,随着消费者对胃肠道疾病治疗需求的增加,盐酸法舒地尔市场规模将持续扩大。
市场竞争盐酸法舒地尔市场竞争激烈,主要有多家国内外制药企业参与。
目前,市场上最知名的盐酸法舒地尔品牌包括A公司的“XX明确尔”和B公司的“YY明确尔”等。
这些品牌都通过药店、医院和在线渠道销售。
竞争主要体现在产品质量、价格和市场推广等方面。
为了获得优势,各品牌都加大了研发和生产投入,不断改善产品质量和提高生产效率,以降低成本并提供更合理的价格。
此外,市场推广也是企业间竞争的重要环节,通过广告、促销和医学会议等手段,企业努力提高知名度和市场份额。
市场需求随着人们生活水平的提高和饮食结构的改变,胃肠道疾病的发病率逐年上升。
盐酸法舒地尔作为一种常见的胃肠道疾病治疗药物,具有较高的市场需求。
消费者需求的增加主要源于以下几个方面:1.胃溃疡患者的增多:随着工作压力和生活节奏的加快,胃溃疡患者数量逐年增加。
盐酸法舒地尔可以有效缓解胃酸引起的疼痛,因此受到广大胃溃疡患者的欢迎。
2.食道反流性疾病患者的增加:不规律的饮食、长时间保持一个姿势等因素导致食道反流性疾病患者的数量逐年增加。
盐酸法舒地尔可以减少胃酸的分泌,缓解食道反流引起的不适感。
3.医疗水平提高:随着医疗技术的进步和诊断能力的提高,胃肠道疾病的早期诊断和治疗得以加强。
这推动了盐酸法舒地尔的市场需求增长。
市场前景根据市场研究分析,盐酸法舒地尔市场前景广阔。
在未来几年里,市场规模有望继续增长,主要原因包括:1.人口老龄化带来的市场机遇:随着人口老龄化进程的加快,胃肠道疾病的发病率呈逐年上升趋势。
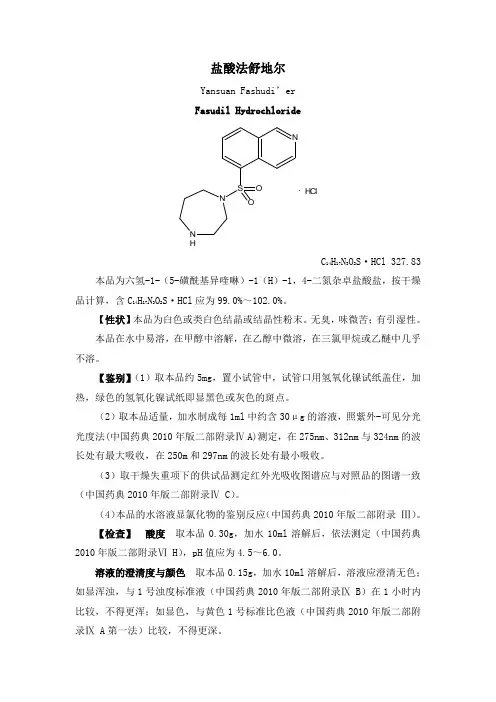
盐酸法舒地尔Yansuan Fashudi’er Fasudil HydrochlorideNS NO ONH.HClC 14H17N3O2S·HCl327.83本品为六氢-1-(5-磺酰基异喹啉)-1(H)-1,4-二氮杂卓盐酸盐,按干燥品计算,含C14H17N3O2S·HCl应为99.0%~102.0%。
【性状】本品为白色或类白色结晶或结晶性粉末。
无臭,味微苦;有引湿性。
本品在水中易溶,在甲醇中溶解,在乙醇中微溶,在三氯甲烷或乙醚中几乎不溶。
【鉴别】(1)取本品约5mg,置小试管中,试管口用氢氧化镍试纸盖住,加热,绿色的氢氧化镍试纸即显黑色或灰色的斑点。
(2)取本品适量,加水制成每1ml中约含30μg的溶液,照紫外-可见分光光度法(中国药典2010年版二部附录ⅣA)测定,在275nm、312nm与324nm的波长处有最大吸收,在250m和297nm的波长处有最小吸收。
(3)取干燥失重项下的供试品测定红外光吸收图谱应与对照品的图谱一致(中国药典2010年版二部附录Ⅳ C)。
(4)本品的水溶液显氯化物的鉴别反应(中国药典2010年版二部附录Ⅲ)。
【检查】酸度取本品0.30g,加水10ml溶解后,依法测定(中国药典2010年版二部附录Ⅵ H),pH值应为4.5~6.0。
溶液的澄清度与颜色取本品0.15g,加水10ml溶解后,溶液应澄清无色;如显浑浊,与1号浊度标准液(中国药典2010年版二部附录Ⅸ B)在1小时内比较,不得更浑;如显色,与黄色1号标准比色液(中国药典2010年版二部附录Ⅸ A第一法)比较,不得更深。
有关物质取本品适量,加流动相制成每1ml中约含0.2mg的溶液,作为供试品溶液,精密量取1ml,置100ml量瓶中,加流动相稀释至刻度,摇匀,作为对照溶液;照含量测定项下的色谱条件,取对照溶液20μl注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高为满量程的10%~20%;再精密量取供试品溶液与对照溶液各20μl,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的4倍。


盐酸法舒地尔治疗78例缺血性脑卒中疗效观察【摘要】目的:分析临床在治疗缺血性脑卒中患者时给予盐酸法舒地尔治疗后的临床效果。
方法:将笔者所在医院收治的155例缺血性脑卒中患者随机分为观察组和对照组,对照组77例患者实施常规治疗,观察组78例患者在对照组基础上加盐酸法舒地尔治疗,比较两组患者治疗后的临床效果。
结果:观察组临床治疗有效率及神经功能缺损评分与对照组比较,差异有统计学意义(p0.05),具有可比性。
1.2 方法对照组实施常规治疗,其中包括:给予患者实施2次/d的甘露醇静脉滴注,剂量为20%甘露醇125 ml,治疗周期为2周;同时给予继之极化液(包括10%葡萄糖溶液500 ml、10%氯化钾溶液15 ml、胰岛素8 u)每日一次静脉滴注,治疗周期为1周。
观察组对照组基础上加盐酸法舒地尔治疗。
盐酸法舒地尔的治疗方法为在100 ml 0.9%氯化钾溶液中加入30 mg盐酸法舒地尔注射液后,为患者实施3次/d的静脉滴注,治疗周期为3周。
1.3 疗效评定标准参照国内相关评定标准,按照患者神经功能缺损评分减少程度对此次治疗后患者的临床效果进行了如下分级:将患者缺损评分减少程度在91%以上的称为治愈;将患者缺损评分减少程度在46%~90%的称为显效;将患者缺损评分减少程度在18%~45%的称为有效;将患者缺损评分减少程度低于17%的称为无效。
临床治疗总有效=治愈+显效+有效。
1.4 统计学方法3 讨论临床上将患者的局部脑组织因血液循环发生障碍而导致的局部脑组织缺氧、缺血坏死现象,继而引起患者发生相应神经功能缺损的症状称为缺血性脑卒中。
近几年对于该病的研究显示rho激酶系统对于该种疾病的发生起着至关重要的作用[2]。
研究显示rho激酶在缺血性疾病中的发生机制主要包含:在动脉粥样硬化、血管痉挛、狭窄等疾病的发生时rho激酶具有重要作;rho激酶会直接影响患者体内神经网络的形成及对神经轴突再生及生长产生抑制作用;对患者体内细胞的凋亡具有促进作用[3]。

盐酸法舒地尔在冠心病不稳定性心绞痛患者的应用效果分析【摘要】目的:调查和研究盐酸法舒地尔对治疗冠心病不稳定性心绞痛患者在临床上的应用效果。
方法:调查对象为2012年1-10月在笔者所在医院治疗的60例冠心病不稳定性心绞痛患者,将所有患者分为治疗组30例和对照组30例,对照组进行常规基础治疗,治疗组在常规治疗基础上采用盐酸法舒地尔治疗,观察两组治疗后的临床反应。
结果:治疗组总有效率为93.3%。
对照组总有效率为66.7%,两组比较差异有统计学意义(p50%。
排除肝肾功能较差以及有脑部出血病史的患者,最后将60例患者分为治疗组30例和对照组30例。
两组患者一般资料比较差异无统计学意义(p>0.05)。
1.2 方法两组患者入院后均行心电监护和心电图监测,均给予硝酸酯类药物、阿司匹林、氯吡格雷、低分子肝素、他汀类调脂药等常规治疗;治疗组在常规治疗的基础上外加用盐酸法舒地尔30 mg,加入200 ml氯化钠静脉滴注,2周一疗程。
1.3 疗效评价标准参照1979年全国冠心病心绞痛座谈会修订的《冠心病的诊断参考标准》。
显效:症状消失或基本消失,心电图恢复大致正常或达到正常。
有效:心绞痛发作次数减少以及硝酸甘油消耗量在40%~70%。
心电图t波由平坦变为直立。
无效:心绞痛发作次数减少以及硝酸甘油消耗减少不到50%。
症状和体征没有任何改变,心电图和治疗前没有任何变化[2]。
1.4 统计学处理采用spss 16.0软件对各变量进行正态性检验和描述性分析,计量资料以均数±标准差(x±s)表示,计数资料以绝对值或者构成比表示,如果计量资料呈正态分布且方差齐,计量资料比较比较采用t检验,如果计量资料不符合正态性分布,则用秩和检验,计数比较以绝对值或者构成比表示,采用字2检验,p<0.05表示差异具有统计学意义。
2 结果2.1 两组治疗前后心绞痛疗效比较治疗组显效25例,有效3例,总有效率为93.3%。
0引言盐酸法舒地尔是异喹啉磺胺衍生物,能抑制细胞内游离钙离子的活动,还能抑制蛋白激酶A、G、C 和肌球蛋白轻链激酶,即抑制平滑肌收缩最终阶段的肌球蛋白轻链磷酸化,使血管平滑肌舒张,扩张血管。
用于蛛网膜下腔出血后脑血管痉挛引起的缺血性脑血管疾病症状的改善。
为了观察盐酸法舒地尔注射液制剂的用药安全,按照国家SFDA颁发的《化学药物刺激性、过敏性和溶血性研究技术指导原则》,进行了实验兔血管刺激性、肌肉刺激性、溶血性盐酸法舒地尔注射液局部用药安全评价试验研究ExperimentforLocalDrugSecurityEvaluationofFasudilHydrochlorideInjection张俊明丁琦王丽华李良郑国安徐丽瑛Zhang Junming Ding Qi Wang Lihua Li Liang Zheng Guoan Xu Liying(江西省药物研究所,江西南昌330029)(Jiangxi Institute of Mater Medica,Jiangxi Nanchang330029)摘要:目的:研究盐酸法舒地尔注射液局部用药的安全性。
方法:按照国家SFDA颁发的《化学药物刺激性、过敏性和溶血性研究技术指导原则》进行了局部血管刺激性、肌肉刺激性、溶血性和全身主动过敏性试验。
结果:①盐酸法舒地尔注射液耳缘静脉点滴给药浓度为0.3mg/ml,给药容积为2.0ml/kg,对试验兔血管无刺激性;②盐酸法舒地尔注射液肌肉注射给药浓度为15mg/ml,给药容积为0.5ml/只时,对试验兔肌肉无刺激性;③盐酸法舒地尔注射液药物浓度为0.3mg/ml,在体外试验条件下无溶血反应及红细胞凝聚反应;④盐酸法舒地尔注射液致敏剂量为1.5和4.5mg/kg,激发剂量为3.0和9.0g/kg时,对豚鼠无主动全身过敏性反应,与阴性对照组比较,差异无显著性意义(p>0.05)。
结论:盐酸法舒地尔注射液试验条件下无血管和肌肉刺激性、无溶血性及过敏性反应。
专利名称:一种盐酸法舒地尔的合成与制备方法专利类型:发明专利
发明人:孟俊秀,汪艺宁,顾大公,殷西锋
申请号:CN201210090443.5
申请日:20120331
公开号:CN102603715A
公开日:
20120725
专利内容由知识产权出版社提供
摘要:本发明公开一种盐酸法舒地尔的合成与制备方法,以5-异喹啉磺酸为原料,在二氯亚砜中回流制得5-异喹啉磺酰氯盐酸盐,经冰水溶解后,加入二氯甲烷,调节溶液pH值至中性后分液。
有机相经水、食盐水洗涤、干燥、抽滤,制得5-异喹啉磺酰氯的二氯甲烷溶液。
该溶液在其他碱性试剂存在的条件下与高哌嗪反应,反应结束后,反应液经盐酸水溶液、氢氧化钠水溶液洗涤,洗涤液分别用二氯甲烷萃取。
有机相合并、水洗、干燥、抽滤,滴加饱和氯化氢乙醇溶液,析出盐酸法舒地尔粗品。
该粗品用乙醇水溶液重结晶后制得盐酸法舒地尔。
本发明通过使用低廉的除酸试剂,大大减少了价格昂贵的高哌嗪使用量,从而有效降低了盐酸法舒地尔的制备成本。
申请人:苏州工业园区南华生物科技有限公司
地址:215021 江苏省苏州市工业园区金鸡湖大道1355号国际科技园
国籍:CN
代理机构:苏州广正知识产权代理有限公司
代理人:张利强
更多信息请下载全文后查看。
盐酸法舒地尔脂质体的制备及其对炎性内皮细胞的改善作用莫莹莹;李京涛;梁彬彬;吴棘【期刊名称】《广西医科大学学报》【年(卷),期】2022(39)9【摘要】目的:探索盐酸法舒地尔脂质体的最佳制备方法,评价其对血管紧张素Ⅱ(AngⅡ)诱导的炎性内皮细胞的改善作用。
方法:采用薄膜分散法制备盐酸法舒地尔脂质体,以包封率为评判标准优化制备方案,并检测其粒径及电位、模拟体外释放实验、细胞摄取等相关性质。
体外培养人脐静脉内皮细胞(HUVECs),将其分为对照组、AngⅡ组、载药脂质体组及空白脂质体组,CCK8法观察载药脂质体对细胞活力的影响,硝酸还原法检测细胞培养上清液一氧化氮(NO)含量,酶联免疫吸附试验(ELISA)法测定细胞培养上清液中细胞间黏附分子-1(ICAM-1)、血管细胞黏附分子-1(VCAM-1)含量。
结果:盐酸法舒地尔脂质体平均粒径为(185.12±20.90)nm,平均电位为(-25.22±1.23)mV,包封率(91.48±5.46)%,载药量(41.86±2.35)%,体外模拟释放在24 h内可释放出约87.62%所包封的药物,能被细胞成功摄取。
与AngⅡ组和空白脂质体组比较,载药脂质体组能明显减弱AngⅡ对内皮细胞活力的抑制作用,载药脂质体组NO含量升高,VCAM-1、ICAM-1含量降低(P<0.01)。
结论:盐酸法舒地尔脂质体为纳米制剂,包封率及载药量高,能成功被HUVECs摄取,可达到长效缓释的效果,改善AngⅡ引起的内皮细胞炎性作用。
【总页数】6页(P1371-1376)【作者】莫莹莹;李京涛;梁彬彬;吴棘【作者单位】广西医科大学第一附属医院超声科【正文语种】中文【中图分类】R943【相关文献】1.禽传染性支气管炎核酸疫苗脂质体的制备及其理化性质的研究2.盐酸法舒地尔对血管紧张素Ⅱ诱导内皮细胞的炎性保护作用3.盐酸米诺环素脂质体控释凝胶改善大鼠实验性牙周炎的作用评价4.禽传染性支气管炎病毒脂质体核酸疫苗的制备5.硫酸氨基葡萄糖脂质体的制备及其对骨关节炎的治疗作用因版权原因,仅展示原文概要,查看原文内容请购买。
盐酸法舒地尔Yansuan Fashudi’er Fasudil Hydrochloride
N
S N
O O
N
H
.HC l
C14H17N3O2S·HCl327.83本品为六氢-1-(5-磺酰基异喹啉)-1(H)-1,4-二氮杂卓盐酸盐,按干燥品计算,含C14H17N3O2S·HCl应为99.0%~102.0%。
【性状】本品为白色或类白色结晶或结晶性粉末。
无臭,味微苦;有引湿性。
本品在水中易溶,在甲醇中溶解,在乙醇中微溶,在三氯甲烷或乙醚中几乎不溶。
【鉴别】(1)取本品约5mg,置小试管中,试管口用氢氧化镍试纸盖住,加热,绿色的氢氧化镍试纸即显黑色或灰色的斑点。
(2)取本品适量,加水制成每1ml中约含30μg的溶液,照紫外-可见分光光度法(中国药典2010年版二部附录Ⅳ A)测定,在275nm、312nm与324nm的波长处有最大吸收,在250m和297nm的波长处有最小吸收。
(3)取干燥失重项下的供试品测定红外光吸收图谱应与对照品的图谱一致(中国药典2010年版二部附录Ⅳ C)。
(4)本品的水溶液显氯化物的鉴别反应(中国药典2010年版二部附录Ⅲ)。
【检查】酸度取本品0.30g,加水10ml溶解后,依法测定(中国药典2010年版二部附录ⅥH),pH值应为4.5~6.0。
溶液的澄清度与颜色取本品0.15g,加水10ml溶解后,溶液应澄清无色;
如显浑浊,与1号浊度标准液(中国药典2010年版二部附录ⅨB)在1小时内比较,不得更浑;如显色,与黄色1号标准比色液(中国药典2010年版二部附录ⅨA第一法)比较,不得更深。
有关物质取本品适量,加流动相制成每1ml中约含0.2mg的溶液,作为供试品溶液,精密量取1ml,置100ml量瓶中,加流动相稀释至刻度,摇匀,作为对照溶液;照含量测定项下的色谱条件,取对照溶液20μl注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高为满量程的10%~20%;再精密量取供试品溶液与对照溶液各20μl,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的4倍。
供试品溶液中如显杂质峰,单个杂质峰的峰面积不得大于对照溶液主峰面积的0.3倍(0.3%),各杂质峰面积之和不得大于对照溶液主峰面积(1.0%)。
残留溶剂甲醇、乙醇、二氯甲烷和二甲基甲酰胺(DMF)
甲醇、乙醇、二氯甲烷
内标溶液制备称取乙酸乙酯50mg置10ml量瓶中,用二甲基甲酰胺稀释至刻度,摇匀,即得。
测定法取本品1.0g,精密称定,置10ml量瓶中,精密加入内标溶液1ml,用二甲基甲酰胺溶解并稀释至刻度,摇匀,作为供试品溶液。
精密称取甲醇30mg 和乙醇50mg,置同一10ml量瓶中,加二甲基甲酰胺稀释至刻度,摇匀,作为储备溶液1;精密称取二氯甲烷60mg,置10ml量瓶中,加二甲基甲酰胺稀释至刻度,摇匀,精密量取1ml置10ml量瓶中,加二甲基甲酰胺稀释至刻度,摇匀,作为储备溶液2;分别精密量取上述储备溶液1ml,置同一10ml量瓶中,精密加入内标溶液1ml,用二甲基甲酰胺稀释至刻度,摇匀,作为对照品溶液。
照气相色谱法(中国药典2010年版二部附录ⅤE)测定,AOV-1301毛细管色谱柱;柱温:程序升温,初温40℃,保持3分钟,以20℃/分钟升至160℃,保持2分钟;载气N2:0.1MPa;流速:H2,30ml/min及空气300ml/min。
检测器温度:220℃;注样器温度:220℃。
精密量取各溶液1μl,快速注入气相色谱仪,甲醇、乙醇、二氯甲烷和乙酸乙酯依次出峰。
记录色谱图,按内标法以峰面积计算,含甲醇、乙
醇和二氯甲烷均应符合规定。
二甲基甲酰胺(DMF)
测定法取本品约1.0g,精密称定,置10ml量瓶中,加甲醇适量,超声5分钟,用甲醇稀释至刻度,摇匀,离心,取上清液,作为供试品溶液。
精密称取DMF44mg,置10ml量瓶中,用甲醇稀释至刻度,摇匀,精密量取2ml置10ml 量瓶中,加甲醇稀释至刻度,摇匀,精密量取1ml置10ml量瓶中,用甲醇稀释至刻度,摇匀,作为对照品溶液。
照气相色谱法(中国药典2010年版二部附录ⅤE)测定,AOV-1301毛细管色谱柱;柱温:75℃,恒温;检测器温度:200℃;注样器温度:200℃;载气N2:0.1MPa;流速:H2,30ml/min及空气300ml/min。
精密量取各溶液1μl,快速注入气相色谱仪,记录色谱图,按外标法以峰面积计算DMF的含量,含DMF应符合规定。
干燥失重取本品,在150℃干燥4小时,减失重量不得过2.5%(中国药典2010年版二部附录ⅧL)。
炽灼残渣取本品1.0g,依法检查(中国药典2010年版二部附录ⅧN)。
遗留残渣不得过0.1%。
重金属取炽灼残渣项下遗留的残渣,依法检查(中国药典2010年版二部附录ⅧH 第二法),含重金属不得过百万分之二十。
【含量测定】照高效液相色谱法(中国药典2010年版二部附录ⅤD)测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;以0.08mol/L磷酸二氢钾溶液-乙腈-10%四丁基氢氧化铵溶液-三乙胺(88:12:0.5:2.5)(用磷酸调节pH值至7.0)为流动相;检测波长为220nm。
理论板数按盐酸法舒地尔峰计算应不低于3000。
取本品适量,精密称定,加流动相溶解并定量稀释制成每1ml中约含20µg 的溶液,作为供试品溶液,精密量取20μl注入液相色谱仪,记录色谱图。
另精密称取经150℃干燥4小时的对照品适量,同法操作,按外标法以峰面积计算,
即得。
【类别】血管扩张药。
【贮藏】密封,在干燥处保存。
【有效期】24个月。
【制剂】盐酸法舒地尔注射液
盐酸法舒地尔注射液
Yansuan Fashudi’er Zhusheye
Fasudil Hydrochloride Injection
本品为盐酸法舒地尔的灭菌水溶液。
含盐酸法舒地尔(C14H17N3O2S·HCl)应为标示量的90.0%~110.0%。
【性状】本品为无色或微黄色的澄明液体。
【鉴别】(1)取本品2ml,置水浴上蒸干(或近干),取残留固体约5mg,置小试管中,试管口用氢氧化镍试纸盖住,加热,绿色的氢氧化镍试纸即显黑色或灰色斑点。
(2)取本品适量,加水稀释制成每1ml中约含有30μg的溶液,照紫外-可见分光光度法(中国药典2010年版二部附录ⅣA)测定,在275nm、312nm、324nm波长处有最大吸收,在250nm、297nm波长处有最小吸收。
(3)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
【检查】pH值应为5.7~6.3(中国药典2010年版二部附录VI H)。
颜色取本品,与黄色1号标准比色液(中国药典2010年版二部附录ⅨA 第一法)比较,不得更深。
有关物质取本品适量,加流动相稀释制成每1ml中约含盐酸法舒地尔
0.2mg的溶液,作为供试品溶液;精密量取1ml,置100ml量瓶中,用流动相稀释至刻度,摇匀,作为对照溶液。
照含量测定项下的色谱条件,取对照溶液20μl注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高为满量程的10%~20%;再精密量取供试品溶液与对照溶液各20μl,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的4倍。
供试品溶液中如显杂质峰,单一杂质峰的峰面积不得大于对照溶液主峰面积的0.3倍(0.3%),各杂质峰面积之和不得大于对照溶液主峰面积(1.0%)。
细菌内毒素取本品,依法检查(中国药典2010年版二部附录ⅪE),每1ml含细菌内毒素的量应小于0.5EU。
无菌取本品,依法检查(中国药典2010年版二部附录ⅪH),应符合规定。
其他应符合注射剂项下有关的各项规定(中国药典2010年版二部附录I B)。
【含量测定】照高效液相色谱法(中国药典2010年版二部附录V D)测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;以0.08moL/L磷酸二氢钾溶液-乙腈-10%四丁基氢氧化铵-三乙胺(88:12:0.5:2.5)(用磷酸调节pH值7.0)为流动相;检测波长为220nm。
理论板数按法舒地尔峰计算应不低于3000。
测定法精密量取本品适量,用流动相稀释制成每1ml中含盐酸法舒地尔20μg的溶液,作为供试品溶液。
精密量取20μl注入液相色谱仪,记录色谱图。
另
取盐酸法舒地尔对照品适量,精密称定,加流动相溶解并稀释制成每1ml中含20μg的溶液,同法测定,按外标法以峰面积计算,即得。
【类别】血管扩张药。
【规格】2ml:30mg
【贮藏】遮光,密闭保存。
【有效期】暂定24个月。