单核细胞增生李斯特菌临床感染及实验室检测
- 格式:ppt
- 大小:8.07 MB
- 文档页数:52


㊃论著㊃D O I:10.3969/j.i s s n.1672-9455.2024.01.014产妇及新生儿单核细胞增生李斯特菌感染情况分析*张霞1,董瑞谦2ә山东省济南市妇幼保健院:1.检验科;2.院感科,山东济南250001摘要:目的探讨该院单核细胞增生李斯特菌(简称单增李斯特菌)感染发病情况及预防治疗措施㊂方法回顾性选取2012-2021年该院检出的单增李斯特菌阳性病例为研究对象,统计分析其科室分布㊁发病及抗感染治疗情况㊂结果检出的阳性病例为产妇及其分娩新生儿㊂产科出院患者单增李斯特菌感染率为7.63/ 100000,分娩新生儿单增李斯特菌感染率为4.68/100000㊂全院产妇㊁新生儿单增李斯特菌感染率为5.32/ 100000㊂感染产妇分娩新生儿死亡率与正常分娩产妇的新生儿死亡率比较,差异有统计学意义(P<0.05)㊂经验性抗感染治疗,产妇用药选择针对单核李斯特菌敏感的青霉素类抗菌药物的病例数远少于新生儿,二者比较差异有统计学意义(P<0.05)㊂结论产妇单增李斯特菌感染率虽低,但危害大,经验性抗感染治疗应首选对单增李斯特菌敏感的抗菌药物㊂关键词:单核细胞增生李斯特菌;发病率;抗感染治疗;产妇;新生儿中图法分类号:R714.62文献标志码:A文章编号:1672-9455(2024)01-0061-04A n a l y s i s o n L i s t e r i a m o n o c y t o g e n e s i n f e c t i o n i n p a r t u r i e n t s a n d n e o n a t e s*Z HA N G X i a1,D O N G R u i q i a n2ә1.D e p a r t m e n t o f C l i n i c a l L a b o r a t o r y;2.D e p a r t m e n t o f I n f e c t i o n M a n a g e m e n t,J i n a n M u n i c i p a l M a t e r n a la n d C h i l d H e a l t h C a r e H o s p i t a l,J i n a n,S h a n d o n g250001,C h i n aA b s t r a c t:O b j e c t i v e T o e x p l o r e t h e i n f e c t i o n o n s e t,p r e v e n t i o n a n d t r e a t m e n t m e a s u r e s o f L i s t e r i a m o n o-c y t o g e n e s i n f e c t i o n i n t h i s h o s p i t a l.M e t h o d s T h e c a s e s o f d e t e c t e d L i s t e r i a m o n o c y t o g e n e s p o s i t i v e d u r i n g 2012-2021w e r e r e t r o s p e c t i v e l y s e l e c t e d a s o b j e c t s.T h e i r d e p a r t m e n t s d i s t r i b u t i o n,o n s e t a n d i n f e c t i o n t r e a t-m e n t w e r e s t a t i s t i c a l l y a n a l y z e d.R e s u l t s T h e d e t e c t e d p o s i t i v e c a s e s w e r e t h e p a r t u r i e n t s a n d t h e i r d e l i v e r e d n e w b o r n s.T h e i n f e c t i o n r a t e o f L i s t e r i a m o n o c y t o g e n e s i n t h e o b s t e t r i c d i s c h a r g e d p a t i e n t s w a s7.63/100000, t h e i n f e c t i o n r a t e o f L i s t e r i a m o n o c y t o g e n e s i n t h e d e l i v e r e d n e w b o r n s w a s4.68/100000.T h e i n c i d e n c e r a t e o f L i s t e r i a m o n o c y t o g e n e s i n f e c t i o n i n t h e p a r t u r i e n t s a n d n e u b o r n s i n t h e w h o l e h o s p i t a l w a s5.32/100000. T h e r e w a s a s t a t i s t i c a l l y s i g n i f i c a n t d i f f e r e n c e i n n e o n a t a l m o r t a l i t y r a t e b e t w e e n t h e i n f e c t e d p a r t u r i e n t s a n d n o r m a l l y d e l i v e r e d n e w b o r n s(P<0.05).T h e n u m b e r o f t h e p a t i e n t s w i t h e m p i r i c a n t i-i n f e c t i o n t r e a t m e n t a n d t h e p a r t u r i e n t p a t i e n t s w i t h t h e m e d i c a t i o n s e l e c t i n g p e n i c i l l i n a n t i b i o t i c s w h i c h w e r e s e n s i t i v e t o L i s t e r i a m o n o c y t o g e n e s w a s m u c h l e s s t h a n t h e n e w b o r n s,a n d t h e d i f f e r e n c e w a s s t a t i s t i c a l l y s i g n i f i c a n t(P<0.05).C o n c l u s i o n T h e i n f e c t i o n r a t e o f L i s t e r i a m o n o c y t o g e n e s i n t h e p a r t u r i e n t s i s l o w,b u t w h i c h h a s g r e a t h a r m. T h e e m p i r i c a n t i-i n f e c t i o n t r e a t m e n t s h o u l d p r e f e r r e d f o r s e l e c t i n g t h e a n t i b a c t e r i a l a g e n t s c o v e r i n g L i s t e r i a m o n o c y t o g e n e s s e n s i t i v i t yK e y w o r d s:L i s t e r i a m o n o c y t o g e n e s;i n c i d e n c e r a t e;a n t i i n f e c t i o n t r e a t m e n t;p a r t u r i e n t s;n e w b o r n李斯特菌病是由单核细胞增生李斯特菌(简称单增李斯特菌)引起的一种罕见而严重的食源性感染疾病,表现为败血症㊁神经李斯特菌病和母婴感染㊂在怀孕期间,它可能导致孕妇无症状或发烧㊁头痛㊁腹泻㊁肌痛㊁早产㊁胎儿丢失以及新生儿全身和中枢神经系统感染㊂母体李斯特菌病大多在妊娠中期和晚期,作为散发病例或在暴发的情况下被报道㊂属于克隆复合体1㊁4和6的菌株被称为高毒力菌株,与母体新生儿感染最为相关㊂新生儿可由母体绒毛膜羊膜炎导致早发败血症或通过胃肠道单增李斯特菌定植的产道发生 迟发性 脑膜炎[1-3]㊂2015年,欧洲一项2 224例单增李斯特菌感染病例报道显示,该病总病死率为18.8%[4]㊂2011-2016年,中国19个省份报告253例单增李斯特菌感染患者,病死率为25.7%,但㊃16㊃检验医学与临床2024年1月第21卷第1期 L a b M e d C l i n,J a n u a r y2024,V o l.21,N o.1*基金项目:山东省济南市卫生健康委员会科技计划项目(2022-1-41)㊂作者简介:张霞,女,副主任技师,主要从事临床检验和生化检验研究㊂ә通信作者,E-m a i l:d o n g r u i q i a n@163.c o m㊂网络首发h t t p://k n s.c n k i.n e t/k c m s/d e t a i l/50.1167.R.20231019.1316.002.h t m l(2023-11-28)死亡人数不包括孕妇或儿童[5]㊂尽管已知单增李斯特菌对孕产妇和新生儿有极大危害,但临床研究相对匮乏,如产科㊁出院患者的发病率㊁单增李斯特菌感染导致的孕妇流产率㊁孕妇单增李斯特菌感染的经验性抗菌药物选择及有效性评价㊂本研究回顾性分析2012-2021年本院检出的产妇及新生儿单增李斯特菌感染病例,旨在为单增李斯特菌感染的诊断㊁预防㊁治疗提供依据㊂1资料与方法1.1一般资料采用回顾性调查方法选取本院产科2012-2021年检出单增李斯特菌的产妇与新生儿病例为研究对象,其中9例活产产妇,5例流产产妇,9例新生儿,共23例㊂纳入标准:(1)单增李斯特菌培养阳性;(2)产妇(均为单胎)及其所分娩新生儿;(3)病历资料完整㊂排除标准:(1)非孕产妇;(2)非宫内感染新生儿㊂本研究经本院伦理委员会审批(审批号:2023-01-057)㊂1.2方法1.2.1数据采集通过病历检索系统收集目标菌检出情况,查阅目标病例,提取病历中患者入院基本信息㊁用药记录㊁手术情况㊁生命体征(体温)㊁临床表现㊁微生物培养结果㊁出院诊断㊁日常病程,以及中性粒细胞比例㊁降钙素原㊁C反应蛋白检测结果等㊂1.2.2研究分组以无菌标本或密切关联标本检出单增李斯特菌为依据纳入分析㊂以分娩后胎儿是否成活为次级指标,将产妇分为成活组(9例)和流产组(5例)㊂1.3统计学处理采用S P S S24.0统计软件对所有数据进行统计处理和分析㊂符合正态分布的计量资料以xʃs表示;不符合正态分布的计量资料以M (P25,P75)表示㊂计数资料以例数或率表示,组间比较采用χ2检验㊂以P<0.05为差异有统计学意义㊂2结果2.1检出年份及例数查询2012年1月至2021年12月本院产科单增李斯特菌阳性产妇和新生儿病例23例,其中2019年检出最多,为6例,2015年和2017年为0例㊂其中,成活组产妇9例,流产组产妇5例㊂分娩新生儿9例㊂2.2成活组母子检出情况成活组9例产妇分娩,其中成活新生儿8例,另外1例新生儿出生5d后死亡㊂7例产妇单增李斯特菌检测阳性,所分娩新生儿5例阳性;2例产妇单增李斯特菌检测阴性但所分娩新生儿阳性㊂1例产妇表现为重度感染㊂7例产妇检出标本分别为羊水3例,全血3例,阴道分泌物3例,胎膜1例㊂其中,1例产妇全血㊁羊水㊁胎膜标本均为阳性,1例全血㊁阴道分泌物均为阳性㊂本组产妇中5例为足月生产,大于37周㊂5例产后出现发热㊁中重度绒毛膜羊膜炎,但愈后良好㊂其中8例产妇治疗均首选头孢类抗菌药物或奥硝唑,之后6例调整为青霉素类或碳青霉烯类抗菌药物㊂另外1例阴道分泌物检出单增李斯特菌,但无感染表现,经阴道分娩,产后4d出院,未使用抗菌药物治疗㊂经统计,9例产妇分娩孕周(35.84ʃ3.02)周,人均检出全血㊁羊水㊁阴道分泌物阳性标本数为1(0,1)例,胎动减少㊁腹痛㊁腹胀㊁胎心增速㊁发热㊁见红的相关异常主诉数为2(1,2)条,产前最高体温(37.7ʃ1.2)ħ,产后最高体温(38.7ʃ1.3)ħ,各病例绒毛膜羊膜炎㊁胎儿窘迫㊁先兆早产㊁脓毒症㊁羊膜腔感染㊁泌尿系统感染㊁阴道炎等相关出院诊断或病理诊断数为3(2,3)条,分娩方式:8例剖宫产㊁1例经阴道分娩,平均住院天数为8.5(7.0,11.0)d,预后均良好㊂经统计,9例新生儿(其中1例死亡),人均检出全血㊁咽拭子㊁粪便阳性标本数为1(1,1)例,新生儿表现为发热㊁窒息㊁呼吸困难㊁三凹征㊁血便等感染阳性体征数为1(1,1)条,最高体温(37.4ʃ0.5)ħ,新生儿窒息㊁败血症㊁心肌损伤㊁消化道出血㊁肺出血㊁新生儿肺炎㊁新生儿化脓性脑膜炎感染相关诊断数为2(1,5)条,使用敏感抗菌药物为3(2,3)种,出生体质量(2678.9ʃ548.4)g,住院时间为15(7,16)d㊂7例治愈,1例手术,1例死亡㊂成活组9例产妇,孕周均大于32周,其中5例37周以上㊂例2分娩的新生儿因早发宫内严重感染死亡㊂例1因 停经32周㊁胎动减少3d㊁下腹坠胀伴腰酸0.5d 入院就诊㊂例2因 不规律下腹痛伴阴道流水5h 入院,入院9h后因发热㊁胎心减速进行剖宫产㊂孕妇带菌时间长,导致胎儿宫内感染严重而死亡㊂例3阴道分泌物检出阳性菌,但产后发热,其子出现血便,诊断为败血症㊂例4羊水标本检出单增李斯特菌,但自身感染较轻,分娩住院7d后出院,其子未检出阳性菌,但出现发热等感染表现,治疗7d后出院㊂例5因 自觉胎动消失1d,胎心监护150~170次/分 入院,分娩后除自身感染较重,诊断为脓毒症外,新生儿诊断败血症㊁化脓性脑膜炎,但母子经治疗结局良好㊂例6仅阴道分泌物检出阳性菌,产妇自身无感染表现,其子出生后出现发热,血培养阳性,治疗16d痊愈出院㊂例7第1次入院表现为单增李斯特菌感染,但病原学检查未检出阳性菌,诊断为上呼吸道感染㊂第2次入院后,全血㊁羊水㊁胎膜标本均检出阳性菌㊂例8入院药物治疗也未首先考虑单增李斯特菌感染㊂例9,停经38周+2,发热伴胎动减少1d,血培养阳性,所分娩新生儿未检出单核李斯特菌,母子均治愈出院㊂9例新生儿中7例新生儿检出阳性菌,标本来源分别为全血7例,咽拭子2例,粪便1例,其中2例检测全血和咽拭子标本同时阳性,1例检测全血和粪便标本同时阳性㊂8例治疗首选青霉素类抗菌药物或美罗培南,1例首选头孢类抗菌药物,后调整为青霉素类抗菌药物㊂㊃26㊃检验医学与临床2024年1月第21卷第1期 L a b M e d C l i n,J a n u a r y2024,V o l.21,N o.12.3流产组产妇情况5例流产产妇检出单增李斯特菌,2013㊁2014㊁2018年各1例,2019年2例㊂5例产妇流产或死胎引产,流产孕周为22~28周,共同特征为发热,入院时3例死胎,2例宫缩频繁,均在入院当日流产或引产㊂5例产妇愈后良好㊂检出单增李斯特菌标本分别为羊水1例㊁全血2例㊁阴道分泌物2例㊂3例治疗首选头孢类抗菌药物,1例首选红霉素, 1例首选奥硝唑和阿莫西林㊂经统计,流产组5例产妇流产孕周(24.43ʃ2.46)周,人均检出羊水㊁全血㊁阴道分泌物阳性标本数为1(1,1)例,胎动消失㊁发热㊁腹痛㊁阴道流血㊁排出妊娠组织的相关异常主诉为(2.20ʃ0.45)条,产前最高体温(38.6ʃ0.9)ħ,产后最高体温(36.3ʃ0.7)ħ,死胎㊁绒毛膜羊膜炎㊁胎膜早破㊁难免流产㊁羊膜腔感染㊁脓毒血症㊁泌尿系统感染的相关诊断为2(1,3)条,使用敏感抗菌药物病例为3(2,3)例,均预后良好㊂5例产妇流产或死胎引产,孕周均在28周以下㊂综合5例主诉,大部分于发热1d以上或胎动消失后就诊,错失救治最佳时机㊂回顾性病例分析发现,分娩前2周,患者出现发热㊁呕吐㊁腹泻㊁子宫收缩等表现㊂2.4经验性治疗抗菌药物选择使用抗菌药物治疗的9例成活组产妇㊁5例流产组产妇及9例新生儿,产妇感染治疗首选青霉素类抗菌药物0例,新生儿感染治疗首选青霉素类抗菌药物8例㊂经验性使用抗菌药物治疗过程中,所选择的抗菌药物针对单增李斯特菌敏感的病例数,18例产妇中有0例,新生儿9例中有8例,两组用药选择情况比较,差异有统计学意义(P=0.003)㊂2.5涉及感染产妇胎儿结局比较14例产妇纳入研究,其中活产9例,流产5例㊂活产9例中,1例5d 后死亡,单增李斯特菌感染产妇分娩新生儿死亡率为111.11ɢ(1/9)㊂本院2012-2021年报告1岁以内婴儿死亡率为1.42ɢ(215/151174),正常分娩新生儿死亡率为1.06ɢ(160/151174)㊂单增李斯特菌感染产妇分娩新生儿死亡率与正常分娩产妇的新生儿死亡率比较,差异有统计学意义(P=0.011)㊂2.6产妇㊁新生儿感染单增李斯特菌发病情况产科出院患者单增李斯特菌感染率为7.63/100000,分娩新生儿单增李斯特菌感染率为4.68/100000㊂全院产妇㊁新生儿单增李斯特菌感染率为5.32/ 100000㊂3讨论单增李斯特菌感染对胎儿的成活有重大影响㊂单增李斯特菌对头孢类抗菌药物具有天然耐药性,经验性抗感染用药应首选青霉素类抗菌药物,这对于预防单增李斯特菌感染病例发生严重后果有重要意义㊂但本研究涉及的病例由于用药习惯,在经验性抗感染治疗中,首选青霉素类抗菌药物治疗的病例明显少于首选头孢类抗菌药物等治疗的病例,经验性用药选择有差异㊂本研究汇总了10年发病数据,发病率的基础数据来源时间跨度更长,依据更充分㊂本机构检出的单增李斯特菌感染病例均为产妇及其分娩新生儿,其他科室如妇科㊁外科㊁儿科等未见检出㊂本研究从统计学角度,分析单增李斯特菌感染对胎儿丢失的影响,而以往研究侧重于病例个案[6-9],或针对所有医疗机构㊁所有人群的发病情况[10],或基于国外该菌感染病例数据㊂本研究结果和结论有助于妇幼保健机构孕产妇的精细化管理,有助于消除单增李斯特菌感染早期治疗的不利因素,有助于增加经验用药选择的合理性㊂李斯特菌病感染建议以青霉素为基础的治疗(大剂量青霉素或阿莫西林)结合庆大霉素治疗侵袭性感染;复方三噁唑可用于对青霉素不耐受的患者[11]㊂妊娠期间不明原因发热患者应高度警惕,如疑为单增李斯特菌感染,经验性治疗应选择有效的抗菌药物㊂单增李斯特菌对头孢类抗菌药物具有天然耐药性,推荐剂量主要基于单增李斯特菌脑膜炎治疗建议,3~12 g/d,持续7~28d,直至分娩;或阿莫西林100 m g/(k g㊃d),持续2周,联用与阿莫西林具有协同作用的庆大霉素5m g/(k g㊃d),持续3~5d㊂为了使抗菌药物有效渗透到宿主细胞,保持较高细胞内浓度,需维持足够药物浓度或保持p H值不变[12]㊂单增李斯特菌经口进入人体,首先到达小肠黏膜,再经循环系统和淋巴结进入其他器官㊂单增李斯特菌是细胞内细菌,易隐藏于宿主细胞,某些内联蛋白有利于单增李斯特菌攻击宿主细胞,一旦进入细胞,单增李斯特菌就会释放李斯特菌溶素和磷脂酶,溶解液泡膜㊂当单增李斯特菌到达细胞质时,侵蚀宿主细胞的细胞骨架,迅速增殖并促进肌动蛋白丝发育,使感染细胞的肌动蛋白丝在一个极点聚合,形成肌动蛋白尾和细菌细胞间传递所需的突起,有利于细菌在细胞内移动,穿透细胞质并最终到达质膜㊂随后,该菌利用质膜突起和细胞间扩散感染邻近细胞㊂单增李斯特菌这种特殊的细胞内循环作用机制使其避免接触细胞外环境,逃避人类的T细胞免疫,从一个细胞移动到另一个细胞,继续感染其他器官和组织㊂此外,抗体㊁补体㊁中性粒细胞也失去了对宿主细胞的保护作用㊂单增李斯特菌的毒力取决于受感染者的免疫力㊁菌株类型和感染范围㊂摄入104~106菌株/克食物即可导致李斯特菌感染㊂对于免疫缺陷高危人群,其感染所需菌株量更低[13]㊂有研究报道,产妇单增李斯特菌感染潜伏期较长,该病潜伏期为19.0~27.5d,比神经系统疾病(9 d)和菌血症(2d)更长[14-16]㊂李斯特菌感染主要发生在妊娠晚期(66%),而不是妊娠早期(3%),并可导致严重感染甚至新生儿死亡[17-19]㊂㊃36㊃检验医学与临床2024年1月第21卷第1期 L a b M e d C l i n,J a n u a r y2024,V o l.21,N o.1本研究虽然汇总了本院10年的产妇㊁新生儿单增李斯特菌感染数据,但样本量相对较少,数据来自一家机构,还有待于扩大样本量及数据覆盖面㊂妇女儿童是社会的重要群体,是国家妇女儿童发展纲要的重要关注对象㊂关注国民全生命周期健康,首先要关注妇女儿童健康,关注影响妇女㊁儿童生命健康的每一个环节㊂临床需提高对妊娠期感染李斯特菌的认识,早期诊断,早期治疗可明显改善母婴愈后㊂本研究既从统计学角度对单增李斯特菌感染的发病率及对产妇㊁新生儿的影响程度提供了数据,又从抗感染经验性用药的早期治疗方面提出了建议㊂参考文献[1]C HA R L I E R C,D I S S O N O,L E C U I T A M.M a t e r n a l-n e o-n a t a l l i s t e r i o s i s[J].V i r u l e n c e,2020,11(1):391-397. [2]S C H L E C H W F.E p i d e m i o l o g y a n d c l i n i c a l m a n i f e s t a-t i o n s o f l i s t e r i a m o n o c y t o g e n e s i n f e c t i o n[J].M i c r o b i o l S p e c t r,2019,7(3):14.[3]I V O V A N W,J O N A S T B,MA R T I N C,e t a l.R e t r o s p e c-t i v e v a l i d a t i o n o f w h o l e g e n o m e s e q u e n c i n g-e n h a n c e d s u r-v e i l l a n c e o f l i s t e r i o s i s i n E u r o p e,2010t o2015[J].E u r o S u r v e i l l,2018,23(33):1700798.[4]L I W,B A I L,F U P,e t a l.T h e e p i d e m i o l o g y o f l i s t e r i am o n o c y t o g e n e s i n C h i n a[J].F o o d b o r n e P a t h o g D i s,2018, 15(8):459-466.[5]WA N G Z Y,T A O X J,L I U S,e t a l.A n u p d a t e r e v i e w o n l i s t e r i a i n f e c t i o n i n p r e g n a n c y[J].I n f e c t D r u g R e s i s t, 2021,14:1967-1978.[6]宋敏,牟瑞丽,张琳琳,等.妊娠合并单核李斯特菌感染7例临床分析[J].现代妇产科进展,2021,30(3):200-203.[7]曹世姣,叶柳青,李会琴.妊娠合并李斯特菌感染7例临床分析[J].国际妇产科学杂志,2020,47(5):584-589.[8]卫蔷,张力,刘兴会,等.妊娠期单核细胞增多性李斯特菌感染并文献复习[J/C D].中华妇幼临床医学杂志(电子版),2018,14(2):218-223.[9]张心红,王凤英.妊娠晚期李斯特菌感染致胎死宫内1例临床分析并文献复习[J].检验医学与临床,2021,18(3) 429-431.[10]H E R R A D O R Z,G H E R A S I M A,L O P E Z-V E L E Z R,e ta l.L i s t e r i o s i s i n S p a i nb a s e d o n h o s p i t a l i s a t i o n r ec o rd s,1997t o2015:n e e d f o r g r e a t e r a w a r e n e s s[J].E u r o S u r-v e i l l,2019,24(21):1800271.[11]MA R I A V I,N I S HA R,L U K E S M,e t a l.L i s t e r i a m o n o-c y t o g e n e s i n f e c t i o n s:p r e s e n t a t i o n,d i a g n o s i s a n d t re a t-m e n t[J].B r J H o s p M e d(L o n d),2021,82(10):1-6.[12]石璐,唐莲,李静静,等.临床药师参与围产期李斯特菌病治疗一例[J].临床药物治疗杂志,2022,20(4):85-88.[13]WA N G Z Y,T A O X J,L I U S,e t a l.A n u p d a t e r e v i e w o n l i s t e r i a i n f e c t i o n i n p r e g n a n c y[J].I n f e c t D r u g R e s i s t, 2021,14:1967-1978.[14]A N G E L O K M,J A C K S O N K A,WO N G K K,e t a l.A s-s e s s m e n t o f t h e i n c u b a t i o n p e r i o d f o r i n v a s i v e l i s t e r i o s i s [J].C l i n I n f e c t D i s,2016,63(11):1487-1489.[15]G O R L E T V,K I N G L A,V A I L L A N T,e t a l.W h a t i s t h ei n c u b a t i o n p e r i o d f o r l i s t e r i o s i s[J].B M C I n f e c t D i s, 2013,13(1):11.[16]C HA R L I E R C,G O F F I F I N E T F,A Z R I A E,e t a l.L e c u i t.I n a d e q u a t e m a n a g e m e n t o f p r e g n a n c y-a s s o c i a t e d l i s t e r i o-s i s:l e s s o n s f r o m f o u r c a s e r e p o r t s[J].C l i n M i c r o b i o l I n-f e c t,2014,20(3):246-249.[17]F O U N T I K H S I M I E,M O H A N A R A J-A N T O N A,H O-R T E I B,e t a l.L i s t e r i o s i s i n p r e g n a n c y:a n u m b r e l l a r e v i e w o f m a t e r n a l e x p o s u r e,t r e a t m e n t a n d n e o n a t a l c o m p l i c a t i o n s[J].B J O G,2022,129(9):1427-1433.[18]A N T O N I O S A,L I D I A A C,J O SÉR B,e t a l.L a t e s t i l l-b i r t h d u e t o l i s t e r i o s i s[J].A u t o p s C a s e R e p,2018,8(4): e2018051.[19]J O SÉA V,E M I L I A K,MA R I E L A S.L i s t e r i a p l a c e n t a li n f e c t i o n[J].m B i o,2017,8(3):e00949.(收稿日期:2023-04-10修回日期:2023-10-15)(上接第60页)e t a l.C D4+T c e l l d e r i v e d N G A L m o d if i e s t h e o u t c o m e o fi s c h e m i c a c u t e k i d n e y i n j u r y[J].J I mm u n o l,2020,204(3):586-595.[13]L I U X,Z HA O X,D U A N X,e t a l.K n o c k o u t o f N G A La g g r a v a t e s t ub u l o i n t e r s t i t i a l i n j u r y i n a m o u s e m o d e l o fd i a be t i c n e p h r o p a t h y b y e n h a n c i n g o x i d a t i v e s t r e s s a n df i-b r o s i s[J].E x p T h e r M e d,2021,21(4):321.[14]张会芬,杨宏秀,刘丽,等.血清中性粒细胞明胶酶相关脂质运载蛋白㊁胱抑素C及尿白蛋白肌酐比值㊁N-乙酰-β-D-氨基葡萄糖苷酶检测在早期糖尿病肾脏疾病中的应用价值[J].中国糖尿病杂志,2018,26(4):309-315. [15]董照刚,郑喜胜,贾明雅,等.尿N A G㊁血P C T及S O F A评分对脓毒症患者急性肾损伤的预测价值[J].中华医院感染学杂志,2020,30(23):3534-3538.[16]朱晶洁,吴磊,王春,等.血清鸢尾素㊁胱抑素C㊁视黄醇结合蛋白联合检测在早期糖尿病肾病诊断中的应用[J].糖尿病新世界,2022,25(14):9-12.[17]朱晗玉.糖尿病肾病诊断及预后生物学标志物的研究现状与展望[J].中华实用诊断与治疗杂志,2018,32(1):1-4.[18]张驰,谢晓慧,郑芳芳,等.血清F e t u i n-A㊁N G A L对糖尿病肾病的早期诊断价值[J].中国现代医学杂志,2023,33(1):1-6.[19]张志斌,温庆辉,张锡波.高血压肾病早期血清C y s C㊁β2-MG和尿N A G㊁R B P水平检测及临床意义[J].海南医学,2021,32(23):3024-3027.[20]张佳思,邹春波,卢宇,等.血脂蛋白磷脂酶A2和中性粒细胞明胶酶相关脂质运载蛋白在诊断早期糖尿病肾病中的价值[J].上海交通大学学报(医学版),2021,41(6): 770-775.(收稿日期:2023-03-11修回日期:2023-10-12)㊃46㊃检验医学与临床2024年1月第21卷第1期 L a b M e d C l i n,J a n u a r y2024,V o l.21,N o.1。


社区获得性单核细胞增生李斯特菌败血症的临床和实验室特点分析曹敬荣;闵嵘;王育英;谢威;赵琪彦;王培昌【期刊名称】《检验医学与临床》【年(卷),期】2016(013)018【总页数】2页(P2696-2697)【关键词】单核细胞增生;李斯特菌;败血症;血培养;rRNA;质谱分析【作者】曹敬荣;闵嵘;王育英;谢威;赵琪彦;王培昌【作者单位】首都医科大学宣武医院检验科,北京100053;首都医科大学宣武医院检验科,北京100053;首都医科大学宣武医院检验科,北京100053;首都医科大学宣武医院检验科,北京100053;首都医科大学宣武医院检验科,北京100053;首都医科大学宣武医院检验科,北京100053【正文语种】中文单核细胞增生李斯特是一种胞内寄生菌,适应力强,在冰箱内可缓慢生长,是冷藏食品威胁人类健康的主要病原菌之一,食用冰箱内单核细胞增生李斯特污染的食品是引起社区获得性感染的常见途径之一[1-5]。
本文就本院收治的1例李斯特菌败血症患者进行了报道。
1.1 病历资料患者,男性,102岁,因7 d内排暗红色血便3次,发热1 d出现昏迷,急性发病入院。
既往高血压病史30年,重度贫血,可疑恶性肿瘤1年。
入院查体:体温38.9 ℃,心率大于90次/分,气促,昏睡状态。
双肺呼吸音粗,可闻及粗大湿罗音,腹韧以右下腹为著,压痛及反跳痛不配合。
血常规示白细胞15.37×109/L,中性粒细胞85.2%,Hb 89 g/L,CRP 111 μmmol/L,降钙素原(PCT)0.734 mg/L,病情危重。
急诊给予拉氧头孢、美罗培南及奥硝唑治疗,体温未见下降。
临床结合患者发病特点和实验室检查高度怀疑脓毒血症,3次抽血培养均报告阳性(阳性报警时间15 h),分离菌鉴定为单核细胞增生李斯特菌。
详询病史发现其发病前有饮用牛奶及隔夜剩菜史,确定社区获得性单核细胞增生李斯特菌败血症诊断,临床根据经验治疗及药敏结果联合使用抗李斯特菌药物治疗后患者体温下降,复查血培养阴性,症状和体征好转出院。

龙源期刊网 单核细胞增生李斯特菌检测技术是什么作者:周林来源:《学习与科普》2019年第31期单核细胞增生李斯特菌包含在食源性致病菌范围当中。
就目前来看,免疫学检测方法和分子学检测方法是很多单增李斯特菌检测方法中使用最频繁的两种方法。
免疫学检测方法具有操作简便、时间短的特点,然而其非常依赖高特异性的抗体,结果容易出现失误,需要对检测结果进行详细判定。
和免疫学检测法相比,分子学检测方法具有灵敏度高、省时省力等特点,然而分子学检测方法在使用过程中需要较多的操作经验,同时不能在大批量检测中应用。
一、单核细胞增生李斯特菌概述(一)生物学特征单核细胞增生李斯特菌是一种革兰阳性短杆菌,其对营养的需求量较少,生长温度通常最低不能低于2摄氏度,最高不能超过42摄氏度,同时可以在弱酸、弱碱和6.5%NaCl肉汤中得到快速成长,并且能够形成β-溶血。
在其生长过程中还可以发酵出很多种糖类物质,按照O抗原以及H抗原能够分解成十三中血清型,其中1/2a与4b这两种类型在致病菌株中的占比最大。
(二)污染源及流行病学单核细胞增生李斯特菌是自然界中常见的一种致病菌,抗冻能力非常强,其主要传播路径是通过粪-口这种方式进行。
健康人粪便中的单核细胞增生李斯特菌携带率通常为0.6%至16.0%,然而奶制品、水产品以及家禽中均携带相应的单核细胞增生李斯特菌。
另外,单核细胞增生李斯特菌通过胎盘、黏膜、性以及产道鞥部位都可以进入到体内,从而导致感染。
单核细胞增生李斯特菌的致病性与其具有的毒作用、宿主的免疫状况以及年龄具有密不可分的关系,宿主的细胞免疫可以有效的解除单核细胞增生李斯特菌中存在的病菌。
各种免疫力弱的人群都属于易感人群,比如新生儿、四十岁以上的成人等。
健康成人感染后会出现和感冒相似的情况,然而其他免疫力功能较低的人可能会出现更加严重的症状,乃至会直接死亡。
二、相关检测技术(一)聚合酶链反应技术就目前来看,聚合酶链反应技术得到了广泛的普及与运用。




单核细胞增生李斯特菌培养方法前言本文档旨在介绍一种关于单核细胞增生李斯特菌(L is te ri am on oc yt o ge ne s)的培养方法。
这种培养方法可以帮助研究人员在实验室中有效地培养和研究单核细胞增生李斯特菌,提供便利的实验操作流程和相关规范。
材料和试剂-培养基:大肠杆菌肉汤培养基(LB Br ot h)。
-平板培养基:L BA ga r平板。
-培养器具:试管、枪口鳌头瓶、平板培养基瓶。
-紧缩酶(R es tr ic ti o nE nz ym es):用于D NA修饰。
步骤1.准备试管:将适量的LB Br ot h培养基加入试管中,每株文化需要一个试管。
试管要标记清楚,以便记录。
2.孵育菌种:将单核细胞增生李斯特菌取出,置于L BA ga r平板上,静置于37°C培养箱中孵育12-16小时。
3.菌种接种:从平板上挑取一小块单核细胞增生李斯特菌菌落,用枪口鳌头瓶内的紧缩酶捉摄菌落悬液,均匀地滴入LB Br oth培养基试管中。
4.培养:将接种的试管放入37°C恒温培养箱中,培养12-16小时。
在培养过程中,营养条件适宜的单核细胞增生李斯特菌会迅速繁殖生长。
5.存储:选择健康生长、菌量适宜的菌株,用含有20%甘露醇的L B Br ot h培养基制备菌液,并将其分装保存于枪口鳌头瓶中,并在-80°C低温冰箱中保存,确保菌株的长期保存。
结论本文档提供了一种针对单核细胞增生李斯特菌的培养方法。
通过遵循上述步骤,我们可以在实验室中成功培养和研究单核细胞增生李斯特菌。
这一方法的重要性在于为相关研究提供了可靠的实验操作流程,并且可以在不同实验室间进行标准化操作。
希望本文档能够对相关研究工作者提供帮助,并促进单核细胞增生李斯特菌领域的研究进展。
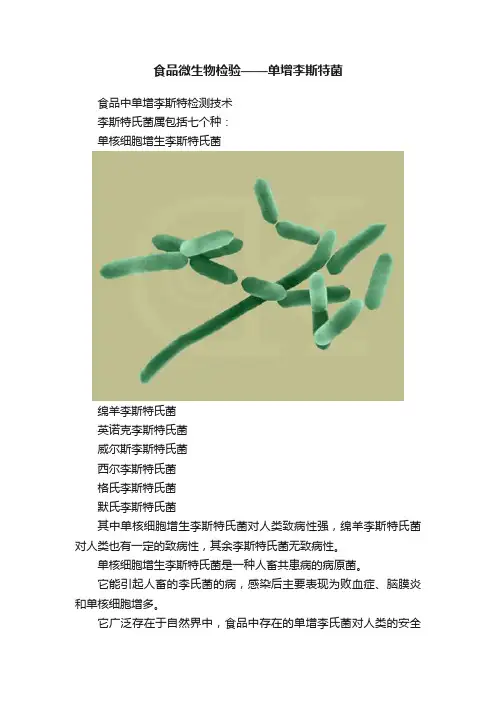
食品微生物检验——单增李斯特菌食品中单增李斯特检测技术李斯特氏菌属包括七个种:单核细胞增生李斯特氏菌绵羊李斯特氏菌英诺克李斯特氏菌威尔斯李斯特氏菌西尔李斯特氏菌格氏李斯特氏菌默氏李斯特氏菌其中单核细胞增生李斯特氏菌对人类致病性强,绵羊李斯特氏菌对人类也有一定的致病性,其余李斯特氏菌无致病性。
单核细胞增生李斯特氏菌是一种人畜共患病的病原菌。
它能引起人畜的李氏菌的病,感染后主要表现为败血症、脑膜炎和单核细胞增多。
它广泛存在于自然界中,食品中存在的单增李氏菌对人类的安全具有危险,该菌在4℃的环境中仍可生长繁殖,是冷藏食品威胁人类健康的主要病原菌之一,因此,在食品卫生微生物检验中,必须加以重视。
该菌为革兰氏阳性短杆菌,大小约为0.5μmх 1.0-2.0μm,直或稍弯,两端钝圆,常呈V字型排列,偶有球状、双球状。
兼性厌氧、无芽胞,一般不形成荚膜,但在营养丰富的环境中可形成荚膜,在陈旧培养中的菌体可呈丝状及革兰氏阴性。
该菌有4根周毛和1根端毛,但周毛易脱落。
该菌营养要求不高,在20--25℃培养有动力,穿刺培养2-5天可见倒立伞状生长,肉汤培养物在显微镜下可见翻跟斗运动。
该菌的生长范围为2--42℃(也有报道在0℃能缓慢生长),最适培养温度为35--37℃,在pH中性至弱碱性(pH9.6)、氧分压略低、二氧化碳张力略高的条件下该菌生长良好,在pH3.8-4.4能缓慢生长,在6.5% NaCl 肉汤中生长良好。
在固体培养基上,菌落初始很小,透明,边缘整齐,呈露滴状,但随着菌落的增大,变得不透明。
在5-7%的血平板上,菌落通常也不大,灰白色,刺种血平板培养后可产生窄小的β-溶血环。
在0.6%酵母浸膏胰酪大豆琼脂(TSAYE)和改良Mc Bride(MMA)琼脂上,用45度角入射光照射菌落,通过解剖镜垂直观察,菌落呈兰色、灰色或兰灰色。
该菌触酶阳性,氧化酶阴性。
发酵多种糖类,产酸不产气。
如发酵葡萄糖、乳糖、水杨素、麦芽糖、鼠李糖、七叶苷、蔗糖(迟发酵)、山梨醇、海藻糖、果糖。

食品安全国家标准食品微生物学检验单核细胞增生李斯特氏菌检验1范围本标准规定了食品中单核细胞增生李斯特氏菌(L i s t e r i am o n o c y t o g e n e s)的检验方法㊂本标准第一法适用于食品中单核细胞增生李斯特氏菌的定性检验;第二法适用于单核细胞增生李斯特氏菌含量较高的食品中单核细胞增生李斯特氏菌的计数;第三法适用于单核细胞增生李斯特氏菌含量较低(<100C F U/g)而杂菌含量较高的食品中单核细胞增生李斯特氏菌的计数,特别是牛奶㊁水以及含干扰菌落计数的颗粒物质的食品㊂2设备和材料除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:2.1冰箱:2ħ~5ħ㊂2.2恒温培养箱:30ħʃ1ħ㊁36ħʃ1ħ㊂2.3均质器㊂2.4显微镜:10x~100x㊂2.5电子天平:感量0.1g㊂2.6锥形瓶:100m L㊁500m L㊂2.7无菌吸管:1m L(具0.01m L刻度)㊁10m L(具0.1m L刻度)或微量移液器及吸头㊂2.8无菌平皿:直径90mm㊂2.9无菌试管:16mmˑ160mm㊂2.10离心管:30mmˑ100mm㊂2.11无菌注射器:1m L㊂2.12单核细胞增生李斯特氏菌(L i s t e r i a m o n o c y t o g e n e s)A T C C19111或C M C C54004,或其他等效标准菌株㊂2.13英诺克李斯特氏菌(L i s t e r i a i n n o c u a)A T C C33090,或其他等效标准菌株㊂2.14伊氏李斯特氏菌(L i s t e r i a i v a n o v i i)A T C C19119,或其他等效标准菌株㊂2.15斯氏李斯特氏菌(L i s t e r i a s e e l i g e r i)A T C C35967,或其他等效标准菌株㊂2.16金黄色葡萄球菌(S t a p h y l o c o c c u s a u r e u s)A T C C25923或其他产β-溶血环金葡菌,或其他等效标准菌株㊂2.17马红球菌(R h o d o c o c c u s e q u i)A T C C6939或N C T C1621,或其他等效标准菌株㊂2.18小白鼠:I C R体重18g~22g㊂2.19全自动微生物生化鉴定系统㊂3培养基和试剂3.1含0.6%酵母浸膏的胰酪胨大豆肉汤(T S B-Y E):见A.1㊂3.2含0.6%酵母浸膏的胰酪胨大豆琼脂(T S A-Y E):见A.2㊂3.3李氏增菌肉汤L B(L B1,L B2):见A.3㊂3.41%盐酸吖啶黄(a c r i f l a v i n eH C l)溶液:见A.3.2.1㊁A.3.2.2㊂3.51%萘啶酮酸钠盐(n a l a d i x i c a c i d)溶液:见A.3.2.1㊁A.3.2.2㊂3.6 P A L C AM琼脂:见A.4㊂3.7革兰氏染液:见A.5㊂3.8S I M动力培养基:见A.6㊂3.9缓冲葡萄糖蛋白胨水[甲基红(M R)和V-P试验用]:见A.7㊂3.105%~8%羊血琼脂:见A.8㊂3.11糖发酵管:见A.9㊂3.12过氧化氢试剂:见A.10㊂3.13李斯特氏菌显色培养基㊂3.14生化鉴定试剂盒或全自动微生物鉴定系统㊂3.15缓冲蛋白胨水:见A.11㊂第一法单核细胞增生李斯特氏菌定性检验4检验程序单核细胞增生李斯特氏菌定性检验程序见图1㊂图1单核细胞增生李斯特氏菌定性检验程序5操作步骤5.1增菌以无菌操作取样品25g(m L)加入到含有225m LL B1增菌液的均质袋中,在拍击式均质器上连续均质1m i n~2m i n;或放入盛有225m LL B1增菌液的均质杯中,以8000r/m i n~10000r/m i n均质1m i n~2m i n㊂于30ħʃ1ħ培养24hʃ2h,移取0.1m L,转种于10m LL B2增菌液内,于30ħʃ1ħ培养24hʃ2h㊂5.2分离取L B2二次增菌液划线接种于李斯特氏菌显色平板和P A L C AM琼脂平板,于36ħʃ1ħ培养24h~48h,观察各个平板上生长的菌落㊂典型菌落在P A L C AM琼脂平板上为小的圆形灰绿色菌落,周围有棕黑色水解圈,有些菌落有黑色凹陷;在李斯特氏菌显色平板上的菌落特征,参照产品说明进行判定㊂5.3初筛自选择性琼脂平板上分别挑取3个~5个典型或可疑菌落,分别接种木糖㊁鼠李糖发酵管,于36ħʃ1ħ培养24hʃ2h,同时在T S A-Y E平板上划线,于36ħʃ1ħ培养18h~24h,然后选择木糖阴性㊁鼠李糖阳性的纯培养物继续进行鉴定㊂5.4鉴定(或选择生化鉴定试剂盒或全自动微生物鉴定系统等)5.4.1染色镜检:李斯特氏菌为革兰氏阳性短杆菌,大小为(0.4μm~0.5μm)ˑ(0.5μm~2.0μm);用生理盐水制成菌悬液,在油镜或相差显微镜下观察,该菌出现轻微旋转或翻滚样的运动㊂5.4.2动力试验:挑取纯培养的单个可疑菌落穿刺半固体或S I M动力培养基,于25ħ~30ħ培养48h,李斯特氏菌有动力,在半固体或S I M培养基上方呈伞状生长,如伞状生长不明显,可继续培养5d,再观察结果㊂5.4.3生化鉴定:挑取纯培养的单个可疑菌落,进行过氧化氢酶试验,过氧化氢酶阳性反应的菌落继续进行糖发酵试验和M R-V P试验㊂单核细胞增生李斯特氏菌的主要生化特征见表1㊂5.4.4溶血试验:将新鲜的羊血琼脂平板底面划分为20个~25个小格,挑取纯培养的单个可疑菌落刺种到血平板上,每格刺种一个菌落,并刺种阳性对照菌(单增李斯特氏菌㊁伊氏李斯特氏菌和斯氏李斯特氏菌)和阴性对照菌(英诺克李斯特氏菌),穿刺时尽量接近底部,但不要触到底面,同时避免琼脂破裂, 36ħʃ1ħ培养24h~48h,于明亮处观察,单增李斯特氏菌呈现狭窄㊁清晰㊁明亮的溶血圈,斯氏李斯特氏菌在刺种点周围产生弱的透明溶血圈,英诺克李斯特氏菌无溶血圈,伊氏李斯特氏菌产生宽的㊁轮廓清晰的β-溶血区域,若结果不明显,可置4ħ冰箱24h~48h再观察㊂注:也可用划线接种法㊂5.4.5协同溶血试验c AM P(可选项目):在羊血琼脂平板上平行划线接种金黄色葡萄球菌和马红球菌,挑取纯培养的单个可疑菌落垂直划线接种于平行线之间,垂直线两端不要触及平行线,距离1mm~ 2mm,同时接种单核细胞增生李斯特氏菌㊁英诺克李斯特氏菌㊁伊氏李斯特氏菌和斯氏李斯特氏菌,于36ħʃ1ħ培养24h~48h㊂单核细胞增生李斯特氏菌在靠近金黄色葡萄球菌处出现约2mm的β-溶血增强区域,斯氏李斯特氏菌也出现微弱的溶血增强区域,伊氏李斯特氏菌在靠近马红球菌处出现约5mm~10mm的 箭头状 β-溶血增强区域,英诺克李斯特氏菌不产生溶血现象㊂若结果不明显,可置4ħ冰箱24h~48h再观察㊂注:5%~8%的单核细胞增生李斯特氏菌在马红球菌一端有溶血增强现象㊂表1单核细胞增生李斯特氏菌生化特征与其他李斯特氏菌的区别菌种溶血反应葡萄糖麦芽糖M R-V P甘露醇鼠李糖木糖七叶苷单核细胞增生李斯特氏菌(L.m o n o c y t o g e n e s)++++/+-+-+格氏李斯特氏菌(L.g r a y i)-+++/++--+斯氏李斯特氏菌(L.s e e l i g e r i)++++/+--++威氏李斯特氏菌(L.w e l s h i m e r i)-+++/+-V++伊氏李斯特氏菌(L.i v a n o v i i)++++/+--++英诺克李斯特氏菌(L.i n n o c u a)-+++/+-V-+注:+阳性;-阴性;V反应不定㊂5.5小鼠毒力试验(可选项目)将符合上述特性的纯培养物接种于T S B-Y E中,于36ħʃ1ħ培养24h,4000r/m i n离心5m i n,弃上清液,用无菌生理盐水制备成浓度为1010C F U/m L的菌悬液,取此菌悬液对3只~5只小鼠进行腹腔注射,每只0.5m L,同时观察小鼠死亡情况㊂接种致病株的小鼠于2d~5d内死亡㊂试验设单增李斯特氏菌致病株和灭菌生理盐水对照组㊂单核细胞增生李斯特氏菌㊁伊氏李斯特氏菌对小鼠有致病性㊂5.6结果与报告综合以上生化试验和溶血试验的结果,报告25g(m L)样品中检出或未检出单核细胞增生李斯特氏菌㊂第二法单核细胞增生李斯特氏菌平板计数法6检验程序单核细胞增生李斯特氏菌平板计数程序见图2㊂图2单核细胞增生李斯特氏菌平板计数程序7操作步骤7.1样品的稀释7.1.1以无菌操作称取样品25g(m L),放入盛有225m L缓冲蛋白胨水或无添加剂的L B肉汤的无菌均质袋内(或均质杯)内,在拍击式均质器上连续均质1m i n~2m i n或以8000r/m i n~10000r/m i n均质1m i n~2m i n㊂液体样品,振荡混匀,制成1ʒ10的样品匀液㊂7.1.2用1m L无菌吸管或微量移液器吸取1ʒ10样品匀液1m L,沿管壁缓慢注于盛有9m L缓冲蛋白胨水或无添加剂的L B肉汤的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支1m L无菌吸管反复吹打使其混合均匀,制成1ʒ100的样品匀液㊂7.1.3按7.1.2操作程序,制备10倍系列稀释样品匀液㊂每递增稀释1次,换用1支1m L无菌吸管或吸头㊂7.2样品的接种根据对样品污染状况的估计,选择2个~3个适宜连续稀释度的样品匀液(液体样品可包括原液),每个稀释度的样品匀液分别吸取1m L以0.3m L㊁0.3m L㊁0.4m L的接种量分别加入3块李斯特氏菌显色平板,用无菌L棒涂布整个平板,注意不要触及平板边缘㊂使用前,如琼脂平板表面有水珠,可放在25ħ~50ħ的培养箱里干燥,直到平板表面的水珠消失㊂7.3培养7.3.1在通常情况下,涂布后,将平板静置10m i n,如样液不易吸收,可将平板放在培养箱36ħʃ1ħ培养1h;等样品匀液吸收后翻转平皿,倒置于培养箱,36ħʃ1ħ培养24h~48h㊂7.4典型菌落计数和确认7.4.1单核细胞增生李斯特氏菌在李斯特氏菌显色平板上的菌落特征以产品说明为准㊂7.4.2选择有典型单核细胞增生李斯特氏菌菌落的平板,且同一稀释度3个平板所有菌落数合计在15C F U~150C F U之间的平板,计数典型菌落数㊂如果:a)只有一个稀释度的平板菌落数在15C F U~150C F U之间且有典型菌落,计数该稀释度平板上的典型菌落;b)所有稀释度的平板菌落数均小于15C F U且有典型菌落,应计数最低稀释度平板上的典型菌落;c ) 某一稀释度的平板菌落数大于150C F U 且有典型菌落,但下一稀释度平板上没有典型菌落,应计数该稀释度平板上的典型菌落;d ) 所有稀释度的平板菌落数大于150C F U 且有典型菌落,应计数最高稀释度平板上的典型菌落;e ) 所有稀释度的平板菌落数均不在15C F U~150C F U 之间且有典型菌落,其中一部分小于15C F U 或大于150C F U 时,应计数最接近15C F U 或150C F U 的稀释度平板上的典型菌落㊂以上按式(1)计算㊂f ) 2个连续稀释度的平板菌落数均在15C F U~150C F U 之间,按式(2)计算㊂7.4.3 从典型菌落中任选5个菌落(小于5个全选),分别按5.3㊁5.4进行鉴定㊂8 结果计数T =A BC d(1)式中:T样品中单核细胞增生李斯特氏菌菌落数;A某一稀释度典型菌落的总数;B某一稀释度确证为单核细胞增生李斯特氏菌的菌落数;C某一稀释度用于单核细胞增生李斯特氏菌确证试验的菌落数;d稀释因子㊂T =A 1B 1/C 1+A 2B 2/C 21.1d(2)式中:T样品中单核细胞增生李斯特氏菌菌落数;A 1第一稀释度(低稀释倍数)典型菌落的总数;B 1 第一稀释度(低稀释倍数)确证为单核细胞增生李斯特氏菌的菌落数;C 1 第一稀释度(低稀释倍数)用于单核细胞增生李斯特氏菌确证试验的菌落数;A 2 第二稀释度(高稀释倍数)典型菌落的总数;B 2 第二稀释度(高稀释倍数)确证为单核细胞增生李斯特氏菌的菌落数;C 2第二稀释度(高稀释倍数)用于单核细胞增生李斯特氏菌确证试验的菌落数;1.1 计算系数;d 稀释因子(第一稀释度)㊂9 结果报告报告每g (m L )样品中单核细胞增生李斯特氏菌菌数,以C F U /g(m L )表示;如T 值为0,则以小于1乘以最低稀释倍数报告㊂第三法 单核细胞增生李斯特氏菌M P N 计数法10 检验程序单核细胞增生李斯特氏菌M P N 计数法检验程序见图3㊂图3单核细胞增生李斯特氏菌M P N计数程序11操作步骤11.1样品的稀释按7.1进行㊂11.2接种和培养11.2.1根据对样品污染状况的估计,选取3个适宜连续稀释度的样品匀液(液体样品可包括原液),接种于10m LL B1肉汤,每一稀释度接种3管,每管接种1m L(如果接种量需要超过1m L,则用双料L B1增菌液)于30ħʃ1ħ培养24hʃ2h㊂每管各移取0.1m L,转种于10m LL B2增菌液内,于30ħʃ1ħ培养24hʃ2h㊂11.2.2用接种环从各管中移取1环,接种李斯特氏菌显色平板,36ħʃ1ħ培养24h~48h㊂11.3确证试验自每块平板上挑取5个典型菌落(5个以下全选),按照5.3㊁5.4进行鉴定㊂12结果与报告根据证实为单核细胞增生李斯特氏菌阳性的试管管数,查M P N检索表(见附录B),报告每g(m L)样品中单核细胞增生李斯特氏菌的最可能数,以M P N/g(m L)表示㊂附录A培养基和试剂A.1含0.6%酵母浸膏的胰酪胨大豆肉汤(T S B-Y E)A.1.1成分胰胨17.0g多价胨3.0g酵母膏6.0g氯化钠5.0g磷酸氢二钾2.5g葡萄糖2.5g蒸馏水1000m LA.1.2制法将上述各成分加热搅拌溶解,调节p H至7.2ʃ0.2,分装,121ħ高压灭菌15m i n,备用㊂A.2含0.6%酵母膏的胰酪胨大豆琼脂(T S A-Y E)A.2.1成分胰胨17.0g多价胨3.0g酵母膏6.0g氯化钠5.0g磷酸氢二钾2.5g葡萄糖2.5g琼脂15.0g蒸馏水1000m LA.2.2制法将上述各成分加热搅拌溶解,调节p H至7.2ʃ0.2,分装,121ħ高压灭菌15m i n,备用㊂A.3李氏增菌肉汤(L B1,L B2)A.3.1成分胰胨5.0g多价胨5.0g酵母膏5.0g氯化钠20.0g磷酸二氢钾1.4g磷酸氢二钠12.0g七叶苷1.0g蒸馏水1000m LA.3.2制法将上述成分加热溶解,调节p H至7.2ʃ0.2,分装,121ħ高压灭菌15m i n,备用㊂A.3.2.1李氏Ⅰ液(L B1)225m L中加入:1%萘啶酮酸(用0.05m o l/L氢氧化钠溶液配制)0.5m L1%吖啶黄(用无菌蒸馏水配制)0.3m LA.3.2.2李氏Ⅱ液(L B2)200m L中加入:1%萘啶酮酸0.4m L1%吖啶黄0.5m LA.4P A L C A M琼脂A.4.1成分酵母膏8.0g葡萄糖0.5g七叶甙0.8g柠檬酸铁铵0.5g甘露醇10.0g酚红0.1g氯化锂15.0g酪蛋白胰酶消化物10.0g心胰酶消化物3.0g玉米淀粉1.0g肉胃酶消化物5.0g氯化钠5.0g琼脂15.0g蒸馏水1000m LA.4.2制法将上述成分加热溶解,调节p H至7.2ʃ0.2,分装,121ħ高压灭菌15m i n,备用㊂A.4.2.1P A L C A M选择性添加剂多粘菌素B5.0m g盐酸吖啶黄2.5m g头孢他啶10.0m g无菌蒸馏水500m LA.4.2.2制法将P A L C AM基础培养基溶化后冷却到50ħ,加入2m LP A L C AM选择性添加剂,混匀后倾倒在无菌的平皿中,备用㊂A.5革兰氏染色液A.5.1结晶紫染色液A.5.1.1成分结晶紫1.0g95%乙醇20.0m L1%草酸铵水溶液80.0m LA.5.1.2制法将结晶紫完全溶解于乙醇中,然后与草酸铵溶液混合㊂A.5.2革兰氏碘液A.5.2.1成分碘1.0g碘化钾2.0g蒸馏水300m LA.5.2.2制法将碘与碘化钾先进行混合,加入蒸馏水少许,充分振摇,待完全溶解后,再加蒸馏水至300m L㊂A.5.3沙黄复染液A.5.3.1成分沙黄0.25g95%乙醇10.0m L蒸馏水90.0m LA.5.3.2制法将沙黄溶解于乙醇中,然后用蒸馏水稀释㊂A.5.4染色法A.5.4.1涂片用火焰固定后滴加结晶紫染液,作用1m i n,水洗㊂A.5.4.2滴加革兰氏碘液,作用1m i n,水洗㊂A.5.4.3滴加95%乙醇脱色,约15s~30s,直至染色液被洗掉,不要过分脱色,水洗㊂A.5.4.4滴加复染液,复染1m i n,水洗㊁待干㊁镜检㊂A.6S I M动力培养基A.6.1成分胰胨20.0g多价胨6.0gG B 4789.30 201611 硫酸铁铵0.2g 硫代硫酸钠0.2g 琼脂3.5g 蒸馏水1000m L A .6.2 制法将上述各成分加热混匀,调节p H 至7.2ʃ0.2,分装小试管,121ħ高压灭菌15m i n,备用㊂A .6.3 试验方法挑取纯培养的单个可疑菌落穿刺接种到S I M 培养基中,于25ħ~30ħ培养48h ,观察结果㊂A .7 缓冲葡萄糖蛋白胨水(M R 和V P 试验用)A .7.1 成分多价胨7.0g 葡萄糖5.0g 磷酸氢二钾5.0g 蒸馏水1000m L A .7.2 制法溶化后调节p H 至7.0ʃ0.2,分装试管,每管1m L ,121ħ高压灭菌15m i n ,备用㊂A .7.3 甲基红(M R )试验A .7.3.1 甲基红试剂A .7.3.1.1 成分甲基红10m g 95%乙醇30m L 蒸馏水20m LA .7.3.1.2 制法10m g 甲基红溶于30m L95%乙醇中,然后加入20m L 蒸馏水㊂A .7.3.1.3 试验方法取适量琼脂培养物接种于缓冲葡萄糖蛋白胨水中,36ħʃ1ħ培养2d ~5d ㊂滴加甲基红试剂一滴,立即观察结果㊂鲜红色为阳性,黄色为阴性㊂A .7.4 V -P 试验A .7.4.1 6%α-萘酚-乙醇溶液成分及制法:取α-萘酚6.0g ,加无水乙醇溶解,定容至100m L ㊂。
REF3012314226B-zh-2009/11 VIDAS快速单核细胞增生李斯特菌(LMX)仅供实验室用VIDAS®快速单核细胞增多李斯特菌(LMX)分析是在VIDAS®上采用酶联荧光免疫分析(ELFA)方法,对人类食品和环境样本的单核细胞增多李斯特菌进行特异性检测。
概述李斯特氏菌属现分为6个种,包括单核细胞增生李斯特菌、英诺克李斯特菌、绵羊李斯特、西尔李斯特、威尔斯李斯特菌及格氏李斯特(1)。
单核细胞增生李斯特菌是唯一对人致病的菌。
人类李斯特氏菌病包括脑炎、脑膜炎、败血症和流产。
高危人群包括孕妇、新生儿、免疫损伤患者及老年人(2,3)。
单核细胞增多李斯特菌在环境中分布广泛,对未加工原料、部分加工食品及发酵食品具有潜在危害。
VIDAS®快速单核细胞增生李斯特菌(LMX)试验是一种快速筛选试验,将取代费时的传统方法,可直接筛选人类食品(如肉类、乳制品、海产品和蔬菜)或环境样本中的单核细胞增生李斯特菌。
原理VIDAS®快速单核细胞增生李斯特菌是一种采用自动化VIDAS®系统(参见用户手册)作为酶联荧光免疫分析(ELFA)方法,对李斯特菌抗原进行检测的酶联免疫方法。
固相容器(SPR®)是一个类似于加样头的一次性装置,起加样器的作用。
SPR®内壁用单核细胞增生李斯特菌单克隆抗体包被。
各种测试试剂为即用型,均预先放置在密封的试剂条内。
VIDAS®系统自动完成全部实验程序。
反应底物在SPR®内外循环数次。
将部分增菌肉汤加于试剂条上,样本中的单增李斯特菌抗原与SPR®内面包被的抗单增李斯特菌抗体结合,未结合的样本则被洗去。
与酶结合的的抗体也在SPR®内外循环,并与固定于SPR内壁的单增李斯特菌抗原结合。
测生物素的存在。
酶复合物由孵育的碱性磷酸酶标记的二抗检测。
最后洗去未结合的酶复合物。
最后在SPR®.中加入荧光底物,磷酸4-甲基伞型物。