食品中单核细胞增生李斯特氏菌检验
- 格式:pdf
- 大小:233.27 KB
- 文档页数:5

MM_FS_CNJ_0344出口食品单核细胞增生李斯特氏菌斜射光镜MM_FS_CNJ_0344出口食品中单核细胞增生李斯特氏菌检验方法1.适用范围本方法适用于牛乳、乳制品、水产品、肉及肉制品食品。
其他食品可参照采用。
2.原理概要单核细胞增生李斯特氏菌是一种能引起人畜共患疾病的致病菌。
在胰酪胨大豆酵母浸膏琼脂(TSA-YE)、选择性培养基(MMA)等平板上用45°角斜射光照射可观察到蓝色菌落;水解七叶苷并与柠檬酸铁铵反应产生黑色菌落。
3.主要试剂和仪器.主要试剂(包括培养基)胰酪胨大豆酵母浸膏肉汤(TSB-YE)(见B1);胰酪胨大豆酵母浸膏琼脂(TSA-YE)(见B2);增菌培养液(EB)(见B3);选择性培养基(MMA)(见B4);牛津琼脂(见B5);改良缓冲蛋白胨水(MBP)(见B6);7%羊血琼脂(见B7);糖发酵培养基(见B8);半固体琼脂;尿素琼脂;硝酸盐培养基;MR-VP培养基;三糖铁琼脂(TSI)。
胰酪蛋白胨(或胰蛋白胨);盐酸吖啶黄素;萘啶酮酸;复达新;甘氨酸酐;氯化锂;苯乙醇;放线菌酮;多粘菌素E;头孢双硫唑甲氧;磷霉素;柠檬酸铁铵;七叶苷;酚红;D-葡萄糖;D-甘露醇;哥伦比亚琼脂;酵母浸膏;牛肉浸膏。
.仪器微生物学实验室常用设备;解剖镜;斜射灯;平面镜。
4.过程简述.样品如为冷冻食品,应于2~5℃解冻,且不超过18h,若不能及时检验,应置于-15℃保存。
非冷冻的易腐样品应尽可能及时检验,若不能及时检验,应置于4℃冰箱保存,在24h之内检验。
.前增菌和增菌前增菌:巴氏消毒乳、乳制品、冷冻水产品,冻肉及其它加工食品均应进行前增菌。
无菌操作称取25g样品,加入装有225mL改良缓冲蛋白胨水(MBP)的均质杯内,高速均质1~2min,制成1∶10样品匀液,转入500mL广口瓶内;液体食品可用吸管吸取25mL样品,加入装有225mL改良缓冲蛋白胨水(MBP)的广口内,充分振摇制成1∶10样品匀液,于30℃培养24、48h。

单核细胞增生李斯特氏菌生化鉴定引言单核细胞增生李斯特氏菌(Listeria monocytogenes)是一种常见的食源性致病菌,可引起严重的食物中毒和感染疾病。
为了及时诊断和控制该菌的传播,对其进行准确的生化鉴定非常重要。
本文将介绍单核细胞增生李斯特氏菌的生化鉴定方法及相关实验步骤。
实验材料与方法实验材料•单核细胞增生李斯特氏菌培养基•Listeria Enrichment Broth(LEB)•Listeria Agar Base(LAB)•乳清素蛋白水解物培养基(Trypticase Soy Broth,TSB)•乳清素蛋白水解物琼脂培养基(Trypticase Soy Agar,TSA)•碱性亮绿液实验方法1.取一份食物样品,如肉类、奶制品等,加入适量LEB中,并在37℃孵育24小时。
2.取0.1ml培养液,在TSB中进行预培养,37℃孵育24小时。
3.从TSB中取出适量菌液,用胶体金法进行菌落计数,并将菌液稀释至10-4倍。
4.取适量的稀释液分别接种于LAB和TSA琼脂培养基上,并在37℃孵育24小时。
5.观察菌落形态、颜色等特征,并记录下来。
生化鉴定实验单核细胞增生李斯特氏菌生化鉴定步骤如下:1.琼脂凝胶双扩散试验:将单核细胞增生李斯特氏菌抗原与相应的抗血清共同扩散于琼脂凝胶板上,观察是否发生免疫反应。
若有明显的线条或沉淀形成,则说明存在抗原-抗体反应,可以初步判断为单核细胞增生李斯特氏菌。
2.碱性亮绿液试验:将培养基中的单核细胞增生李斯特氏菌与碱性亮绿液接触,观察是否产生绿色荧光。
若产生绿色荧光,则说明菌株具有单核细胞增生李斯特氏菌的特性。
3.单核细胞增生李斯特氏菌脂多糖(LPS)鉴定:采用酚-硫酸法或酚-硝基苯法,将培养基中的单核细胞增生李斯特氏菌进行LPS提取,然后进行比色反应。
若出现红色或紫色沉淀,则说明存在LPS,可以进一步确认为单核细胞增生李斯特氏菌。
结果与讨论通过上述实验方法,我们可以对食物样品中的单核细胞增生李斯特氏菌进行生化鉴定。

DBS22 DBS22/019—2012吉林省食品安全地方标准食品中单核细胞增生李斯特菌的定量检测2013年发布 2013年实施吉林省卫生厅发布前言本标准根据GB/T1。
1—2000《标准化工作导则第1部分:标准的结构和编写规则》的要求编写.本标准分为两种检测方法:第一法:单核细胞增生李斯特氏菌平板计数法;第二法:MPN计数法。
其中第一法适用于污染较严重的食品,第二法适用于单核细胞增生李斯特氏菌含量较低而杂菌含量较高的食品。
本标准负责起草单位:吉林省疾病预防控制中心、长春市疾病预防控制中心.本标准负责起草人:刘桂华、龚云伟、李月婷、赵薇吉林省食品安全地方标准食品中单核细胞增生李斯特菌的定量检测1 范围本操作程序规定了食品中单核细胞增生李斯特氏菌(Listeria monocytogenes)的定量检验方法.本操作程序适用于食品中单核细胞增生李斯特氏菌的定量检验。
2 设备和材料除微生物实验室常规无菌及培养设备外,其他设备和材料如下:2。
1 冰箱:2℃~5℃和—18℃.2.2 恒温培养箱:30℃±1℃、36℃±1℃.2.3 均质器。
2.4 显微镜:10×~100×.2。
5 电子天平:感量0。
1 g。
2.6 锥形瓶:100 mL、500 mL。
2。
7 无菌吸管:1 mL(具0。
01 mL刻度)、10 mL(具0.1 mL刻度)。
2.8 无菌平皿:直径90 mm。
2。
9 无菌试管:16 mm×160 mm.。
2。
10 离心管:30 mm×100 mm.2。
11 无菌注射器:1 mL。
2。
12 金黄色葡萄球菌(ATCC 25923)。
2.13 马红球菌(Rhodococcus equi)。
2。
14 全自动微生物生化鉴定系统。
3 培养基和试剂3。
1 含0。
6%酵母浸膏的胰酪胨大豆肉汤(TSB-YE):见附录A中A。
1.3。
2 含0.6%酵母浸膏的胰酪胨大豆琼脂(TSA-YE):见附录A中A.2。
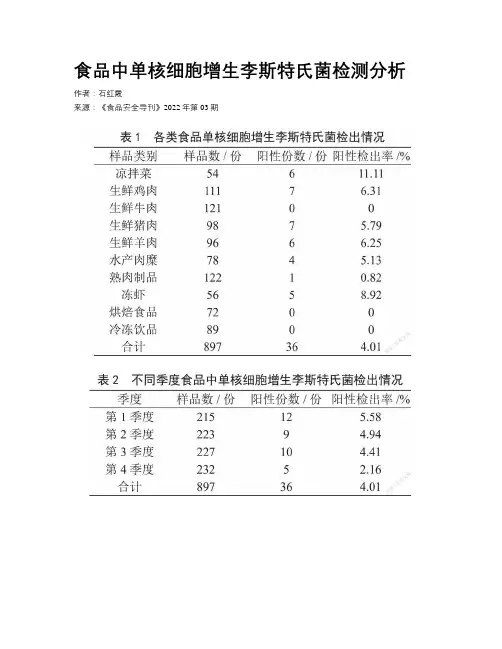
食品中单核细胞增生李斯特氏菌检测分析作者:***来源:《食品安全导刊》2022年第03期摘要:目的:分析食品中单核细胞增生李斯特氏菌的检测结果,以及时发现食品安全隐患,为食品安全监管提供参考依据。
方法:严格按照《全国食源性致病菌监测工作手册》中的单核细胞增生李斯特氏菌检验标准,对某市2021年1—12月定期采样的10类常用食品进行单核细胞增生李斯特氏菌检测,分析其阳性检出率。
结果:897份10类常用食品中,检出单核细胞增生李斯特氏菌36份,阳性检出率为4.01%,结论:食品中存在单核细胞增生李斯特氏菌污染的风险,其中以凉拌菜及冷藏食品的污染风险最高,应加强该方面的防控,确保食品安全。
关键词:单核细胞增生李斯特氏菌;食品安全;检测Detection and Analysis of Listeria Monocytogenes in FoodSHI Hongxia(Ulanqab Center for Disease Control and Prevention Inner Mongolia, Ulanqab 012000,China)Abstract: Objective: To analyze the detection results of Listeria monocytogenes in food,find the hidden dangers of food safety in time, and provide reference basis for food safety supervision. Methods: The detection of Listeria monocytogenes in the national manual for the monitoring of foodborne pathogens shall be strictly followed. According to the test standard, 10 kinds of common foods regularly sampled in a city from January to December 2021 were tested for Listeria monocytogenes, and the positive detection rate was analyzed. Conclusion: There is a risk of Listeria monocytogenes contamination in foods, among which cold dishes and refrigerated foods have the highest risk of contamination. Prevention and control in this regard should be strengthened to ensure food safety.Keywords: listeria monocytogenes; food safety; testing单核细胞增生李斯特氏菌广泛存在于土壤、蔬菜、粪便及多数食品中,该病菌对低温环境具有较好的耐受性,在5 ℃时可大量繁殖,当该病菌进入生物表层后会形成生物膜,并能提高对理化因素的抵抗力,是食源性疾病的主要致病菌之一,可通过粪便或食物进行传播。

食品中单核细胞增生李斯特氏菌的检验能力验证结果分析作者:彭怡许红玉黄厚强张曲来源:《中国食品》2024年第02期单核细胞增生李斯特氏菌(Listeria monocytogenes,LM),简称为单增李斯特氏菌,是一种需氧兼性厌氧的食源性病原菌、革兰氏阳性短杆菌,广泛存在于自然界中。
其中,奶制品、肉制品、水产品、海产品、禽类食品、蔬菜等容易受到该菌污染,误食用含有该菌的新生儿、老年人等免疫力低者易患脑膜炎、败血症,孕妇则易发生早产或流产,致死率高达20%-30%,给食品安全造成严重威胁。
近年来,国内外关于单增李斯特氏菌的主要检测方法包括国标法、免疫学检测法、生物传感器检测法等,这些方法各有优缺点。
能力验证通过对实验室间的检验能力进行比对,评价参加者的能力,是证明实验室检验能力的重要方式之一。
资阳市食品药品检验检测中心生物检验科参加了由四川省食品检验研究院组织的“食品中单核细胞增生李斯特氏菌的检验能力验证”,采用国标法《GB 4789.30-2016 食品安全国家标准食品微生物学检验单核细胞增生李斯特氏菌检验》第一法对样品进行定性检验。
一、材料与方法1.样品。
由四川省食品检验研究院提供3份单核细胞增生李斯特氏菌样品,每份样品包括一瓶白色球状西林瓶装和一袋质量约为25g的奶粉,样品编号分别为LM-029、LM-177和LM-307。
2.菌种。
单增李斯特氏菌ATCC 19115、斯氏李斯特氏菌ATCC 35967、伊氏李斯特氏菌ATCC 19119、英诺克李斯特氏菌ATCC 33090,均由广东环凯生物科技有限公司提供。
3.主要试剂。
脑心浸出液肉汤(BHI)、李氏菌增菌肉汤(LB1,LB2)基础、PALCAM 琼脂、李斯特氏菌显色培养基、SIM生化管、HBI单增李斯特氏菌生化鉴定条(GB),购自青岛高科技工业园海博生物技术有限公司;李斯特氏菌显色培养基、PALCAM琼脂、含0.6%酵母浸膏的胰酪胨大豆琼脂(TSA-YE)、血平板、革兰氏染色液试剂盒、3%过氧化氢、单增李斯特氏菌干制生化鉴定试剂盒,购自北京陆桥技术股份有限公司。

乳粉中单核细胞增生李斯特氏菌能力验证结果与分析单核细胞(monocytes)是一类存在于人体血液和组织中的白细胞(leukocytes)。
它们作为免疫系统中的重要成分,具有很强的吞噬能力和免疫调节功能。
李斯特氏菌(Listeria monocytogenes)是一种革兰氏阳性杆菌,它能够引起严重的人类食物中毒,尤其是婴儿和免疫缺陷患者。
乳粉作为婴幼儿的主要食物,其安全性尤为重要。
为了对乳粉中单核细胞增生李斯特氏菌的能力进行验证,可以进行以下步骤:1.材料准备:-乳粉样品- 特定培养基(如Listeria Enrichment Broth)-李斯特氏菌(已知培养物)-离心管-培养皿2.试验步骤:a.预处理乳粉样品:-取适量的乳粉样品,加入适量的特定培养基-将混合物在摇床上以适当速度摇匀-使用离心机将样品离心,以除去悬浮的杂质b.培养李斯特氏菌:-取一定量的已知培养物,加入特定培养基中-在适当的温度和湿度下,培养李斯特氏菌至适宜的生长期c.接种乳粉样品:-取适量的乳粉样品,加入特定培养基中-添加已培养的李斯特氏菌(适量)到乳粉样品中-使混合物充分混合d.孵化和观察:-将接种混合物接种到适当的培养皿中-将培养皿置于适当的环境中(温度、湿度等)-在一定时间内观察培养皿中是否有李斯特氏菌的生长3.结果与分析:通过观察培养皿中的生长情况,可以得出以下结论和分析:-如果培养皿中出现了李斯特氏菌的生长,说明乳粉样品中存在单核细胞增生的李斯特氏菌能力。
-如果培养皿中未观察到李斯特氏菌的生长,说明乳粉样品中不存在单核细胞增生的李斯特氏菌能力。
-结果应与对照组进行比较,以确定是否存在显著差异。
需要注意的是,这是仅仅通过培养方法进行初步验证,不能判断乳粉样品的感染风险和食用安全性。
为了更准确地评估乳粉中李斯特氏菌的存在和潜在传播风险,还需要进一步的实验和分析方法,如PCR检测、测定菌群数量等。
同时还应结合临床和流行病学调查数据,做出综合评估和判断。


单核细胞增生李斯特氏菌生化鉴定
李斯特氏菌(Listeria monocytogenes)是一种革兰氏阳性杆菌,是一种常见的细菌性食物中毒病原体。
单核细胞增生组织均为生化鉴定的一种常见方法。
以下是李斯特氏菌生化鉴定的一些特征:
1. 嗜冷性:李斯特氏菌生长适宜温度为2-45℃,菌株能够在4℃下生长,并在冷藏食品中繁殖。
2. β-溶血素产生:李斯特氏菌能够产生β-溶血素,可以通过血琼脂(Blood agar)培养基上的溶血环进行观察。
3. 乳酸发酵:李斯特氏菌是一种革兰氏阳性乳酸菌,能够进行乳酸发酵。
可以使用乳糖发酵基质(Lactose fermentation medium)进行鉴定,如果产生乳酸则为阳性。
4. 半胱氨酸脱羧:李斯特氏菌具有半胱氨酸脱羧酶活性,可以将半胱氨酸转化为硫代氨基酸。
可使用兰氏差异培养基(LDC medium)进行鉴定。
5. 半乳糖酶活性:李斯特氏菌具有半乳糖酶活性,可以将乳糖转化为半乳糖。
可使用半乳糖发酵基质(Rhamnose fermentation medium)进行鉴定。
此外,李斯特氏菌还可以进行PCR扩增目标基因进行鉴定,
如16S rRNA基因、Internal Transcribed Spacer(ITS)区域等。
需要指出的是,单纯进行生化鉴定可能存在一定的误判率,结合其他检测方法可以提高鉴定的准确性。
此外,由于李斯特氏菌在环境中广泛存在,饮食中也常常带菌,所以对于临床病例的确诊还需要结合患者的临床表现、流行病学调查等综合分析。


ICSSN 备案号:中华人民共和国国家质量监督检验检疫总局发布前 言SN/T XXXX-XXXX《食品中多种致病菌快速检测-PCR方法》分为十一个部分:─ 第 1 部分:食品中沙门氏菌检测方法;─ 第 2 部分:食品中志贺氏菌检测方法;─ 第 3 部分:食品中金黄色葡萄球菌检测方法;─ 第 4 部分:食品中小肠结肠炎耶尔森氏菌检测方法;─ 第 5 部分:食品中单核细胞增生李斯特氏菌检测方法;─ 第 6 部分:食品中空肠弯曲菌检测方法;─ 第 7 部分:食品中肠出血性大肠埃希氏菌 O157:H7检测方法;─ 第 8 部分:食品中副溶血性弧菌检测方法;─ 第 9 部分:食品中霍乱弧菌检测方法;─ 第 10 部分:食品中创伤弧菌检测方法;─ 第 11 部分:食品中阪崎肠杆菌BAX全自动PCR检测方法。
本单核细胞增生李斯特氏菌PCR检测方法分为第一法(普通PCR方法)和第二法BAX®全自动致病菌PCR 检测系统1),第二法修改采用了AOAC International Official Method Listeria monocytogenes2003.12。
本标准的附录A和B是资料性附录。
本标准由国家认可监督管理委员会提出并归口。
本标准起草单位:中华人民共和国辽宁出入境检验检疫局。
本标准起草人:卢行安等。
本标准系首次发布的检验检疫行业标准。
1) 为美国杜邦公司(DuPont Qualicon)的产品。
食品中多种致病菌快速检测-PCR方法第5部分:食品中单核细胞增生李斯特氏菌检测方法1 范围本部分规定了用普通PCR技术快速检测单核细胞增生李斯特氏菌的方法。
本部分适用于食品中单核细胞增生李斯特氏菌的检验。
2 规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。
单核细胞增生李斯特氏菌检验检测细则1、目的根据《中华人民共和国国家标准》GB/T4789.30-2003单核细胞增生李斯特氏菌检验进行单核细胞增生李斯特氏菌检验。
2、适用范围适用于食品和食物中毒样品中单核细胞增生李斯特氏菌的检验。
3、职责检测人员负责按照本规程对被测样品进行检测;校核人员负责对检测操作人员是否规范以及检测结果是否准确进行审核;授权签字人负责综合管理和检测报告的签发。
4、试剂及器材4.1 单核细胞增生李斯特氏菌标准菌株4.2 马红球菌4.3 小白鼠:16-18g4.4 TSB-YE4.5 TSA-YE4.6 EB增菌液4.7 李氏增菌液(LB1,LB2)4.8 三糖铁琼脂4.9SIM动力培养基4.10 琼脂4.11 改良的Mc Bride琼脂(MMA)4.12 硝酸盐培养基4.13 缓冲葡萄糖蛋白胨水4.14 糖发酵培养基4.15 过氧化氢4.16 1%盐酸丫啶黄溶液4.17 1%萘啶酮酸盐溶液5、仪器设备5.1 恒温培养箱:30±1℃、24℃±1℃5.2 恒温水浴锅:46±1℃5.3 离心机:4000r/min5.4 显微镜5.5 均质器6、检测步骤6.1样品的收集及处理:无菌取样25g(ml)放灭菌均质器中加225mlEB和LB1增菌液中,充分搅拌成均质。
如不能及时检验,可暂存4℃冰箱。
6.2增菌培养:EB增菌液30℃培养48小时,LB1增菌液225ml放30℃培养24小时,吸取0.1ml,加入10ml LB2增菌液中二次增菌。
6.3分离培养:将EB增菌液和LB2二次增菌分离于选择培养基MMA琼脂平板上,培养30℃48小时,挑选可疑菌落,用白织灯45。
角斜光照射平板。
6.4选五个以上的上述可疑菌落接种三糖铁琼脂和SIM动力培养基,培养于25℃。
一般观察2天-7天,阳性者可做下一步鉴定。
6.5纯培养:将上述有动力、形成伞状者并在三糖铁琼脂培养基上层、下层的产酸而不产硫化氢的可疑培养物接种于TSA-YE上纯培养,做以下鉴定。
食品中单核细胞增生李斯特氏菌能力验证结果分析与讨论马秋莲,周 露,潘馨竹,王 健,马 蓉,徐程伟(宝应县有机食品质量监督检验中心,江苏扬州 225800)摘 要:目的:通过检验食品中单增李斯特氏菌了解实验室关于食品中微生物的检验和检测水平,通过检验技术的更新和检测方法的不断优化,增强实验室整体竞争能力,提升食品检验检测机构检验能力,使微生物实验室外部质控水平得以维护和巩固。
方法:利用BAX Q7对能力验证中的3个样品进行快速筛查,严格依据《食品安全国家标准食品微生物学检验单核细胞增生李斯特氏菌检验》(GB 4789.30—2016),对疑似菌进行鉴定。
结果:编号为270的样品检出为单增李斯特氏菌,编号为318和159的这两个样品中均未检出该致病菌,经过进一步实验,发现这两个样品中的致病菌为英诺克李斯特氏菌。
结论:本实验室顺利完成本次能力验证,结果较满意。
综上表明本实验室具备检验检测单增李斯特氏菌的能力,且检测方法和结果具有一定的准确性。
关键词:食品;能力验证;单核细胞增生李斯特氏菌;检测Proficiency Testing Results and Analysis of Listeriamonocytogenes in FoodMA Qiulian, ZHOU Lu, PAN Xinzhu, WANG Jian, MA Rong, XU Chengwei (Baoying Quality Supervision and Testing Center for Organic Food, Yangzhou 225800, China)Abstract: Objective: Through the inspection of Listeria monocytogenes in food to understand the laboratory on the inspection and detection level of microorganisms in food, through the update of inspection technology and continuous optimization of detection methods, enhance the overall competitiveness of the laboratory, improve the inspection ability of food inspection and detection institutions, so that the microbiology laboratory external quality control level can be maintained and consolidated. Method: BAX Q7 was used to quickly screen 3 samples in the ability verification, and the suspected bacteria were identified in strict accordance with the GB 4789.30—2016. Result: Listeria monocytogenes was detected in the sample numbered 270, while no such pathogen was detected in the two samples numbered 318 and 159. After further experiments, it was found that the pathogenic bacteria in the two samples were Listeria inoknock. Conclusion: The laboratory successfully completed the ability verification, the results are satisfactory. To sum up, this laboratory is capable of testing Listeria monocytogenes, and the detection methods and results have certain accuracy.Keywords: food; capability verification; Listeria monocytogenes; testing自然环境中存在大量的李斯特氏菌,该菌有7个菌株,单增李斯特氏菌作为该菌中的一种,能够引发人、动物共同患病[1]。
分析检测食品中单核细胞增生李斯特氏菌的能力验证结果分析于 潇(上海中维检测技术有限公司,上海 201600)摘 要:为了提升实验室综合检测能力,保证日常出具的抽检结果准确可靠,本实验室参加了2022年南京市食品药品监督检验院组织的能力验证,能力验证结果评价为满意,表明实验室具备单核细胞增生李斯特氏菌的检验能力。
关键词:单核细胞增生李斯特氏菌;能力验证;质量控制Profificiency Testing Analysis of Listeria monocytogenesin FoodYU Xiao(Shanghai Zhongwei Testing Technology Company, Shanghai 201600, China) Abstract: In order to improve the comprehensive testing ability of the laboratory and ensure the accuracy and reliability of the daily sample test results, the laboratory participated in the ability verification organized by Nanjing Food and Drug Supervision and Inspection Institute in 2022, and the ability verification results were evaluated as satisfactory, indicating that the laboratory has the ability to test Listeria monocytogenes.Keywords:Listeria monocytogenes; profificiency testing; quality control李斯特氏菌属革兰氏阳性菌,广泛存在于自然界中,具有耐低温、耐酸、耐高盐等特点。
食品中单核增生细胞李斯特氏菌快速检测研究单核细胞增生李斯特氏菌在病原学上作为一种人畜共患和食源性疾病的致病菌已得到世界范围普遍的公认。
近年来,如何分离和鉴定食品中单核细胞增生李斯特氏菌已成为研究热点。
本文结合近十年的各种该病菌的快速检测方法作了系统综述,介绍了针对该病菌的快速检测方法,如显色培养基快速检测方法、酶联免疫试验检测方法、结合单克隆抗体技术的免疫学检测方法、反转录-PCR 检测方法、生物芯片,以期对食品中单核细胞增生李斯特菌的检测起到帮助和指导作用。
标签:单核增生细胞李斯特氏菌;检测方法单核细胞增生李斯特氏菌是一种短小的革兰氏阳性无芽孢杆菌[1],它能引起人畜的李氏菌的病,该病发病率较低,但致死率高达20%~30%[2],感染后主要表现为败血症、脑膜炎和单核细胞增多。
单核细胞增生李斯特氏菌广泛存在于自然界中,食品中存在的单核细胞增生李斯特氏菌对人类的安全具有危险,该菌在4℃的环境中仍可生长繁殖,是冷藏食品威胁人类健康的主要病原菌之一,因此,在食品卫生微生物检验中,必须加以重视。
本文拟对单核细胞增生李斯特氏菌的检测方法及其当前存在的问题等作系统介绍,以期为进一步深入研究提供参考。
1快速检测方法1.1 显色培养基快速检测方法显色或荧光鉴别培养基的基本原理是针对李斯特氏菌的β-D-葡萄糖苷酶和毒力因子PI-PLC酶,设计相应的底物,加入到常规选择性培养基中,利用酶对底物的分解,产生荧光或显色物质,使其菌落形态或颜色不同于其他李斯特氏菌和非李斯特氏菌,从而实现对李斯特氏菌快速定性鉴定和菌落数目快速定量。
张淑红等[3]检测了显色培养基的特异性和灵敏度。
实验证明此种检测方法具有较高灵敏度、特异性和选择性,是非常有价值的分离平板。
1.2 免疫学检测方法1.2.1 酶联免疫试验检测方法(ELISA)早期起初人们采用简单直接的细胞计数法进行检测,运用细胞计量术对牛奶中的单核细胞增生李斯特氏菌进行检测。
但是由于病原微生物的含量很低,仅通过细胞计数的方法检测灵敏度无法达到。
食品中单核细胞增生李斯特氏菌检验
1原理与范围
本标准规定了食品中单核细胞增生李斯特氏菌的检验方法。
本标准适用于食品中单核细胞增生李斯特氏菌的检验。
2、培养基、试剂和血清
2.1含0.6%酵母浸膏的胰酪胨大豆肉汤;
2.2含0.6%酵母浸膏的胰酪胨大豆琼脂;
2.3李氏增菌肉汤LB(LB1,LB2);
2.4 1%盐酸吖啶黄溶液;
2.5 1%萘啶酮酸钠盐溶液;
2.6 PALCAM 琼脂;
2.7 革兰氏染液;
2.8 SIM动力培养基;
2.9 缓冲葡萄糖蛋白胨水【甲基红(MR)和V-P试验用】;2.10 5%~8%羊血琼脂;
2.11 糖发酵管;
2.12 过氧化氢酶试验;
2.13 李斯特氏菌显色培养基;
2.14 李斯特氏菌生化鉴定试剂盒;
3 、仪器设备
除微生物室常规灭菌及培养设备外,其他设备和材料如下:
3.1 高压蒸汽消毒灭菌器;
3.2 冰箱;
3.3 恒温培养箱:36℃±1℃,30℃±1℃;
3.4 生物显微镜;
3.5 电子天平:感量0.1g;
3.6 均质器;
3.7 吸管:1mL,10mL;
3.8 培养皿(直径90mm);
3.9 培养瓶或三角瓶:容量500mL,250mL;
3.10 试管(,16 mm×160mm);
3.11 离心管:30 mm×100 mm;
3.12 全自动微生物生化鉴定系统。
4 、检验程序
单核细胞增生李斯特氏菌检验程序见图1.
图1 单核细胞增生李斯特氏菌检验程序
5 操作步骤 5.1 增菌
以无菌操作取样品25g(mL)加入到含有225mL LB1 增菌液的均质袋中,在拍击式均质器上连续均质1min —2min ;或放入盛有225mL LB1 增菌液的均质杯中,8000 r/min---10000 r/min 均质1min —2min 。
于30℃±1℃培养24h ,移取0.1mL ,转种于10mL LB2 增菌液内,于30℃±1℃培养18h--24h 。
5.2 分离:
取LB2 二次增菌液划线接种于PALCAM 琼脂平板和李斯特氏菌显色培养基上,于36℃±
1℃培养24h--48h ,观察各个平板上生长的菌落。
典型菌落在PALCAM 琼脂平板上为小的圆形灰绿色菌落,周围有棕黑色水解圈,有些菌落有黑色凹陷;典型菌落在李斯特氏菌显色培养基上的特征按照产品说明进行判定。
5.3 初筛
自选择性琼脂平板上分别挑取 5 个以上典型或可疑菌落,分别接种在木糖、鼠李糖发酵管,于 36 ℃±1 ℃培养 24 h ;同时在 TSA-YE 平板上划线纯化,于 30 ℃±1 ℃培养 24 h ~48 h 。
选择木糖阴性、鼠李糖阳性的纯培养物继续进行鉴定。
5.4 鉴定
5.4.1 染色镜检:李斯特氏菌为革兰氏阳性短杆菌,大小为(0.4 μm ~0.5 μm )×(0.5 μm ~2.0 μm ); 用生理盐水制成菌悬液,在油镜或相差显微镜下观察,该菌出现轻微旋转或翻滚样的运动。
5.4.2 动力试验:李斯特氏菌有动力,呈伞状生长或月牙状生长。
5.4.3 生化鉴定:挑取纯培养的单个可疑菌落,进行过氧化氢酶试验,过氧化氢酶阳性反应的菌落继续进行糖发酵试验和 MR-VP 试验。
单核细胞增生李斯特氏菌的主要生化特征见表 1。
5.4.4 溶血试验:将羊血琼脂平板底面划分为20 个~25 个小格,挑取纯培养的单个可疑菌落刺种到血平板上,每格刺种一个菌落,并刺种阳性对照菌(单增李斯特氏菌和伊氏李斯特氏菌)和阴性对照菌(英诺克李斯特氏菌),穿刺时尽量接近底部,但不要触到底面,同时避免琼脂破裂,36 ℃±1 ℃培养24 h~48 h,于明亮处观察,单增李斯特氏菌和斯氏李斯特氏菌在刺种点周围产生狭小的透明溶血环,英诺克李斯特氏菌无溶血环,伊氏李斯特氏菌产生大的透明溶血环。
5.4.5 协同溶血试验(cAMP):在羊血琼脂平板上平行划线接种金黄色葡萄球菌和马红球菌,挑取纯培养的单个可疑菌落垂直划线接种于平行线之间,垂直线两端不要触及平行线,于30℃±1 ℃培养24 h~48 h。
单核细胞增生李斯特氏菌在靠近金黄色葡萄球菌的接种端溶血增强,斯氏李斯特氏菌的溶血也增强,而伊氏李斯特氏菌在靠近马红球菌的接种端溶血增强。
5.5 可选择生化鉴定试剂盒或全自动微生物生化鉴定系统等对5.3中3个~5个纯培养的可疑菌落进行鉴定。
5.6小鼠毒力试验(可选择)
将符合上述特性的纯培养物接种于TSB-YE 中,于30 ℃±1 ℃培养24 h,4 000 r/min 离心5 min,弃上清液,用无菌生理盐水制备成浓度为1010 CFU/mL 的
菌悬液,取此菌悬液进行小鼠腹腔注射3 只~5 只,每只0.5 mL,观察小鼠死亡情况。
致病株于2 d~5 d 内死亡。
试验时可用已知菌作对照。
单核细胞增生李斯特氏菌、伊氏李斯特氏菌对小鼠有致病性。
6 结果与报告
综合以上生化试验和溶血试验结果,报告25 g(mL)样品中检出或未检出单核细胞增生李斯特氏菌。