实验二 葡萄糖酸钙的合成
- 格式:doc
- 大小:48.50 KB
- 文档页数:2
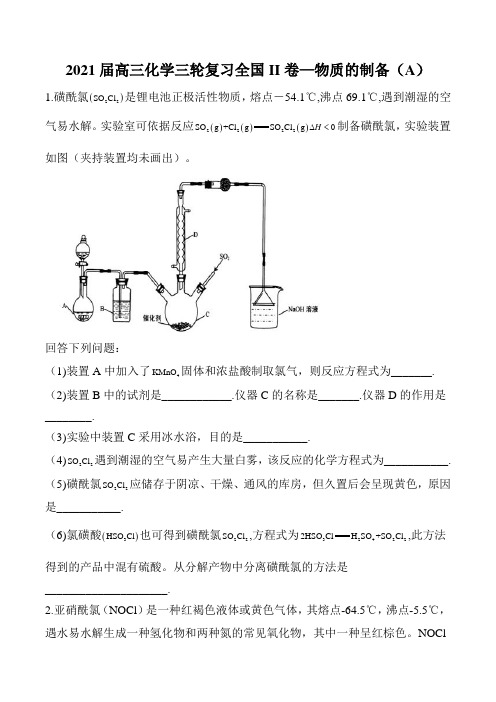
2021届高三化学三轮复习全国II 卷—物质的制备(A )1.磺酰氯()22SO Cl 是锂电池正极活性物质,熔点-54.1℃,沸点69.1℃,遇到潮湿的空气易水解。
实验室可依据反应()()()2222SO g +Cl g SO Cl g 0H ∆<制备磺酰氯,实验装置如图(夹持装置均未画出)。
回答下列问题:(1)装置A 中加入了4KMnO 固体和浓盐酸制取氯气,则反应方程式为_______. (2)装置B 中的试剂是____________.仪器C 的名称是_______.仪器D 的作用是________.(3)实验中装置C 采用冰水浴,目的是___________.(4)22SO Cl 遇到潮湿的空气易产生大量白雾,该反应的化学方程式为___________. (5)磺酰氯22SO Cl 应储存于阴凉、干燥、通风的库房,但久置后会呈现黄色,原因 是___________.(6)氯磺酸()3HSO Cl 也可得到磺酰氯22SO Cl ,方程式为324222HSO Cl H SO +SO Cl ,此方法得到的产品中混有硫酸。
从分解产物中分离磺酰氯的方法是_____________________.2.亚硝酰氯(NOCl )是一种红褐色液体或黄色气体,其熔点-64.5℃,沸点-5.5℃,遇水易水解生成一种氢化物和两种氮的常见氧化物,其中一种呈红棕色。
NOCl可由NO 与纯净的2Cl 在常温常压下合成,相关实验装置如图所示。
(1)装置E 中的试剂为______________。
(2)实验开始时,先打开12K K 、,关闭3K ,再打开分液漏斗活塞滴入适量稀硝酸,当观察到B 中________时关闭12K K 、。
向装置C 三颈瓶中通入干燥2Cl ,当瓶中充满黄绿色气体时,再打开13K K 、,制备NOCl 。
(3)若装置C 中去掉盛2CaCl 的干燥管,则C 中NOCl 可能发生反应的化学方程式为:______________________(4)制得的NOCl 中可能含有少量24N O 杂质,为测定产品纯度进行如下实验: Ⅰ.称取一定量的3AgNO 晶体,溶于水,用250mL 容量瓶定容至250mL 溶液,再用某基准溶液滴定,测得其准确浓度为10.8000mol L -⋅;Ⅱ.将所得亚硝酰氯(NOC1)产品13.10g 溶于水,配制成250mL 溶液;取出25.00mL ,以24K CrO 溶液为指示剂,用上述130.8000mol L AgNO -⋅溶液滴定至终点,消耗3AgNO 溶液的体积为22.50mL (已知:24Ag CrO 为砖红色固体)。


2014年普通高等学校招生全国统一考试(浙江卷)理科综合化学试题解析教师:杭州新理想高复李良总体分析:这次化学试题应该来说学生得分不会很低,同样拿高分也不简单,由于28题实验题与29有机推断题稍简单,这样的题平时月考考60的同学这次有机会拿70分。
平时拿90分的同学未必考得出90分……7.下列说法不正确...的是A.光催化还原水制氢比电解水制氢更节能环保、更经济B.氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理C.某种光学检测技术具有极高的灵敏度,可检测到单个细胞(V=10-12L)内的数个目标分子,据此可推算该检测技术能测量到细胞内浓度约为10-12~10-11mol ·L-1的目标分子D.向汽油中添加甲醇后,该混合燃料的热值不变解析:答案D热值:1千克某种固体(气体)燃料完全燃烧放出的热量称为该燃料的热值,很明显加入甲醇带来的热值肯定改变。
这道题要选择错误答案一般同学都能得出正确答案,实战中还是那句话:其它答案说的那么有道理一般都是对的。
8.下列说法正确的是A.金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理B.用pH计、电导率仪(一种测量溶液导电能力的仪器)均可检测乙酸乙酯的水解程度C.邻苯二甲酸氢钾可用于标定NaOH溶液的浓度,假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小D.向某溶液中加入茚三酮试剂,加热煮沸后溶液若出现蓝色,则可判断该溶液含有蛋白质解析:选择B这里面A答案明显不对,D答案茚三酮是检验氨基酸的,很多人或在BC中徘徊,C答案是错误的,由于称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,得到的邻苯二甲酸氢钾的实际浓度偏小,会使标准液实际浓度减小,使得实际消耗的邻苯二甲酸氢钾的体积增大,所以计算得到的得到的待测液浓度偏大。
B答案乙酸乙酯水解因为有乙酸的存在,酸度,离子浓度都会改变, 用pH计、电导率仪(一种测量溶液导电能力的仪器)均可检测乙酸乙酯的水解程度.9.如表所示的五种元素中,W 、X 、Y 、Z 为短周期元素,这四种元素的原子最外层电子数之和为22。

用紫外分光光度计检测葡萄糖酸钙的流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!使用紫外分光光度计检测葡萄糖酸钙的操作流程葡萄糖酸钙是一种常见的食品添加剂和营养补充剂,其含量的准确测定对于产品质量控制至关重要。

2022年高考化学二轮复习重点专题常考点突破练专题十八 无机实验计算题型一、 纯度计算1.某同学通过如下流程制备氧化亚铜:已知:CuCl 难溶于水和稀硫酸,+2+22Cu O+2H =Cu +Cu+H O 下列说法不正确的是A .步骤②2SO 可用23Na SO 替换B .步骤③中为防止CuCl 被氧化,可用23H SO 溶液洗涤C .步骤④发生反应的离子方程式为--222CuCl+2OH =Cu O+2Cl +H OD .如果2Cu O 试样中混有CuCl 和CuO 杂质,用足量稀硫酸与2Cu O 试样充分反应,根据反应前、后固体质量可计算试样纯度 【答案】D2.现有2.0g 含Na 2O 杂质的Na 2O 2样品,用如图的实验装置测定Na 2O 2试样的纯度,(可供选用的反应物只有CaCO 3固体、盐酸、硫酸和蒸馏水)下列说法错误的是A .装置A 中液体试剂为盐酸B .装置B 的作用是除去挥发出的HCl 气体C .若去掉装置E 会导致所测Na 2O 2试样的纯度偏低D .若反应结束后有气体体积计算得气体质量为0.32g ,则Na 2O 2试样的纯度为78% 【答案】C3.实验室测量 Al(NO 3)3纯度的步骤如图所示。
下列说法正确的是A .配制 Al(NO 3)3溶液只需要 250 mL 容量瓶和玻璃棒这两种玻璃仪器B .加入试剂 a 发生反应的离子方程式为 Al 3+ + 3OH − = Al(OH)3 ↓C .操作“b”需要在蒸发皿中进行D .Al(NO 3)3的纯度为21710m 100%17m 【答案】D4.(2021·云南昆明市·高三三模)II.测定Li 3N 产品纯度(5)反应结束冷却至室温后,读数前应先_______,测得体积为VL(已折合成标准状况)。
若杂质与水反应不产生气体,则Li 3N 的质量分数为_______(只列出含m 和V 的计算式,不必计算化简)。

葡萄糖酸钙含量测定【实验目的】1、熟悉掌握配位滴定法。
2、定量测出葡萄糖酸钙含量。
【实验原理】葡萄糖酸钙含有钙元素,可凭借配位滴定法测定钙元素含量来间接测定葡萄糖酸钙含量。
取适量样品溶解,加NH3-NH4Cl缓冲溶液与EBT(铬黑T)指示剂,用EDTA滴定液滴定至溶液由紫红色转变为纯蓝色。
此时读出EDTA滴定液使用量,计算可得样品中钙元素的含量,由此则可以计算出葡萄糖酸钙的质量,与取用样品质量对比,则可得出样品的葡萄糖酸钙含量。
反应式如下:Ca2++H2In-→CaIn-(红色)+2H+Ca2++H2Y2-→CaY2-+2H+H2Y2-+CaIn-→H2In-(蓝色)+CaY2-【试剂与仪器】试剂:蒸馏水、0.05mol/L EDTA滴定液、葡萄糖酸钙样品、0.100mol/LNH3-NH4Cl缓冲溶液、EBT(铬黑T)指示剂。
仪器:电子天平,200ml锥形瓶若干、三脚架、石棉网、酒精灯、25ml吸量管、酸碱两用滴定管、100ml量筒。
【实验步骤】1.用电子天平称取葡萄糖酸钙样品约0.500g,并记录准确称量数据为M。
2.加蒸馏水至100.0ml,微温,轻摇,使之溶解。
3.加0.100mol/L氢氧化钠试液15ml与钙紫红素指示剂约0.1g。
4.取装有0.05mol/LEDTA滴定液的滴定至溶液由紫色转变为纯蓝色,记录消耗EDTA滴定液的体积V1(ml)。
计算Ca2+含量:c(Ca2+)=c(EDTA)×V1(EDTA)/V(水样)×1000(mmol·L-1)5.计算得样品中Ca2+含量后可计算样品中的葡萄糖酸钙含量,记为m,计算百分含量,即m/M6.重复测定4~6次,求均值。
【实验数据与表格】日期:温度:相对湿度:【思考题】1.配位滴定中为什么要加入缓冲溶液?2.通常使用乙二胺四乙酸二钠盐配制EDTA标准溶液,为什么不用乙二胺四乙酸?3.在配位滴定中,指示剂应具备什么条件?4.如果只用铬黑T指示剂,能否测定Ca2+的含量?如何测定?5.配位滴定法与酸碱滴定法相比,有哪些不同点?操作当中应注意哪些问题?【参考文献】[1]北京师范大学无机化学教研室编.无机化学实验.第3版.北京:高等教育出版社,2001[2]李雪华.基础化学实验.北京:人民卫生出版社,2002[3]唐中珅,陈清原.医用化学实验.北京:科学出版社,2010[4]张枫,房晨婕.医用化学基础.北京:中国协和医科大学出版社,2010。
第三章 药物的杂质检查药物的检查包括四大方面,分别是有效性、均一性、安全性和纯度要求。
药物的纯度是指药物的纯净程度,药物中的杂质是影响药物纯度的主要因素。
因此,药物的纯度检查即是指药物的杂质检查。
根据药物中杂质的来源可分为一般杂质及特殊杂质。
一般杂质是在多数药物的生产和贮藏过程中都容易引入的杂质,如氯化物、硫酸盐、铁盐、重金属、砷盐、炽灼残渣、残留溶剂等,而特殊杂质是各个药物中可能存在的原料、中间体、降解物、异构体、副反应产物等,是该药在生产和贮藏过程中有可能引入的仅属该药特有的一些杂质。
对于药物中所存在的杂质,在不影响疗效、不产生毒性和保证药物质量的前提下,允许药物中含有一定量的杂质。
杂质的限量一般根据杂质的安全性、生产的可行性、产品的稳定性等综合考虑而定。
药物中杂质限量的控制方法一般分两种:一种为限量检查法(limit test ),另一种是对杂质进行含量测定。
限量检查法通常不要求测定其准确含量,只需检查杂质是否超过限量。
进行限量检查时,多数采用标准溶液对照法,此外,还可采用灵敏度法和比较法。
对照法系指取一定量的被检杂质标准溶液和一定量供试品溶液,在相同的条件下试验,比较结果,以确定杂质含量是否超过限量。
由于供试品(S )中所含杂质的最大允许量可以通过杂质标准溶液的浓度(C )和体积(V )的乘积表达,所以,杂质限量(L )的计算公式为:%供试品量体积)杂质标准溶液(浓度杂质限量=100⨯⨯ 或%100S V C L ⨯⨯= 采用对照法须注意平行操作原则,即供试溶液和对照溶液应在完全相同的条件下反应,如加入的试剂、反应的温度、放置的时间等均应相同,这样检查结果才有可比性。
灵敏度法系指在供试品溶液中加入一定量的试剂,在一定反应条件下,不得有阳性结果出现,从而判断供试品中所含杂质是否符合限量规定。
该法不需用杂质标准品溶液对比。
如乳酸(lactic acid )中枸橼酸、草酸、磷酸或酒石酸的检查:取本品0.5g 加水适量使成5ml ,混匀,用氨试液调至微碱性,加氯化钙试液1ml ,至水浴中加热5min ,不得产生浑浊。
实验十八 补锌口服液葡萄糖酸锌的合成实验(6学时)一、实验目的葡萄糖酸锌是近年来开发的一种补锌食品添加剂。
人体缺锌会造成生长停滞、自发性味觉减退和创伤愈合不良等现象,从而发生各种疾病。
以往常用硫酸锌做锌添加剂,但它对人体肠胃道有一定刺激作用,而且吸收率也比较低。
葡萄糖酸锌则有吸收率高、副作用少、使用方便等特点,是20世纪80年代中期发展起来的一种锌添加剂,特别是用作儿童食品、糖果的添加剂,应用日趋广泛。
合成葡萄糖酸锌的方法很多,可以分为直接合成法和间接合成法两大类。
葡萄糖酸锌的纯度分析可采用络合滴定法。
通过本实验要求达到一下目的:1. 学习和掌握合成简单药物的基本方法。
2. 学习并掌握葡萄糖酸锌的合成。
3. 进一步巩固络合滴定分析法。
4. 了解锌的生物意义。
二、实验原理葡萄糖酸锌为白色或接近白色的结晶状粉末,无臭略有不适味,溶于水,易溶于沸水,15℃时饱和溶液浓度为25%(质量分数),不溶于无水乙醇、氯仿和乙醚。
直接合成法是以葡萄糖酸钙和硫酸锌(或硝酸锌)等为原料直接合成。
其反应式为:427116427116)()(CaSO O H C Zn ZnSO O H C Ca +=+这类方法的缺点是产率低、产品纯度差。
间接合成法也是以葡萄糖酸钙为原料,经阳离子交换树脂得葡萄糖酸,再与氧化锌反应得葡萄糖酸锌。
它的工艺条件容易控制、产品质量较高等特点。
在ph≈10的溶液中,铬黑T (EBT )与Zn 2+形成比较稳定的粉红色螯合物(Zn-EBT ),而EDTA 与Zn 2+能形成更为稳定的无色螯合物。
因此,滴定至终点时,铬黑T 便被EDTA 从Zn-EBT 中置换出来,游离的铬黑T 在ph =8~11的溶液中呈纯蓝色。
纯蓝色酒红色 EBTEDTA Zn EDTA EBT Zn +-=+-葡萄糖酸锌溶液中游离的锌离子也可与EDTA 形成稳定的络合物,因此EDTA 滴定法能确定葡萄糖酸锌的含量。
三、实验仪器及试剂1. 仪器 台秤,蒸发皿,布氏漏斗,吸滤瓶,离子交换柱(ψ10~20mm ,长25~30cm 玻璃管),电子天平,滴定管(50mL ),移液管(25mL ),烧杯,容量瓶,电磁搅拌器。
第1篇一、实验目的1. 掌握多糖提取的原理和操作流程;2. 了解不同提取方法对多糖提取率的影响;3. 学习多糖的鉴定方法;4. 熟悉实验仪器的使用。
二、实验原理多糖是一类高分子碳水化合物,广泛存在于植物、动物和微生物中。
多糖具有多种生物活性,如抗炎、抗氧化、免疫调节等。
多糖的提取方法主要有热水提取法、酸提取法、碱提取法等。
本实验采用热水提取法提取多糖,并利用苯酚-硫酸法对提取的多糖进行鉴定。
三、实验材料与试剂1. 实验材料:干燥的植物原料(如香菇、大枣、紫菜等);2. 实验试剂:蒸馏水、NaOH、HCl、苯酚、硫酸、乙醇、DPPH、卡拉菲指示剂等;3. 实验仪器:组织匀浆机、水浴锅、台式高速离心机、分光光度计、容量瓶、移液管、烧杯、漏斗等。
四、实验步骤1. 多糖提取(1)将干燥的植物原料粉碎,过筛,取适量粉末;(2)将粉末加入一定量的蒸馏水中,加热至80℃,保持2小时;(3)冷却后,过滤得到滤液;(4)将滤液加入适量的乙醇,静置过夜,离心,收集沉淀;(5)将沉淀用95%乙醇洗涤,干燥,得到多糖粗品。
2. 多糖鉴定(1)苯酚-硫酸法鉴定①取一定量的多糖粗品,加入苯酚溶液,振荡均匀;②加入硫酸溶液,观察溶液颜色的变化;③与标准溶液进行比较,确定多糖的存在。
(2)DPPH自由基清除法①配制一定浓度的DPPH溶液;②取一定量的多糖粗品,加入DPPH溶液,振荡均匀;③在一定时间后,测定溶液的吸光度;④计算DPPH自由基清除率,评估多糖的抗氧化活性。
五、实验结果与分析1. 多糖提取实验结果表明,热水提取法能够有效地提取植物原料中的多糖,提取率较高。
2. 多糖鉴定(1)苯酚-硫酸法鉴定实验结果显示,多糖粗品与苯酚-硫酸溶液反应后,溶液颜色变为深棕色,说明多糖的存在。
(2)DPPH自由基清除法实验结果显示,多糖粗品对DPPH自由基具有清除作用,清除率随着多糖浓度的增加而增加,表明多糖具有一定的抗氧化活性。
六、实验结论1. 热水提取法能够有效地提取植物原料中的多糖,提取率较高;2. 多糖具有抗氧化活性,可作为天然抗氧化剂;3. 本实验为多糖的提取和鉴定提供了一种简单、实用的方法。
专题64 物质制备纯化综合实验1.[2019新课标Ⅰ]硫酸铁铵[NH4Fe(SO4)2·x H2O]是一种重要铁盐。
为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:回答下列问题:(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。
铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。
(3)步骤③中选用足量的H2O2,理由是_______________。
分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。
硫酸铁铵晶体的化学式为______________。
2.[2019新课标Ⅱ]咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5℃,100℃以上开始升华),有兴奋大脑神经和利尿等作用。
茶叶中含咖啡因约1%~5%、单宁酸(K a约为10−6,易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。
实验室从茶叶中提取咖啡因的流程如下图所示。
索氏提取装置如图所示。
实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。
萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。
回答下列问题:(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是______________,圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒______________。
实验二葡萄糖酸钙的合成
一、实验目的
1、掌握由葡萄糖、碳酸钙合成葡萄糖酸钙的原理及方法;
2、学习氧化反应在药物合成中的应用
二、实验原理
葡萄糖是自然界分布最广且最为重要的一种单糖,它是一种多羟基醛,分子量为180,白色晶体,易溶于水,味甜,熔点146℃。
分子中的醛基,有还原性,能与银氨溶液等弱氧化剂反应生成葡萄糖酸。
葡萄糖酸的制备方法一般有酶法、电解氧化法,空气催化氧化法和化学试剂氧化法。
工业上生产葡萄糖酸的方法,主要是酶法和电解氧化法。
本实验采用的氧化剂是双氧水,用过氧化氢作氧化剂,在无任何催化剂的作用下,把葡萄糖氧化成葡萄糖酸,不需进行葡萄糖酸的精制,然后再用碳酸钙中和生成的葡萄糖酸,结晶后就可得到葡萄糖酸的粗品。
葡萄糖酸钙是一种医药和精细化学品,作为药物,可促进骨骼及牙齿钙化,维持神经和肌肉正常兴奋,降低毛细血管渗透性的营养品。
可用于由于血钙降低而引起的手足抽搐症及麻症、渗出性水肿、瘙痒性皮肤病等疾病的治疗;作为精细化学品,它可作为食品添加剂、水质稳定剂和水泥助剂。
其反应的过程如下:
三、主要试剂与仪器
试剂:葡萄糖、30%双氧水、碳酸钙、无水乙醇
仪器:烧杯、滴管、量筒、磁力粒,过滤器、10ml的注射器、集热式磁力搅拌器,微孔滤膜
四、实验步骤
1、葡萄糖酸溶液的制备
称取0.1mol(18g)葡萄糖,置于100ml三角烧杯中,加入 3倍量的30%双氧水(34ml),在磁力搅拌器中沸水浴加热、搅拌得到无色透明的葡萄糖酸溶液.当氧化率达80%以上时(60min),停止反应,把反应液冷却至60-70℃待用.
2、葡萄糖酸钙的制备
在搅拌下,分批加人约0.05mol(5g)的碳酸钙至葡萄糖酸溶液中,直至无 CO
2气体放出为止。
反应完全后,趁热用注射器把反应液注入装有0.22微米过滤器过滤,得澄清透明葡萄糖酸钙溶液。
3、结晶得到葡萄糖酸钙的粗品
把上述葡萄糖酸钙溶液转入100ml三角烧杯冷却至室温,往烧杯中添加适量的无水乙醇(约1:1的比例),得到不溶乙醇溶液,静置10min得到絮状沉淀,用已称过重量的滤纸抽滤得到白色粉末状葡萄糖酸钙粗品。
4、计算产率
抽滤得到的葡萄糖酸钙粗品在50℃烘箱过夜。
减去滤纸重,得到合成的实际生成量。
葡萄糖酸钙的得率=实际生成量(g)/理论生成量(g)×100%
五、思考题
1、阐述用双氧水氧化得到葡萄糖酸的优点与缺点?
2、分析所得到的葡萄糖酸钙高低及其可能的影响因素?
附注:
物质摩尔质量溶解性
葡萄糖180 易溶于水
葡萄糖酸钙430 易溶于沸水,略溶于冷水,不溶于乙醇或乙醚等有机溶剂双氧水43 能与水、乙醇或乙醚以任何比例混合。
不溶于苯、石油醚碳酸钙100 几乎不溶于水,在含有铵盐或三氧化二铁的水中溶解,不溶
于醇。