猪场抗原抗体检测报告分析学习全解
- 格式:ppt
- 大小:1.70 MB
- 文档页数:17


几张图,了解蓝耳病流行现状近两年,猪伪狂犬病有所消停,圆环病毒病也有所改善,唯独蓝耳病一直困扰惟独着猪场。
目前来看,蓝耳病依然是毒害危害养猪业最大的疾病,但可防可控。
2021年度,福州大北农全国疫病防控服务中心对动物各地猪场进行抗原抗体检测,处理完送检的病料其后,通过RT-PCR检测方法进行鉴定蓝耳病复合物检测,并对其流行情况进行整理,为猪场蓝耳病的防控提供可靠依据。
一、检测地区分布要闻2021年度,共检测351份病料,主要来自全国的五个省份,福建省居首位,共检测病料194份(55.3%)。
其次为山东省64份(18.2%)、浙江省、湖南省和广东省。
检测范围远至全国,数据可靠。
几张图,了解蓝耳病流行亟需二、蓝耳病毒阳性检出率地理分布对2021年度检测的351份病料进行蓝耳病毒RT-PCR检测,并对其阳性检出率进行区域统计,见下图。
图中可以蓝耳病在全国各地流行范围广,除安徽和江西外,其他省份阳性发率在40%-70%。
2021-2021年猪蓝耳病火鸡生育率逐年递减,2021年呈明显上升趋势明显,2021年猪蓝耳病病毒尿检的检出率约为60%,呈上升趋势。
这除了与猪场的管理、环境、免疫因素有关外,还极有可能与病原病毒发生变异有关。
三、蓝耳病病毒阳性检出率季节分布对2021年检测的351份病料或进行猪蓝耳病抗原(PRRSV)阳性滴度进行统计,见下图:从图中可以看出蓝耳病一年四季均可发生,频发多为寒冷的冬季(1月和2月),冬春交替的4月,春夏交替的6月以及夏秋交替的9月。
可见蓝耳病的爆发多见于季节交替的常为时候,季节交替带来的环境变化,导致猪只免疫力下降,影响蓝耳疫苗免疫清晰度甚至出现免疫失败的现象。
所以在蓝耳病防控喂食过程中必须要改善饲养环境,减少冷热应激。
总而言之,蓝耳病目前无特效药,控制该病,防重于治,关键在于选好疫苗。
做好猪场免疫预防,制定严格免疫程序,定期或进行免疫抗体监测。
福州大北农动物猪场防控服务中心对疫病如何选好蓝耳疫苗做了如下分析:第一,市面上许多蓝耳病不是活疫苗遗传不更稳定、毒力偏强,免疫这种疫苗相当于给猪群感染强流感病毒毒株,效果适得其反;第二,蓝耳病毒在稻田变异快,养殖场不可能迅速找到与自身流行毒株绝不同源性完全一致的疫苗。

猪的血清学试验:对结果的解释Porcine ser ology: Interpreting the Results 作者:Carlos Artigas博士(西班牙Hipra研究室兽医技术服务主任) 译者:秦崇德(上海市农业科学院畜牧兽医研究所)正处在新世纪之初的当今,信息是我们在所有领域取得进展的最有价值的工具。
正是由于这个原因,我们必须从一开始就将血清学分析作为从猪体和猪场取得信息的一个途径。
临床兽医每天并且以后仍将越来越多地在所有与健康和生产率有关的领域内利用血清学分析。
在养猪生产中,对于血清学实验室得出的结果进行正确的分析,非常有助于我们得到为作出决策以及改进任何生产参数所需要的信息。
当今猪场的生产水平都非常高,这就使得猪场的疾病处于非常动态化的状况之中,尤其是当突然出现新的、容易引发其它疾病或本身就可引起免疫抑制的病毒性病原体的时候。
由于这一动态状况,我们决不能忘记对猪场中所有可控制的参数进行控制的重要性,而这些参数中的一种就是猪的免疫状态。
对于猪来说,疾病就意味着生产率下降,疾病必须被看作是许多问题的集合,而不应被看作是单个的问题。
血清学分析则是使这一问题集合得到解决所必需的工具。
血清学分析为我们提供了了解免疫学状态的机会,而我们可将所了解的信息用于:·预防新的疾病进入猪场:新的疾病进入猪场,主要发生在引进新的后备母猪时;了解公猪中心的免疫状态,就可在采用人工授精时预防将新的疾病引入猪场;·确定免疫接种的最佳时间:对于许多疾病来说,非常重要的就是要了解母源抗体水平的下降情况; ·了解猪群的健康状况:定期进行血清学分析,就可对不同次取样的分析结果进行比较,从而了解猪群的正常免疫状态(每个猪场的正常免疫状态都是互不同的);·进行疾病诊断:在猪场发生了某种疾病时,我们可进行血清学研究而将研究结果与该猪场的正常情况进行比较。
发生感染之后,抗体水平通常会在15天内增高2~3倍,具体时间取决于疾病的种类; ·判断保护力水平的高低:在免疫接种之后,我们可根据血清学分析结果而得知血液中抗体水平是否达到了预期水平,这对于了解疾病来说也是非常重要的。

实验室对猪病的检测可以采用多种方法和技术。
以下是一些常见的猪病检测方法:
1.血清学检测:通过采集猪的血液样本,进行血清学检测,包括血清抗体检测和血清学指
标检测。
这些检测可以用于确定猪是否感染了特定的病原体,或者是否已经产生了免疫应答。
2.分子生物学检测:分子生物学技术,如聚合酶链反应(PCR)、逆转录聚合酶链反应
(RT-PCR)和核酸杂交等,可以用于检测病原体的核酸序列,从而确定猪是否感染了特定的病原体。
这些方法通常能提供快速、准确的结果。
3.细菌学和真菌学检测:通过细菌培养、细菌鉴定和真菌培养等方法,可以检测猪体内是
否存在细菌或真菌感染。
这些检测方法可以确定病原体的种类和敏感性,以便选择合适的治疗方法。
4.组织学检测:通过取得猪的组织样本,进行组织学检测,如病理学检查、免疫组织化学
染色和组织培养等,可以确定病变的组织学特征,辅助诊断和病因分析。
5.免疫学检测:包括免疫荧光、免疫酶联免疫吸附试验(ELISA)、免疫电泳等方法,可
以检测猪体内特定抗体或抗原的存在,用于诊断感染性疾病。

非洲猪瘟检测与诊断技术要点中国农业科学院上海兽医研究所牵头编制2019年9月前言非洲猪瘟(African Swine Fever,ASF)是由非洲猪瘟病毒(African Swine Fever Virus,ASFV)引起的猪的一种急性、热性、高度接触性传染病,发病率和死亡率可达100%。
世界动物卫生组织(OIE)将其列为法定报告动物疫病,我国将其列为一类动物疫病。
1921年,ASF最初发现于肯尼亚,上世纪五、六十年代在非洲、欧洲、南美洲流行。
2018年8月初我国爆发非洲猪瘟首起疫情以来,该疫病已蔓延全国23个省,给我国生猪养殖业和国民经济带来巨大损失。
由于ASFV感染机制复杂,目前世界范围内至今尚无有效预防用非洲猪瘟疫苗,因此早期发现、精准检测是控制该病传播和发生的关键。
本文参考了OIE关于非洲猪瘟防控的文件、农业农村部发布相关文件和中国动物卫生与流行病学中心、中国动物疫病预防控制中心的相关技术手册,结合我们的研究成果,从非洲猪瘟早期发现、现场排查、精准检测三个方面的技术要点编写而成,主要面向从事非洲猪瘟现场排查和检测的一线防疫人员,提供了简明实用的相关操作技术与方法,为非洲猪瘟现场排查与检测等相关工作提供参考。
编者牵头团队:上海兽医研究所猪呼吸道传染病团队负责人:马志永参加人:魏建超等参加团队:哈尔滨兽医研究所猪烈性传染病创新团队负责人:仇华吉参加人:罗玉子等兰州兽医研究所外寄生虫与虫媒疫病团队负责人:刘志杰参加人:林密等兰牧药研究所中兽医与临床团队负责人:李建喜参加人:崔东安目录一、概述 (1)二、早期发现 (4)三、现场排查 (5)(一)准备工作 (6)1.人员准备 (6)2.车辆准备 (6)3.物品准备 (6)(二)进出养殖场要求 (7)1.抵达养殖场 (7)2.穿戴个人防护设备(在清洁区) (8)3.离场前准备 (8)4.离场后 (9)5.消毒剂的选择 (9)(三)临床诊断 (9)1.临床症状 (10)2.剖检病变 (11)3.鉴别诊断 (12)4.发现疑似病例的情况下应立即采取的行动 (13)(四)样品采集、包装与运输 (14)1.采样方法 (14)2.样品的记录、保存、包装和运送 (15)3.废弃物处理 (18)四、实验室诊断与确诊 (19)1.快速精准检测 (19)2.疫情确诊 (19)附件一:非洲猪瘟防治技术规范 (20)附件二:国家非洲猪瘟参考实验室、专业实验室和区域实验室名单 (24)一、概述非洲猪瘟病毒(ASFV)是一种有囊膜的DNA病毒,是非洲猪瘟病毒科、非洲猪瘟病毒属的唯一成员。

胶体金免疫层析法检测猪瘟(强弱毒区分)抗体研究李华玮;郑鸣【摘要】以原核表达的重组猪瘟病毒E2蛋白为弱毒抗原,以猪瘟病毒(HCV)强毒株细胞培养物为强毒抗原,利用胶体金标记技术国内首次建立了HCV抗体检测(强弱毒区分)的免疫层析试纸条(双抗原夹心法).研究结果表明,检测时只需将80 μL待检测猪血清加于加样端20 min后观察结果即可.若观察区上端仅1条红色条带,即为HCV抗体阴性;2~3条条带即为HCV抗体阳性;若出现2条条带的位置为观察区上端和中间部位,即为HCV弱毒抗体阳性;若出现2条条带的位置位于观察区上端和下端部位,则为HCV强毒抗体阳性;若出现3条条带则HCV强弱毒抗体均为阳性.本试纸可很好地避免因试验操作造成的假阳性、假阴性,且操作简单、快速、简便、灵敏度高、特异好、不需特殊设备、价格低廉,20 min即可判断结果,且可区分强弱毒感染,适于基层实验室和现场检测.【期刊名称】《广东农业科学》【年(卷),期】2012(039)007【总页数】4页(P130-132,封3)【关键词】猪瘟病毒(HCV);细胞培养;胶体金免疫层析【作者】李华玮;郑鸣【作者单位】郑州牧业高等专科学校生物工程系,河南郑州450011;郑州牧业高等专科学校生物工程系,河南郑州450011【正文语种】中文【中图分类】S852.65+1猪瘟病毒属于黄病毒科瘟病毒属,有囊膜、耐热、不耐碱和脂溶剂,仅一个血清型。
猪瘟是由猪瘟病毒引起的一种高度接触性传染病,猪是该病毒唯一的自然宿主[1-4]。
当前,猪瘟在我国各地区时有发生,每年因猪瘟而死亡的猪只占病死猪的1/3以上,是养猪业威胁最重的传染病之一,常造成猪场破产[5-7]。
当前猪瘟病毒在体内抗体压力或体外继代影响下,已形成强毒型和弱毒型,首发性病毒毒性较强,常发性病毒毒性较弱[8-9]。
强毒株对任何年龄和品种的猪种均有极高的致病和致死率;弱毒株仅有抵抗力差的猪才会感染,感染后不会死亡但活力不足,表现症状不典型而往往被忽视,但其可长期带毒传播,进而成为最重要的传染源[10]。



猪圆环病毒2型检测技术及研究进展猪圆环病毒2型(PRRSV-2)是一种严重危害猪健康的病毒,对猪场养殖业造成了严重的经济损失。
猪圆环病毒2型检测技术及研究的进展备受关注。
本文将对猪圆环病毒2型检测技术及研究进展进行介绍。
猪圆环病毒2型是一种RNA病毒,主要感染猪的肺泡巨噬细胞和树突细胞,引起猪的呼吸道疾病。
该病毒具有高变异性和抗原异质性,使得对其检测和控制具有一定的困难。
目前,针对猪圆环病毒2型的检测技术主要包括病毒抗原检测、病毒核酸检测和抗体检测。
病毒抗原检测是目前应用最为广泛的检测技术之一,其原理是利用酶联免疫吸附试验(ELISA)或荧光素酶免疫吸附测定(FIA)等方法检测猪血清、血浆或组织样品中的猪圆环病毒2型抗原。
病毒核酸检测则是通过聚合酶链式反应(PCR)技术检测病毒在猪体内的核酸含量,可快速、准确地检测猪圆环病毒2型的感染情况。
抗体检测则是通过酶联免疫吸附试验(ELISA)等方法检测猪血清或血浆中的病毒抗体水平,用于评估猪圆环病毒2型的感染和免疫情况。
近年来,针对猪圆环病毒2型的检测技术不断得到改进和提高,使得对该病毒的检测更加快速、准确和灵敏。
新型ELISA检测试剂盒的开发,可以大大缩短检测时间,提高检测的准确性;PCR技术的改进也使得对病毒核酸的检测更为灵敏和快速;抗体检测方面也出现了更加精准的检测方法,能够更好地评估猪圆环病毒2型的感染和免疫情况。
除了检测技术的不断改进之外,针对猪圆环病毒2型的研究也在不断深入。
研究人员对猪圆环病毒2型的传播途径、致病机制、病毒变异性等方面进行了深入研究,为更好地控制和防治该病毒提供了重要的理论支持。
研究人员还不断寻找新的疫苗和药物来应对猪圆环病毒2型的感染,为猪场养殖业的健康发展提供有力的支持。
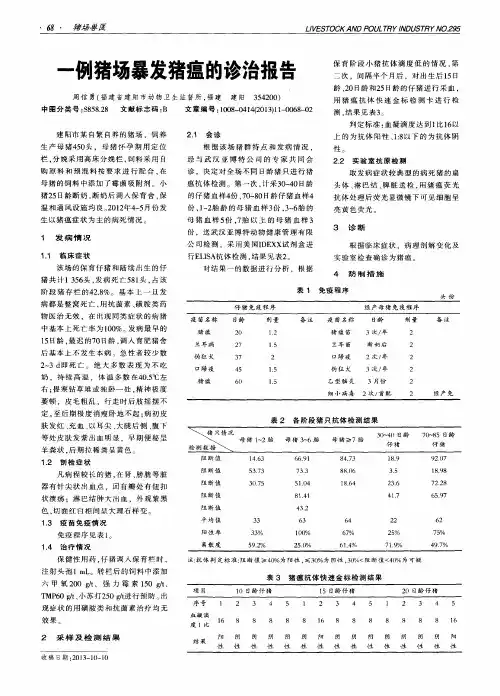

猪场免疫效果评估和疫情预测方案根据对猪群大量检测数据的分析,结合生产实践情况;制定对猪场常见病的免疫效果评估和疫情预测方案。
一、种猪群的免疫效果评估和疫情预测方案1、后备公猪、母猪:在开始使用前15天—30天,母猪全采或按照30头/批次抽检;公猪100%采样,采集血样进行如下项目检测:1.1、猪瘟抗体:保护率(比阳性率更高的判断标准)100%。
非洲猪瘟抗体阳性率0%。
1.2、伪狂犬:gB抗体保护率(比阳性率更高的判断标准)100%;gE抗体阴性率100%。
1.3、蓝耳病抗体:阳性率100%、离散度<30%。
1.4、圆环病毒抗体:阳性率100%、离散度<30%。
1.5、细小病毒抗体:阳性率100%、离散度<30%。
1.6、乙型脑炎抗体:阳性率100%、离散度<30%。
1.7、口蹄疫:O型抗体保护率(比阳性率更高的判断标准)100%;A型抗体保护率(比阳性率更高的判断标准)100%2、生产公猪、母猪:每年4月和10月下旬两次检测,母猪按10%的比例随机采集血样、公猪100%采样(可以采集唾液)进行如下项目的检测:2.1、猪瘟抗体:保护率(比阳性率更高的判断标准)100%;2.2、伪狂犬:gB抗体保护率(比阳性率更高的判断标准)100%;母猪gE抗体阳性率逐年下降、公猪立即淘汰、2.3、蓝耳病抗体:阳性率100%、离散度<30%。
2.4、圆环病毒抗体:阳性率100%、离散度<30%。
2.5、口蹄疫:O型抗体保护率(比阳性率更高的判断比作准)100%;A型抗体保护率(比阳性率更高的判断标准)100%2.6、在采集血样的同时采集所有生产公猪的精液进行如下项目的检测:2.6.1、蓝耳病抗原,阳性猪立即淘汰2.6.2、伪狂犬抗原,阳性猪立即淘汰2.6.3、圆环病毒抗原,阳性猪立即淘汰2.6.4、非洲猪瘟抗原,阳性猪立即淘汰。
2.7、每3个月1次随机采集20%窝仔猪的脐带血,选择每窝中的所有弱仔采样;进行如下项目的检测2.7.1、圆环病毒抗原,仔猪阳性、母猪立即淘汰。
PRRSV Nsp7间接ELISA检测方法的建立及其单克
隆抗体的制备的开题报告
一、研究背景:
猪繁殖与呼吸综合征病毒(PRRSV)是一种引起严重传染病的病原体,主要影响猪的健康和生产。
PRRSV属于RNA病毒,在猪场中造成的经济损失极大。
因此,开发简便、快速、灵敏的PRRSV检测方法对于疫情的预防和控制具有非常重要的意义。
二、研究目的和内容:
本研究的目的是建立一种基于Nsp7(non-structural protein 7)的间接ELISA检测方法,并制备Nsp7的单克隆抗体。
具体研究内容包括以下几个方面:
1.采集PRRSV感染病猪血清,用于制备Nsp7特异性的抗原。
2.克隆Nsp7基因并表达蛋白,通过Western blot鉴定其特异性。
3.筛选Nsp7特异性单克隆抗体。
4.优化Nsp7间接ELISA检测方法,评估其敏感性和特异性。
三、研究意义:
建立Nsp7间接ELISA检测方法和制备单克隆抗体,不仅具有重要的理论意义,还可以为PRRSV的病毒学和分子生物学研究提供新的手段,同时也可以为PRRSV的预防和控制提供重要的技术支持。
猪瘟诊断技术国标猪瘟,又称猪疫、疟热等,是一种由猪瘟病毒引起的急性、急性高传染性疾病,主要通过直接接触、飞沫传播和病毒污染物传播,对猪群健康和养猪业产生了极大的危害。
猪瘟既影响猪的生长发育,又引起大量猪的死亡,对于猪场的经济利益造成了极大的损失。
猪瘟的早期诊断和有效防治显得尤为重要,将有助于降低猪瘟对养猪业的危害和影响。
为了规范和标准化猪瘟的诊断技术,提高猪瘟的诊断水平和准确度,促进猪瘟的早期发现和有效防治,制定了《猪瘟诊断技术国标》,本国标适用于养殖场猪瘟的临床诊断、实验室检测以及疫情监测。
一、范围本国标规定了猪瘟诊断技术的相关术语和定义、诊断技术的要求和方法、技术实施、检测结果判定等内容。
二、术语和定义1. 猪瘟病毒:引起猪瘟的病原体,是一种单链RNA病毒。
2. 猪瘟抗体:猪体内产生的抗猪瘟病毒的特异性免疫球蛋白。
3. 临床试验:通过观察猪在自然状态下出现的病症和异常行为等情况,进行初步判断猪是否感染了猪瘟。
三、诊断技术的要求和方法1. 诊断技术的要求:(1)准确性:诊断技术应具有高度的准确性,能够对感染猪瘟的猪进行准确鉴定。
(2)快速性:诊断过程应迅速,以便及时采取应对措施。
(3)简便性:诊断技术应尽量简化操作步骤,提高操作的便利性。
(4)经济性:诊断技术应具有较低的成本,以降低检测的经济负担。
2. 诊断技术的方法:(1)临床观察法:通过观察被怀疑感染猪的临床表现,如发热、咳嗽、呕吐等,作为诊断的第一步。
(2)实验室检测:通过采集猪体液、组织等样本进行猪瘟病毒核酸检测、病毒抗原检测、猪瘟抗体检测等方法。
四、技术实施1. 临床试验:(1)确诊试验:对被怀疑感染猪进行详细的临床观察,并采集相关样本进行实验室检测。
(2)排除试验:对疑似猪瘟病例进行详细观察,并采集相关样本进行实验室检测,最终排除猪瘟感染的可能性。
2. 实验室检测:(1)样本采集:应选择体温升高、鼻涕多、呼吸困难等临床症状较为明显的猪进行样本采集,包括血液、鼻咽拭子、腮腺淋巴结组织等。