猪场抗原抗体检测报告分析学习
- 格式:ppt
- 大小:1.70 MB
- 文档页数:17
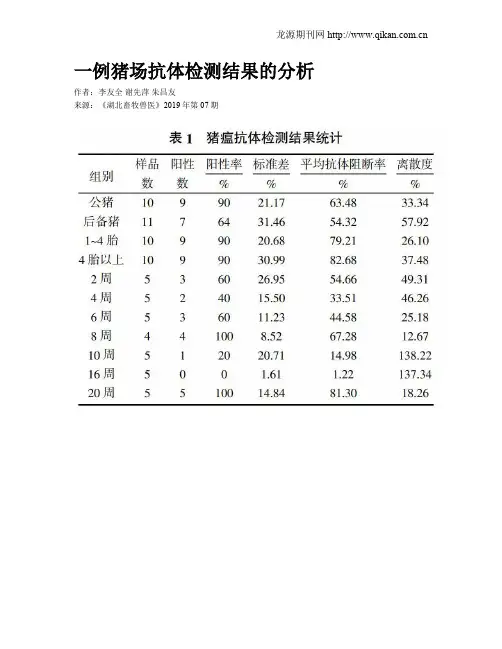
一例猪场抗体检测结果的分析作者:李友全谢先萍朱昌友来源:《湖北畜牧兽医》2019年第07期摘要:通过分析一猪场的抗体检测结果,揭示了其抗体变化的原因和猪场疾病的感染和流行情况,同时对猪场抗体检测和分析的常见问题进行了探讨。
关键词:猪;抗体检测;抗体分析中图分类号:S858.28 ; ; ; ;文献标识码:A ; ; ; ;文章编号:1007-273X(2019)07-0024-02广东某猪场生产成绩不是很理想,例行做了一次猪群的抗体检测,结合临床生产实际和免疫程序进行了抗体分析,现将其报道如下,供参考。
1 ;猪场基本情况该猪场存栏基础母猪400头,后备母猪100头。
生产公母猪每年免疫猪瘟疫苗三次、猪伪狂犬疫苗三次、猪蓝耳病疫苗三次、猪圆环病毒疫苗两次;仔猪和育肥猪分别于1日龄(滴鼻)、60日龄、90日龄三次免疫猪伪狂犬疫苗、14日龄免疫猪蓝耳病疫苗、21日龄免疫猪圆环病毒疫苗、30日龄和55日龄免疫猪瘟疫苗;后备猪于140日龄开始分别免疫猪蓝耳病疫苗、猪伪狂犬疫苗、猪圆环病毒疫苗、猪瘟疫苗(间隔10 d左右)。
生产情况为返情率较高(21%),死胎、弱胎达到15%,保育猪在45日龄左右出现皮毛粗乱,呼吸障碍和关节肿胀等现象,保育猪死亡率达6%。
2 ;抗体检测按照组内随机的原则进行采血送检。
共抽检血清样品75份,其中公猪10份、后备母猪11份、1~4胎母猪10份、4胎以上母猪10份、2、4、6、10、16、20周龄生长育肥猪各5份,8周龄生长育肥猪4份,进行血清抗体ELISA检测。
检测猪瘟、猪蓝耳病、猪伪狂犬病、猪圆环病毒病的抗体水平。
3 ;结果与分析抗体检测结果见表1。
判定标准:猪瘟:阻断率≥40%,判定为阳性;阻断率﹤40%,判定为阴性。
猪伪狂犬:S/N≤0.6,判定为阳性;S/N>0.7,判定为阴性;0.6350,判定为阳性;抗体滴度≤350,判定为阴性。
3.1 ;猪瘟抗体分析猪瘟抗体检测结果见表1。

猪场抗体检测意义、采样及结果分析应在猪场工作及为猪场服务的广大毕业生和朋友的准许,我濶濑再一次就猪场抗体检测的意义,采样注意事项和结果分析进行简要总结,供大家参考。
1、养牛场抗体检测的意义我国的养猪业,经过几十年的发展战略,已经逐步走向了规模化,在这种情况下,如果对养殖场疫病的防控,依然按照以前那种发病后再进行用药治疗的途径,不但会付出较多的外科手术成本,并且治疗效果也好些,因此应该以预防为主,猪场疫病的传染病手段,包括消毒(及时吸附环境中的病原体)、预防性给药和疫苗免疫。
而抗体检测主要是指导和检查免疫核查效果,评判猪场健康状态。
1.1抗体检测可以指导制定科学的免疫程序猪体内的抗体,主要作用是可以与病原反应,保护机体免受病原的危害。
但下让在猪体内抗体非常高的前提下,无论是野毒或者是疫苗进入猪体内,都会与抗体反应,所以在抗体较高的前提下免疫疫苗,不但疫苗无效,而且会导致机体原有抗体旧下降或消失,从而引起免疫失败。
而抗体发展阶段检测可以反应不同阶段绵羊血清中抗体水平,从而选择合适的恰当时间进行疫苗免疫,从而医疗保障疫苗免疫效果。
1.2抗体检测可以评价疫苗免疫效果疫苗免疫是否有效,不能单纯依靠临床是否发病来评价。
有些养牛场并没有进行某种疫苗免疫,也有可能没有发病,所以判定不能直接通过临床未患病就判定免疫有效,更不能直到发病就患病判定无效。
通过不同阶段猪抗体水平,评价胰岛的疫苗是否发挥抑制作用了作用,从而判断疫苗纯度是否合格,免疫日龄是否合适,免疫操作是否得当。
1.3抗体检测可以评判猪体健康状态,为种猪引进把关。
通过抗体检测,可以了解伪狂犬野毒感染情况,蓝耳感染情况,依据从而为种猪引进提供参考参照。
2.抗体检测的密序2.1样品采集在采取猪血清时,有几个注意事项,第五第一是要采取不同阶段猪的血清,这样才可以反应在不同阶段的抗体水平,从而判定抗体衰减规律,确定首免日龄,评价疫苗效果。
第二是各个阶段需要有一定的数量,个别紫菊在采集血样时,为了降低检验成本,盲目减少血样数量,从而导致没有代表性,一般情况下,每个阶段的样本数量可以选择4-6份。

学会看猪场抗体检测报告案例分析猪场一年至少两次采集血样送检,根据血清检测结果再来制定或者调整各场的免疫程序。
下面是一个小型猪场采血送检的结果,附实验室初步分析。
检测报告书送检单位:河北省唐山市**猪场管好你老公,别让他玩这游戏广告委托单位:****生物技术开发公司送检时间:2017年4月6日动物品种:猪样品种类:血清样品份数:65份检测项目:猪瘟、猪蓝耳病、猪伪狂犬gE、猪圆环病毒2型检测费:9750元抗体检测结果统计表动物组群检测项目样品数阳性数可疑数阴性数阳性率抗体平均值离散度仔猪CSFV抗体30 21 ——9 70% 54.81% 47.39% PRRSV抗体30 25 —— 5 83.33% 1.27 56.64%PRV gE抗体30 15 ——15 50% 0.57 ——PCV2抗体30 30 0 0 100% 1.46 23.47%母猪CSFV抗体25 25 ——0 100% 72.46% 20.07%PRRSV抗体25 25 ——0 100% 2.00 50.83%PRV gE抗体25 25 ——0 100% 0.06 ——PCV2抗体25 25 0 0 100% 1.60 9.80%公猪CSFV抗体5 4 —— 1 80% 68.16% 46.63% PRRSV抗体 5 5 ——0 100% 2.20 25.93%PRV gE抗体5 5 ——0 100% 0.06 ——PCV2抗体 5 5 0 0 100% 1.51 10%异常母猪CSFV抗体5 5 ——0 100% 76.27% 18.27% PRRSV抗体 5 5 ——0 100% 3.57 3.20%PRV gE抗体5 5 ——0 100% 0.05 ——PCV2抗体 5 5 0 0 100% 1.70 3.62% 展开剩余89%抗体检测情况动物组群血清编号CSFV PRRSVOD值阻断率% 结果OD值S/P值结果仔猪 1 1.124 16.081 阴性 1.567 2.544 阳性2 0.782 43.376 阳性0.806 1.256 阳性3 0.325 79.848 阳性0.861 1.349 阳性4 0.103 97.566 阳性0.582 0.876 阳性5 0.149 93.895 阳性0.563 0.844 阳性6 0.768 44.493 阳性 1.02 1.618 阳性7 0.327 79.689 阳性 1.455 2.355 阳性8 0.59 58.699 阳性 1.162 1.859 阳性9 0.237 86.872 阳性 1.081 1.721 阳性10 0.84 38.747 阴性 1.189 1.904 阳性11 0.098 97.965 阳性0.204 0.236 阴性12 0.731 47.446 阳性0.266 0.341 阴性13 0.511 65.004 阳性0.359 0.499 阳性14 0.525 63.887 阳性 1.039 1.650 阳性15 0.735 47.127 阳性0.359 0.499 阳性16 1.167 12.650 阴性0.239 0.296 阴性17 1.017 24.621 阴性0.216 0.257 阴性18 1.024 24.062 阴性0.381 0.536 阳性19 0.59 58.699 阳性0.193 0.218 阴性20 1.133 15.363 阴性 1.013 1.606 阳性21 0.505 65.483 阳性 1.241 1.992 阳性22 0.755 45.531 阳性 1.393 2.250 阳性23 0.605 57.502 阳性 1.101 1.755 阳性24 0.89 34.757 阴性 1.333 2.148 阳性25 0.952 29.808 阴性0.517 0.766 阳性26 0.753 45.690 阳性0.405 0.577 阳性27 0.952 29.808 阴性0.744 1.151 阳性28 0.413 72.825 阳性 1.111 1.772 阳性29 0.507 65.323 阳性 1.12 1.787 阳性30 0.054 101.476 阳性0.913 1.437 阳性母猪31 0.57 60.295 阳性0.426 0.612 阳性32 0.593 58.460 阳性0.468 0.683 阳性33 0.181 91.341 阳性 2.076 3.406 阳性34 0.537 62.929 阳性 2.083 3.418 阳性35 0.164 92.698 阳性 1.503 2.436 阳性36 0.207 89.266 阳性 1.805 2.948 阳性37 0.528 63.647 阳性 1.751 2.856 阳性38 0.07 100.200 阳性 1.369 2.209 阳性39 0.28 83.440 阳性0.864 1.354 阳性40 0.406 73.384 阳性 1.451 2.348 阳性41 0.246 86.153 阳性0.904 1.422 阳性42 0.619 56.385 阳性0.376 0.528 阳性43 0.392 74.501 阳性0.389 0.550 阳性44 0.718 48.484 阳性0.577 0.868 阳性45 0.42 72.267 阳性0.454 0.660 阳性46 0.473 68.037 阳性0.795 1.237 阳性47 0.531 63.408 阳性 1.532 2.485 阳性48 0.622 56.145 阳性 2.174 3.572 阳性49 0.114 96.688 阳性 1.296 2.086 阳性50 0.37 76.257 阳性0.606 0.917 阳性51 0.618 56.464 阳性 1.541 2.500 阳性52 0.349 77.933 阳性 1.825 2.981 阳性53 0.517 64.525 阳性 1.774 2.895 阳性54 0.313 80.806 阳性 1.428 2.309 阳性55 0.6 57.901 阳性 1.625 2.643 阳性公猪56 0.153 93.575 阳性 1.836 3.000 阳性57 0.404 73.543 阳性 1.466 2.373 阳性58 0.349 77.933 阳性 1.046 1.662 阳性59 1.164 12.889 阴性 1.027 1.630 阳性60 0.287 82.881 阳性 1.429 2.311 阳性异常母猪61 0.48 67.478 阳性 2.144 3.522 阳性62 0.244 86.313 阳性 2.069 3.395 阳性63 0.434 71.149 阳性 2.231 3.669 阳性64 0.135 95.012 阳性 2.226 3.660 阳性65 0.556 61.413 阳性 2.191 3.601 阳性动物组群血清编号PRV gE PCV2OD值S/N值结果OD值 S/P值结果仔猪 1 0.51 0.340 阳性 1.96 1.527 阳性2 0.131 0.087 阳性 2.199 1.719 阳性3 0.179 0.119 阳性 1.8 1.399 阳性4 0.21 0.140 阳性 1.224 0.938 阳性5 0.21 0.140 阳性 2.001 1.560 阳性6 1.38 0.921 阴性 2.019 1.575 阳性7 1.335 0.891 阴性 2.007 1.565 阳性8 1.596 1.065 阴性 2.129 1.663 阳性9 1.683 1.123 阴性 2.036 1.588 阳性10 1.707 1.139 阴性 2.21 1.727 阳性11 0.125 0.083 阳性 2.038 1.590 阳性12 0.103 0.069 阳性 1.913 1.490 阳性13 0.265 0.177 阳性 2.044 1.595 阳性14 0.264 0.176 阳性 2.214 1.731 阳性15 0.266 0.178 阳性 1.913 1.490 阳性16 0.249 0.166 阳性 1.074 0.818 阳性17 0.22 0.147 阳性 2.102 1.641 阳性18 0.199 0.133 阳性 2.112 1.649 阳性19 1.041 0.695 阴性 2.145 1.675 阳性20 0.853 0.569 阳性 2.123 1.658 阳性21 1.777 1.186 阴性 1.498 1.158 阳性22 1.744 1.164 阴性0.732 0.545 阳性23 1.647 1.099 阴性 1.593 1.234 阳性24 0.7 0.467 阳性 1.063 0.810 阳性25 1.241 0.828 阴性0.699 0.518 阳性26 1.423 0.950 阴性 1.552 1.201 阳性27 1.558 1.040 阴性0.826 0.620 阳性28 0.954 0.637 阴性 1.463 1.130 阳性29 0.913 0.609 阴性0.839 0.630 阳性30 1.246 0.831 阴性0.636 0.468 阳性母猪31 0.132 0.088 阳性 2.032 1.585 阳性32 0.067 0.045 阳性 2.283 1.786 阳性33 0.157 0.105 阳性 2.206 1.724 阳性34 0.088 0.059 阳性 2.229 1.743 阳性35 0.077 0.051 阳性 2.139 1.671 阳性36 0.095 0.063 阳性 2.263 1.770 阳性37 0.08 0.053 阳性 2.201 1.720 阳性38 0.075 0.050 阳性 2.21 1.727 阳性39 0.105 0.070 阳性 2.286 1.788 阳性40 0.063 0.042 阳性 2.216 1.732 阳性41 0.071 0.047 阳性 1.98 1.543 阳性42 0.197 0.131 阳性 2.163 1.690 阳性43 0.08 0.053 阳性 2.022 1.577 阳性44 0.129 0.086 阳性 1.57 1.215 阳性45 0.078 0.052 阳性 2.03 1.583 阳性46 0.082 0.055 阳性 1.884 1.467 阳性47 0.088 0.059 阳性 2.128 1.662 阳性48 0.089 0.059 阳性 2.09 1.631 阳性49 0.056 0.037 阳性 2.157 1.685 阳性50 0.075 0.050 阳性 2.059 1.607 阳性51 0.086 0.057 阳性 1.586 1.228 阳性52 0.135 0.090 阳性 1.892 1.473 阳性53 0.102 0.068 阳性 1.855 1.443 阳性54 0.107 0.071 阳性 1.868 1.454 阳性55 0.071 0.047 阳性 1.918 1.494 阳性公猪56 0.12 0.080 阳性 1.948 1.518 阳性57 0.063 0.042 阳性 2.017 1.573 阳性58 0.073 0.049 阳性 1.619 1.255 阳性59 0.067 0.045 阳性 2.099 1.639 阳性60 0.094 0.063 阳性 2.034 1.587 阳性异常母猪61 0.068 0.045 阳性 2.258 1.766 阳性62 0.075 0.050 阳性 2.088 1.630 阳性63 0.073 0.049 阳性 2.261 1.768 阳性64 0.12 0.080 阳性 2.171 1.696 阳性65 0.061 0.041 阳性 2.129 1.663 阳性判定标准CSFV(猪瘟):阻断率≥40%为阳性;阻断率<40%为阴性。
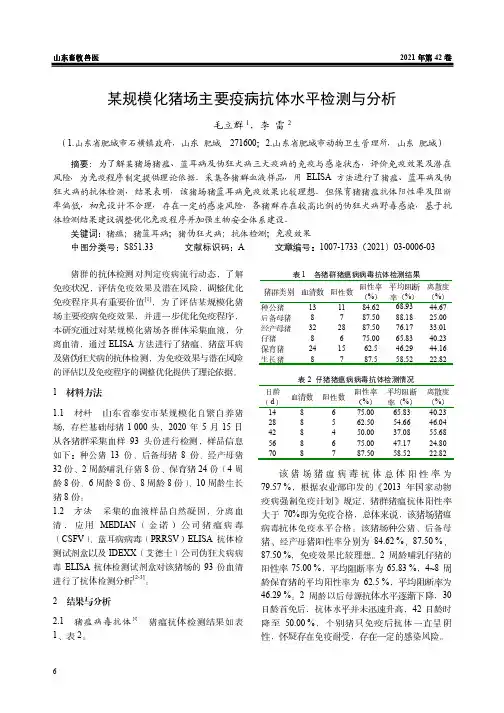
山东畜牧兽医2021年第42卷6某规模化猪场主要疫病抗体水平检测与分析毛立群1,李雷2(1.山东省肥城市石横镇政府,山东肥城271600;2.山东省肥城市动物卫生管理所,山东肥城)摘要:为了解某猪场猪瘟、蓝耳病及伪狂犬病三大疫病的免疫与感染状态,评价免疫效果及潜在风险,为免疫程序制定提供理论依据。
采集各猪群血液样品,用ELISA方法进行了猪瘟、蓝耳病及伪狂犬病的抗体检测,结果表明,该猪场猪蓝耳病免疫效果比较理想。
但保育猪猪瘟抗体阳性率及阻断率偏低,初免设计不合理,存在一定的感染风险,各猪群存在较高比例的伪狂犬病野毒感染,基于抗体检测结果建议调整优化免疫程序并加强生物安全体系建设。
关键词:猪瘟;猪蓝耳病;猪伪狂犬病;抗体检测;免疫效果中图分类号:S851.33 文献标识码:A 文章编号:1007-1733(2021)03-0006-03猪群的抗体检测对判定疫病流行动态,了解免疫状况,评估免疫效果及潜在风险,调整优化免疫程序具有重要价值[1],为了评估某规模化猪场主要疫病免疫效果,并进一步优化免疫程序,本研究通过对某规模化猪场各群体采集血液,分离血清,通过ELISA方法进行了猪瘟、猪蓝耳病及猪伪狂犬病的抗体检测,为免疫效果与潜在风险的评估以及免疫程序的调整优化提供了理论依据。
1 材料方法1.1 材料山东省泰安市某规模化自繁自养猪场,存栏基础母猪1 000头,2020年5月15日从各猪群采集血样93头份进行检测,样品信息如下:种公猪13份、后备母猪8份、经产母猪32份、2周龄哺乳仔猪8份、保育猪24份(4周龄8份、6周龄8份、8周龄8份)、10周龄生长猪8份。
1.2 方法 采集的血液样品自然凝固,分离血清,应用MEDIAN(金诺)公司猪瘟病毒(CSFV)、蓝耳病病毒(PRRSV)ELISA抗体检测试剂盒以及IDEXX(艾德士)公司伪狂犬病病毒ELISA抗体检测试剂盒对该猪场的93份血清进行了抗体检测分析[2-3]。

规模化猪场抗体检测报告分析黄全勇 林文耀/金宇保灵生物药品有限公司 010030 余锋 周细练 刘劲超 曹登博/江西省南昌市智弘牧业有限公司 330000摘 要:为科学制定免疫程序,了解猪场内整体健康状态和重大疾病的免疫水平,本研究应用酶联免疫吸附试验(ELISA)对某规模化猪场采集的份血清进行了口蹄疫(FMD)、猪瘟(CSF)、伪狂犬(PR)和蓝耳病(PRRS)的抗体检测与分析,结果表明该场猪瘟、口蹄疫抗体水平良好、伪狂犬病毒呈阴性、蓝耳病比较活跃需要额外注意。
关键词:猪场;猪病;抗体检测;抗体分析;疾病是制约现代化养猪业的重大因素之一,特别是口蹄疫、猪瘟、伪狂犬和蓝耳病等烈性传染病,给养殖业带来了严重的困扰。
近年来,随着非洲猪瘟在中国的蔓延以及多方面的原因,中国的生猪产业面临着严峻考验。
在防治疾病方面,免疫预防依然是猪场最常用的方式。
影响免疫效果的因素有很多,而血清学抗体检测就是检验猪场免疫效果的重要手段。
通过血清学抗体检测可以实时监测群体免疫状况,了解猪群免疫水平,及时发现问题及潜在风险,从而能够更好地指导猪场制定科学的疫病防控计划。
本文对某规模化猪场进行了口蹄疫、猪瘟、伪狂犬以及蓝耳病的血清学抗体检测,现将结果和数据统计如下。
1 材料方法1.1 猪场背景 该猪场现存栏母猪1000头,采取一点式饲养模式,自繁自养,全进全出。
仔猪21d断奶,70日龄转入育肥舍,保育猪后期出现猪群掉队不好养现象。
1.2 疫苗免疫程序 猪场口蹄疫使用的是猪口蹄疫O、A 二价灭活疫苗(金OA)、猪瘟使用猪瘟活疫苗(传代细胞源)、伪狂犬使用猪伪狂犬病耐热保护剂活疫苗(C株)、蓝耳病使用猪繁殖与呼吸综合征灭活疫苗(NVDC-JXA1株)。
猪瘟免疫程序:母猪、公猪3次/年;后备猪15周首免,24周二免;仔猪4周首免,8周二免,免疫剂量均为1头份/次。
口蹄疫免疫程序:母猪、公猪3次/年;后备猪配种前30d 加免一次;仔猪8周首免,12周二免,免疫剂量均为1头份/次。

78猪业科学 SWINE INDUSTRY SCIENCE 2017年34卷第06期猪场兽医VETERINARY一例规模化猪场的抗体检测报告分析宁明刚1,李富金1,李相钊1,任显东2(1.齐鲁动物保健品有限公司,山东 济南 250100;2.辽宁锦州市疫控中心,辽宁 锦州 121004)猪瘟、猪伪狂犬病、猪蓝耳病(PRRS)三大病毒性疾病一直困扰着养殖场朋友,都可以不同程度的导致母猪繁殖障碍问题,对养殖业造成巨大损失,目前多数检测机构采用美国IDEXX 抗体检测试剂盒对疫苗的免疫效果进行评估。
血清学的检测手段在疫苗的免疫效果评估及其猪病诊断过程中起到越来越重要的作用,本文通过一例规模化猪场的抗体检测报告为例展开分析讨论,以供广大养殖户朋友参考借鉴。
1 基本情况与抗体检测结果某规模化猪场,母猪存栏700头,猪场目前稳定(猪瘟传代细胞苗普免3次/年、猪伪狂犬Bartha-k61毒株疫苗普免3次/年、猪蓝耳病疫苗没有免疫)。
检测血样来自母猪的4个不同生产阶段,共30份。
通过对母猪的猪瘟、猪伪狂犬病疫苗免疫效果做个抗体评估,以表1 抗体检测结果注:(1)猪瘟:阻断率≥40%抗体阳性;<30%为阴性;30%≤阻断率<40%判为可疑。
(2)猪蓝耳:S/P <0.40抗体阴性,S/P ≥0.40抗体阳性。
(3)伪狂犬gB 抗体:S/N ≤0.60抗体阳性,S/N >0.70抗体阴性,0.60<S/N ≤0.70可疑。
(4)伪狂犬gE 抗体:S/N ≤0.60抗体阳性,S/N >0.70抗体阴性,0.60<S/N ≤0.70可疑。
表2 猪瘟抗体数据处理结果表3 伪狂犬抗体数据处理结果样本数阳性数阴性数可疑平均值/%阳性率/%变异系数/%后备母猪6420486750怀孕前期88007210014产房母猪8710568832空怀母猪8611637534样本数gB 抗体合格率/%变异系数/%gE 抗体阳性率/%变异系数/%后备母猪6100261740怀孕前期810023 6388产房母猪810023 10061空怀母猪81002475134图1 猪瘟抗体数据结果分析图2 猪伪狂犬抗体数据结果分析基金项目:山东省生猪产业技术体系创新团队项目(SDAIT-08-20)作者简介:宁明刚(1985-),男,山东济南人,硕士研究生,从事猪场技术服务工作。


China Swine Industry2019年第4期收稿日期:2019-02-19作者简介:姜杰(1981-),男,河南周口人,兽医师,执业兽医师,主要从事规模化猪场生产管理及猪场疫病的实验室诊断分析,E-mail:410867461@猪场疫病的抗体检测与结果分析姜杰徐倩(河南省黄泛区鑫欣牧业股份有限公司,河南周口466000)摘要:猪病的复杂程度在提高,诊断难度在加大,需要借助实验室检测来提高诊断的准确性和科学性。
不少猪场即使在发病后,开展了实验室检测,也没有科学分析检测结果并用于指导生产实践。
以河南省周口市黄泛区农场鑫欣牧业猪场猪瘟病毒、伪狂犬病病毒gB 蛋白、蓝耳病病毒、口蹄疫病毒免疫抗体的检测为例,通过分析检测结果并提出针对性的防控方案,为猪场诊断疾病,并为实验室检测结果指导生产提供思路和借鉴。
关键词:猪场疫病;抗体检测;猪瘟中图分类号:S852.65+1文献标识码:A文章编号:1673-4645(2019)04-0041-03当前猪病愈来愈复杂,靠传统人工剖检、眼观诊断的方法已不合时宜,猪病诊断也需要借助现代科学方法和实验室的准确检测来完成。
对于处在疾病潜伏期或发病阶段的猪群进行科学有效的实验室检测尤为关键,分析检测结果并用于指导生产更为重要。
猪场发病往往不是单一疾病造成的,通常是几种疾病混合感染引起的,这就需要找出关键致病因素进行治疗。
一般细菌性疾病发病严重的诱因是病毒性疾病,猪瘟、伪狂犬病、蓝耳病、口蹄疫等是猪场重点防控的病毒性疾病。
检测发病猪群,如检出细菌性疾病,则需要根据药敏试验,采用针对性药物进行防控;如检出病毒性疾病,如猪瘟野毒感染,则应考虑猪场处在猪瘟发病阶段,并确定感染时间,注意在对同批次猪补打猪瘟疫苗的同时,做好下一批猪的提前免疫,预防该病再次发生。
1猪群检测试验于2017年5月至2018年5月在河南省周口市黄泛区农场鑫欣牧业猪场进行,本场存栏母猪10000头,年出栏育肥猪300000头,猪群整体健康。

河北某规模化猪场蓝耳病抗原抗体检测报告分析河北某规模化猪场蓝耳病抗原抗体检测报告分析近年来,河北省的养殖业得到了快速发展,规模化猪场成为该省农业经济的重要组成部分。
然而,在猪场的日常生产中,疾病的防控是一个重要的课题。
蓝耳病是猪场常见的病害之一,对猪群的养殖和经济利益造成了严重影响。
本文将对河北某规模化猪场的蓝耳病抗原抗体检测报告进行分析,以期为该猪场提供科学的防控措施。
根据报告显示,该猪场选择了特定的抗原和抗体检测方法,采用了酶联免疫吸附试验(ELISA)进行检测。
ELISA是一种常用的病原体检测方法,通过测定抗原与抗体的特异性结合反应,判断猪群是否感染了蓝耳病。
该猪场在定期进行检测和监测的基础上,对发现的疑似感染猪只进行了有针对性的检测,确保了抗原抗体检测的准确性和可靠性。
从该猪场的抗原抗体检测报告中可以看出,蓝耳病的潜在风险在该猪场内是存在的。
报告显示,在检测的样本中,有一部分猪只的抗原和抗体结果为阳性,表明这些猪只曾经感染过蓝耳病或者目前正在受到感染。
这说明该猪场仍然存在蓝耳病的传播和感染风险。
进一步分析报告显示,阳性样本主要集中在猪场的特定区域和特定年龄段的猪只中。
具体来说,青年猪仔群中的阳性率较高,而成年猪和妊娠母猪中的阳性率相对较低。
这说明蓝耳病在不同年龄段的猪只中有着不同的感染特征,年龄是影响猪群感染风险的重要因素。
进一步的分析还显示,阳性样本主要集中在该猪场的特定区域,说明蓝耳病在该猪场的疫情存在一定的地域性。
这可能与猪场内的环境因素、卫生管理与控制措施有关。
猪场管理者需要进一步加强对猪舍的清洁消毒工作,加强对猪群的健康管理,以减少蓝耳病的传播和感染风险。
据报告显示,该猪场已经采取了一些措施来控制蓝耳病的传播和感染。
首先,猪场严格控制了外来动物和人员的进出,减少了病原体的传播途径。
其次,猪场加强了猪只的健康检测和疫苗接种工作,提高了猪群的免疫力。
然而,从阳性样本的检测结果可以看出,这些措施还需要进一步完善和加强,以达到更好的预防和控制效果。

三分钟帮您看懂抗体检测报告——猪瘟篇各位猪友在看完前几期中牧生物平台推送的内容后,是否对猪场防疫与疫苗使用有了更全面的认识呢?小编我是获益匪浅。
那么各位猪友在因地制宜地采用综合性的管控措施之后,又是否对即将获得的收益多了一份期待?等等……先别着急。
在无限的期许当中,由提升生产管理所带来的滚滚财源,是否真的能化虚为实?进一步的说,如何检验我们在猪场防疫方面所取得的成果呢?科学准确的抗体检测报告给您答案!最近几年,一些有条件的养殖场已经定期开展抗体检测工作。
那么在投入大量人力、物力后拿到手的抗体检测报告,您是否真的读的懂呢?本期中牧生物的专题,小编就与您一起来探究抗体检测报告里的门道。
目前,市场上最为常见的抗体检测报告主要有:猪瘟,蓝耳病,伪狂犬,口蹄疫,乙脑,细小,圆环等。
本次我们就选取公认的猪瘟阻断Elisa检测方式,以猪瘟抗体检测的金标准IDEXX检测试剂盒为例。
首先,从原理出发,通过一张图来看看猪瘟抗体检测。
上图所示的阻断法检测猪瘟疫苗抗体的原理,可以简单的概括为:第3步中加入的酶标记物(抗猪瘟病毒的单克隆抗体),与被检血清中的抗猪瘟病毒抗体,两者竞争与包被抗原结合。
而第2步加入的被检血清中如果大量含有抗猪瘟病毒抗体,就会阻断酶标物抗体与包被抗原的结合。
最后加入底物显色。
被检血清中猪瘟病毒抗体越多,阻断率越高,颜色越浅。
猪瘟疫苗的免疫评估一般关注两点:1.阳性率:猪瘟抗体(阻断率(Blocking)≥40%,判为阳性结果;30%<Blocking<40%,判为可疑结果;Blocking≤30%,判为阴性结果)。
免疫合格率:阻断率(Blocking)≥50%的,即为免疫合格(断奶仔猪猪瘟第一次免疫受母源抗体干扰,≥30%可视为合格)。
免疫合格的比例即为免疫合格率。
2.变异系数:Coefficient of Variation(CV)变异系数计算的是平均个体的变化,以平均滴度背离的百分数来表示公式如下:变异系数 CV = 标准偏差(STDEV)/平均阻断率×100%CV≤40%,显示了群内猪只有一个均衡的、相似反应。
养猪场抗体检测结果分析及处理意见目前猪瘟和蓝耳病是影响临床养猪生产的两大重要传染病,给养殖户带来了惨痛的经济损失。
针对某猪场不断发生母猪繁殖障碍的现状,我们实验室制定了相应的抗体检测方案,并根据检测结果提出了相应处理意见,真正意义上指导了生产实践,得到养殖户的一致好评,现将具体内容阐述如下:一、免疫背景:该猪场免疫过猪瘟和蓝耳的疫苗,种猪每年免疫两次,母猪在每次配种前加强免疫一次,但仍然不断有母猪发生流产、早产、死胎弱胎、木乃伊胎等情况。
二、采血方案:该猪场有怀孕母猪400头,哺乳母猪100头,公猪6头。
结合猪场实际规模,我们建议采样怀孕母猪20头、哺乳母猪10头、公猪全采。
保证随机采样,采血尽量避免污染,做好标记,样品装入放有冰袋的保温盒及时送至实验室检验。
三、检测结果与分析:1、猪瘟抗体检测结果与分析猪类别阳性阴性合格阳性率阴性率合格率阻断率平均值离散度怀孕母猪19头1头16头95%5%80%6232哺乳母猪 7头3头7头 70% 30% 70% 67 42公猪 5头 1头 5头 83% 17% 83% 6939对猪瘟有完全抵抗力的猪场要求抗体检测阳性率100%,免疫合格率90%,免疫普通细胞苗要求阻断率平均值在68-78之间,样本离散度在20-25之间。
检测结果显示该猪场猪只抗体水平参差不齐,猪瘟疫苗免疫效果差,提示所采用猪瘟疫苗免疫效果差。
2、蓝耳抗体检测结果与分析猪类别合格阴性可疑发病合格率阴性率发病率S/P平均值离散度怀孕母猪 18头1头1头90%5%5%1.737哺乳母猪 3头3头4头30% 30% 40% 1.7 76公猪 2头0头 4头 33% 0 67% 2.4 73蓝耳免疫良好的猪场S/P通常为0.7-0.8,有些可能大于2.0,很少大于2.5。
大于2.5提示有蓝耳病毒感染呈病毒血症,大于3.5提示有蓝耳病毒急性感染。
S/P平均值在0.7-2.0之间,样本离散度在20-25之间。
猪群保健H E A L T H87 2013年 第9期 SWINE INDUSTRY SCIENCE 猪业科学少仔猪断奶后多系统衰竭综合征、皮炎肾病综合征的发生率,增加日增重以及商品猪的整齐度。
2.1 选好疫苗并制定合理的免疫程序目前,市场上国内外商品化的猪圆环病毒疫苗逐渐增多。
圆环病毒疫苗效果主要取决于抗原和佐剂。
国外圆环病毒疫苗抗原毒株都是PCV2a,其中,梅里亚是全病毒灭活苗,而勃林格、英特威等是基因工程亚单位苗,辉瑞和富道是PCV1-PCV2基因嵌合苗;在佐剂方面,除了梅里亚是油佐剂外,其他产品都为水质佐剂。
而国内商品化的圆环病毒疫苗毒株都是国内分离株(ZJ/C、LG、SH 等),其中以PCV2b 的ZJ/C 株采用兼有水质佐剂和油性佐剂优势的水性佐剂,免疫机体后具有应激小,抗体产生快、维持时间长,从而保证仔猪一次免疫即可抵抗野毒感染。
猪圆环病毒疫苗的免疫程序大体可以分为2类,即母猪免疫和仔猪免疫。
母猪:母猪免疫能够为出生仔猪提供母源抗体保护,保护效果取决于母源抗体的高低。
若猪场内母猪出现由于圆环病毒病所致的流产和死胎,那么应首先考虑母猪免疫圆环病毒疫苗。
经产母猪产前1个月免疫一次,2 mL/头;后备母猪在配种前做2次基础免疫,间隔3周,产前1个月加强免疫一次,2 mL/头。
仔猪:仔猪免疫则可保证每头仔猪获得同等免疫剂量,最大限度地保障免疫的均匀度。
仔猪免疫时间一般在14日龄。
2.2 做好相关配套的防控措施改变和完善饲养方式,做到猪群各个阶段的全进全出;加强饲料原料的控制,防止饲料霉变;饲料中添加免疫调节剂(如黄芪多糖等),增强机体免疫力;减少应激,控制副猪嗜血杆菌和猪链球菌的继发感染等。
参考文献[1] 于周,李俊,程凯慧,等.猪圆环病毒2型毒株的分离鉴定[J].中国兽医杂志,2009,45(1):19-20.[2] 秦云,林燕清,赵永旭,等.2001—2012年国内主要PCV2流行基因型演变趋势[J].猪业科学,2013,3:86-88.(收稿日期:2013-08-02)某大型猪场母猪群主要猪病的抗体、抗原检测结果分析报告李树东1,2,李晓娟1,王 静1,2,范学伟1,2,王宏刚1,2(1.黑龙江农业经济职业学院养殖系,黑龙江 牡丹江 157041;2.牡丹江浩博动物保健科技服务中心,黑龙江 牡丹江 157000)1 材料和方法1.1 血清样品的采集及处理通过前腔静脉采集各阶段母猪血液, 4 000 r/min 离心5 min,吸取血清, -20 ℃冻存送检。
2021年第3期(总第284期) 卫生检疫332020年1-8月份猪场临床样品检测结果分析与防控建议李相钊1,张 广1,高 凤1,陈方园2*(1.齐鲁动物保健品有限公司,山东 济南 250100;2.碧迪医疗器械(上海)有限公司) 中图分类号:S851.34+7 文献标识码:C 文章编号:1007-1733(2021)03-0033-03 2020年1-8月份齐鲁动物保健品有限公司合作第三方检测实验室抗原、抗体检测结果显示,疫病整体相对平稳,但在蓝耳病、德尔塔病毒、猪流行流行腹泻、伪狂犬、圆环病毒的防控还是存在很多问题,要在重视生物安全的前提下,强化动物重大疫病的监控,消灭隐患。
1 材料与方法 1.1 样品来源及分布血清来源:全国15个省市,5217份样品,127个猪场,发病群体样品、正常监测样品,由齐鲁动保公司收集。
病料来源:样品来源全国6个省市,52个猪场,199份病料(具体见表1、表3)。
1.2 方法 抗原检测采用齐鲁动物保健品有限公司全国合作的第三方实验室自建方法,荧光定量PCR/PCR/RT-PCR 方法检测。
猪瘟抗体、伪狂犬抗体、蓝耳抗体采用美国IDEXX ELISA 抗体检测试剂盒,流行性腹泻采用韩国安捷ELISA 抗体检测试剂盒,而圆环采用瑞普/科前ELISA 抗体检测试剂盒,圆环IgM 抗体检测试剂盒为自建方法,均按照说明书操作及标准判定。
2 结果与分析2.1 送检样品来源地分析 送检样品以山东为最多,主要因为齐鲁动物保健有限公司所在地为山东;其他各个省份送检的猪场数量相差不大,样品分布的广度足以代表中国猪场主要疾病流行动态。
2.2 送检样品猪场规模分析 从送检样品的猪场规模看,以1~100头基础母猪的猪场为最多,100~500头基础母猪次之,500~1 000头基础母猪第三,1 000~2 000头基础母猪第四,≥2 000头基础母猪第五,基本呈现养殖规模越大,送检样品数量就越少的规律。