
基因工程实验报告
姓名:杜琳颖学号:2017051141 学院:生命科学院专业:生化与分子一、实验目的
学习并掌握从目的基因克隆到蛋白质表达的实验流程及原理。
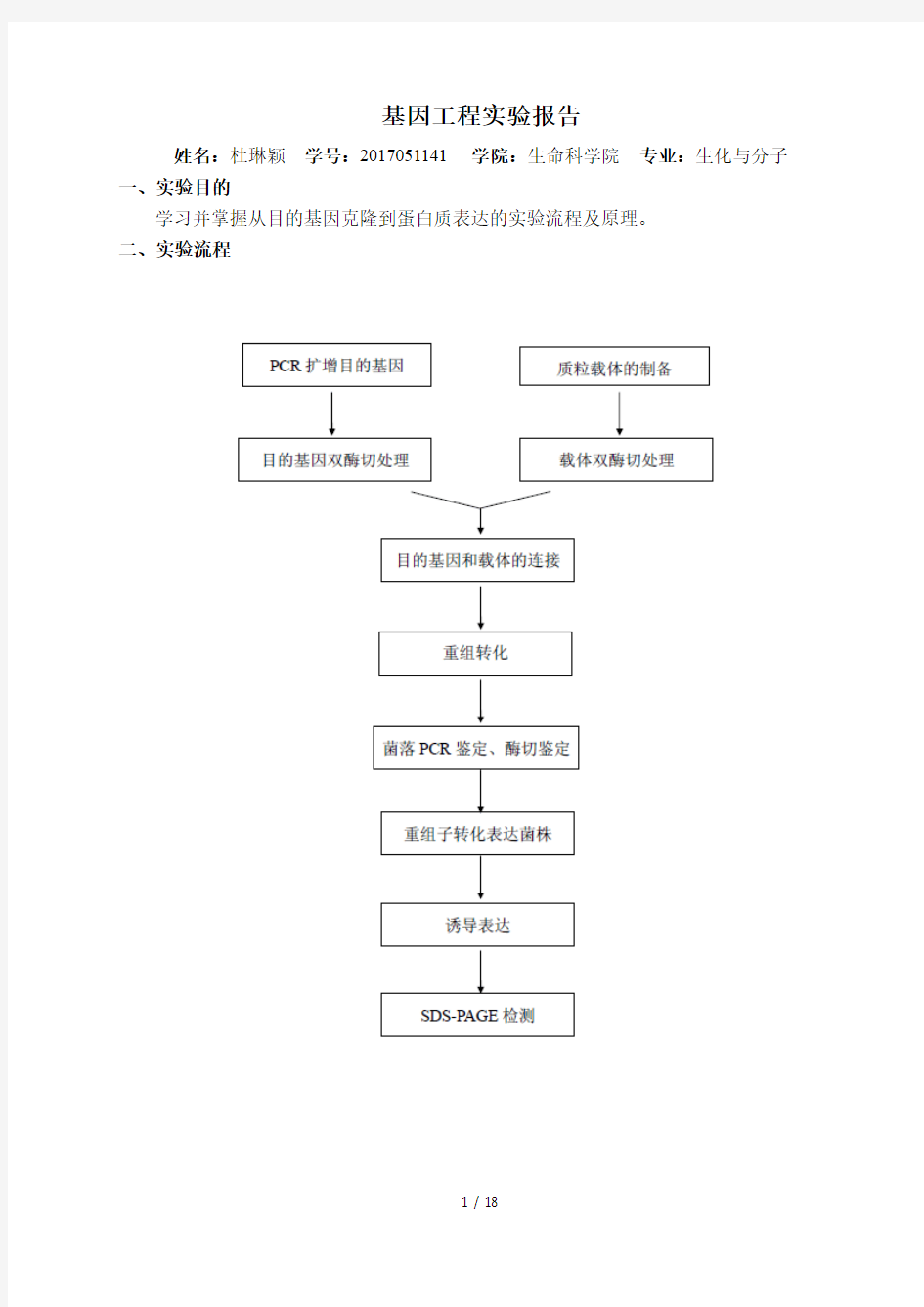
二、实验流程
实验一、质粒提取载体DNA提取及酶切鉴定
一、实验目的
学习质粒的酶切及电泳分析。
二、实验原理
质粒是一种染色体外的稳定遗传因子,具有双链闭环结构的DNA 分子。它具有自主复制能力,能使子代细胞保持它们恒定的拷贝数,可表达它携带的遗传信息。目前,经人工改造的质粒已广泛用作基因工程中目的基因的运载工具——载体。
质粒DNA 的提取是依据质粒DNA 分子较染色体DNA 分子小,且具有超螺旋共价闭合环状的特点,从而将质粒DNA 与大肠杆菌染色体DNA 分离。现在常用的方法有:碱裂解法、密度梯度离心法、煮沸裂解法等。实验室普遍采用的碱裂解法具有操作简便、快速、得率高的优点。其主要原理:利用染色体DNA 与质粒DNA 的变性与复性的差异而达到分离的目的。在碱变性条件下,染色体DNA 的氢键断裂,双螺旋解开而变性,质粒DNA 氢键也大部分断裂,双螺旋也有部分解开,但共价闭合环状结构的两条互补链不会完全分离,当pH=4.8 的乙酸钠将其pH 调到中性时,变性的质粒DNA 又恢复到原来的构型,而染色体DNA 不能复性,形成缠绕的致密网状结构,离心后,由于浮力密度不同,染色体DNA 与大分子RNA、蛋白质-SDS 复合物等一起沉淀下来而被除去。
限制性内切酶可以识别双链DNA 特定位点,并产生特异的切割,形成粘性末端或平末端,这样有利于DNA 片段再连接。限制性内切酶对环状质粒DNA 有多少切点,酶切后就能产生多少个片段。因此,鉴定酶切后的片段在电泳凝胶的区带数,就可以推断切点的数目;从片段迁移率的大小可以判断酶切片段大小的差别。用已知相对分子量DNA 为对照,通过电泳迁移率的比较,可以粗略地测出分子形状相同的未知DNA 的相对分子质量。
三、实验材料、仪器及试剂
(一)实验材料
含载体质粒pET28a的大肠杆菌
(二)试剂
1、LB 液体培养基
2、质粒提取试剂盒(天根生物科技)
3、TBE 缓冲液
4、点样缓冲液Loading buffer(10×)
5、琼脂糖
6、NcoⅠ酶,XhoⅠ酶(Takara)
7、DNA回收纯化试剂盒(天根生物科技)
(三)仪器
1、Eppendorf 管、离心管架
2、10,50,200,1000 μL 微量加样器
3、Eppendorf台式高速离心机
4、电泳仪系统
5、恒温水浴箱
6、凝胶成像仪
7、摇床等
四、实验步骤
(一)质粒提取
1、柱平衡步骤:向吸附柱CP3 中(吸附柱放入收集管中)加入500μL 的平衡液BL,12,000rpm离心1min,倒掉收集管中的废液,将吸附柱重新放回收集管中。
2、取1.5 mL 过夜培养的菌液(已备好),加入1.5mL离心管中,使用12,000rpm离心1min,尽量吸除上清,再收集一次菌体(根据浓度选择)。
3、向留有菌体沉淀的离心管中加入250μL 溶液P1(请先检查是否已加入RNaseA),使用移液器或涡旋振荡器彻底悬浮细菌沉淀。
4、向离心管中加入250μL 溶液P2,温和地上下翻转6-8 次使菌体充分裂解。
5、向离心管中加入350μL 溶液P3,立即温和地上下翻转6-8 次,充分混匀,此时将出现白色絮状沉淀。12,000rpm离心10min,此时在离心管底部形成沉淀。
6、将上一步收集的上清液用移液器转移到吸附柱CP3 中(吸附柱放入收集管中),注意尽量不要吸出沉淀。12,000rpm离心1min,倒掉收集管中的废液,将吸附柱CP3 放入收集管中。
7、向吸附柱CP3 中加入600μL 漂洗液PW(请先检查是否已加入无水乙醇),12,000rpm离心30-60sec,倒掉收集管中的废液,将吸附柱CP3 放入收集管中。重复漂洗一次。
8、将吸附柱CP3 放入收集管中,12,000rpm离心2min,目的是将吸附柱中残余的漂洗液去除。
9、将吸附柱CP3 置于一个干净的离心管中,向吸附膜的中间部位滴加50μL 洗脱缓冲液EB,室温放置2 min,12,000rpm离心2min 将质粒溶液收集到离心管中。
(二)琼脂糖凝胶电泳法检测提取的质粒DNA
吸取4μL所提质粒,加入2μL loading buffer 混匀后点样至0.8%琼脂糖凝胶中,电泳20min左右后拿出放入凝胶成像系统,根据图像判断所提质粒浓度及质量。
(三)质粒载体DNA 酶切
1、按下表将各种试剂分别加入每个Eppendorf 管中。
2、加样后混匀,置于37℃水浴中,保温5 h。
3、吸出8μL酶切产物,加入2μL loading buffer 混匀后点样琼脂糖凝胶电泳,鉴定
酶切是否正确,两个酶切位点之间片段大约150bp左右,理论上双酶切电泳应出现两条带,一条较亮的长片段和一条很暗的小片段。而单酶切只出现一条带,即线性化载体。同时应点样质粒作为阳性对照。
4、确认酶切正确后,在酶切产物中加入loading buffer 终止反应,准备胶回收。
(四)载体片段的获得
1、取酶切产物经琼脂糖凝胶电泳检测确认酶切完全后,然后进行载体片段的回收。
2、制备胶回收的琼脂糖凝胶。
3、将双酶切样品加入点样空中,进行电泳分离。
4、将凝胶板染色后,在凝胶成像仪中切取DNA 大片段。
5、柱平衡步骤:向吸附柱CB2 中加入500μL 平衡液BL,12,000rpm离心1 min,倒
掉收集管中的废液,将吸附柱重新放回收集管中。
6、将单一的目的DNA 条带从琼脂糖凝胶中切下放入干净的离心管中,称取重量。
7、向胶块中加入等倍体积溶胶PC,50℃水浴放置10 min,其间不断温和地上下翻转
离心管,以确保胶块充分溶解。
8、将上一步所得溶液加入一个吸附柱CB2中,12,000rpm离心1min,倒掉收集管中
的废液,将吸附柱CB2 放入收集管中。
9、向吸附柱中加入600μL 漂洗液PW,12,000rpm离心1min,倒掉收集管中的废液,
将吸附柱CB2 放入收集管中。重复漂洗一次。
10、将吸附柱CB2 放回收集管中,12,000rpm离心2min,尽量除去漂洗液。将吸附柱
CA2 置于室温放置数分钟,彻底地晾干。
11、将吸附柱放到一个干净离心管中,向吸附膜中间位置悬空滴加35μL洗脱缓冲液
EB,室温放置2min。12,000rpm离心2min,收集DNA溶液,此就为连接所用载体Vector。
五、实验结果及分析
1.质粒提取检测结果
由此结果可知,质粒提取的质量比较好,且浓度也比较高。可以作为下一步酶切的模板。
2.载体双酶切结果
由于未点样质粒对照,且单酶切条带离双酶切较远,不好比较,故此次结果不能充分说明载体切开。但从图上来看,11,12,13,14泳道很可能是未切开的载体,而1,2,3,4,5,6,7,8泳道的产物与其相比可判断为已切开的载体。此外,此图上未能看到两个酶切位点间的大约150bp左右的小片段,可能是浓度太低亮度不够,也可能是由于片段太小已跑出凝胶。所以,先将1-8泳道的酶切产物胶回收,拟与回收的目的基因连接转化,通过后来的菌落PCR鉴定是否正确。
另外,此次试验酶切做了两次,第一次结果如下图:
很明显看出有三条带,同样,由于没有质粒对照,不好说明最上面是切开的还是未切
开的载体,但通过底下两条带可以推断出,此质粒可能有问题。其载体上两个酶切位点有可能并非一个,除了我们预计的那两个,可能序列中还存在同样的酶切位点,所以导致酶切产物出现多条带的现象。故更换实验材料重新提取质粒和做双酶切。
实验二、目的基因的获得及酶切处理
一、实验目的
1、学习PCR 反应的基本原理和实验技术。
2、了解引物设计的一般要求。
3、掌握PCR 产物的回收及酶切过程
二、实验原理
聚合酶链反应(polymerase chain reaction,PCR)是体外酶促合成DNA 片段的一种技术。利用PCR 技术可在数小时之内大量扩增目的基因或DNA 片段,以用于基因工程操作。
PCR 进行的基本条件:
⑴DNA 模板
⑵引物
⑶dNTP(dATP、dTTP、dGTP、dCTP)
⑷Taq DNA 聚合酶
⑸反应缓冲体系
PCR 循环由三个步骤组成:
⑴变性使模板DNA 解离成单链;
⑵退火使引物与模板DNA 所需扩增序列结合;
⑶延伸DNA 聚合酶利用dNTP 合成与模板碱基序列互补的DNA 链。
每一个循环的产物可作为下一个循环的模板,通过30 个左右循环后,目的片段的扩增可达106倍。
三、实验仪器及试剂
(一)仪器
Premix EX Taq DNA 聚合酶
10×反应缓冲液(含25mmol MgCl2)
引物F1: 5'-CATGCCATGGGCGAGGGCAAAGCCCGCAC-3’;
R1:5'-CCGCTCGAGTCAGACATAAGAAAAGCCATTGG-3’
NcoⅠ酶,XhoⅠ酶(Takara)
胶回收试剂盒(天根生物科技)
DNA模板
(二)试剂
PCR 扩增仪等
四、实验步骤
(一)PCR 扩增
1、按下表加入试剂,并小心混匀。
2、设置PCR 程序并运行:
(二)PCR 产物鉴定
反应结束后,取5μL PCR 产物进行1 %琼脂糖电泳分析。
(三)目的基因片段的回收
步骤同载体片段回收。
(四)目的基因片段的酶切
加样后混匀,置于37℃水浴中,保温7~12 小时。然后每个管中加入Loading buffer 终止反应。
(五)目的基因片段酶切后回收
同载体片段回收的步骤进行。此为Insert,为连接做好准备。
五、实验结果及分析
1.目的基因的获得
目的基因为VP60,是兔出血热病毒外壳蛋白,目的片段大约1700bp左右,点样所用的Marker 为DL2000。从图上看出,PCR产物大小位于2000偏下一些,大致与目的基因大小一致。可以说明目的基因获得正确。由于引物设计加了酶切位点,所以该产物序列两端带有两个酶切位点,便于下一步酶切回收后与载体连接转化。
实验三、质粒载体和外源DNA 的连接及转化
一、实验目的
1、掌握DNA 体外连接的基本技能,了解连接反应的注意事项。
2、掌握感受态细胞制备和转化的基本方法。
二、实验原理
DNA 片段之间的连接是通过DNA 连接酶的催化实现的。DNA 连接酶催化具有平末端或互补粘性末端的DNA 片段间相邻碱基通过3’-5’磷酸二酯键连接起来,该反为需能反应,通常需要加入ATP 或NADH,DNA 连接酶对粘性末端的连接效率要远高于对平末端的连接效率。
在基因基因工程实验中,最常用的来源于T4 噬菌体的T4DNA 连接酶。对于平末端或互补的粘性末端可直接进行连接反应。一个片段是平末端,另一片段为粘性末端或两个片段都是粘性末端但不配对,则需要通过各种方式使其可一匹配或通过平末端进行连接。通常采用末端补平、加同聚物尾、加接头等方式是目的片段之间能够匹配。
进行连接反应时,为了减少片段的自连,通常要进行去磷酸化,去磷酸化可通过碱性磷酸酶完成。比如将目的片段和载体进行时通常要将载体去磷酸化,以减少载体的自连。同要进行连接反应也经常对目的片段进行磷酸化以增强目的片段的连接,在相邻碱基间如果没有磷酸在连接效率大幅下将,如果载体进行了去磷酸化,目的片段可进行磷酸化,以增强目的片段和载体的连接。
在连接反应中,目的DNA 片段和载体的比例是一个关键问题,对于长度为
1kb 的片段和3kb 的载体而言,通常目的片段和载体的比例设为2:1 或3:1,如果目的片段越长该比例应再升高,因为主要考虑的是载体和目的片段之间的分子数的比例。反应体系中核酸的浓度也是一个重要问题,通常反应体系中反应物浓度应保持在25 --100 ng/μL。连接反应和其它酶不同,需要在较低的温度下进行,通常在12~16℃过夜,也可在4℃过夜连接,如果是平末端连接,可适当提高连接温度。除上述因素外,DNA 样品的纯度、盐浓度等会影响连接效率。
所谓感受态细胞是通过一定的试剂处理细胞,使细胞处于易于接受外源DNA 的生理状态。通常用0.1M CaCl2处理细胞,就可得到感受态细胞。细胞原本所处的生理状态制备对感受态细胞的制备很关键。将重组DNA 导入细胞的方法有多种,如热休克法,电击法等。通过这些方法可以使细胞膜出现暂时的松弛,导致外源DNA 进入细胞。
三、实验材料、仪器及仪器
(一)材料
大肠杆菌DH5α菌株
(二)仪器
1、冷冻离心机
2、恒温水浴
3、微量移液器
4、无菌操作台
5、电子天平
(三)试剂
1、目的DNA 片段(NcoⅠ/XhoⅠ)
2、载体(pET-28a NcoⅠ/XhoⅠ)
3、T4 DNA 连接酶(Thermo)
4、ddH2O
5、0.1mol/L CaCl2
6、LB 液体培养基
7、LB 固体培养基
8、卡那霉素(100 毫克/毫升)
四、实验步骤
(一)连接
取一个200μL 的PCR 管依次加入下列试剂:
使反应体系充分混合,离心30s,37℃连接20,min。
(二)感受态细胞的制备(0.1M CaCl2方法)
1、取1.5ml 摇好的菌液于1.5 mL的EP 管中,4℃4000rpm 离心3min,弃上清。
2、加250μL 0.1M CaCl2(预冷)温和悬浮菌体,4℃8000rpm 离心1min 弃上清。
3、加100μL 0.1M 的CaCl2(预冷)温和悬浮菌体,即为感受态细胞。置于4℃存放。12h 内使用效果最佳。
(三)连接产物对大肠杆菌的转化
1、1、将连接产物全部加入100μL 制备好的感受态细胞中。
2、冰上放置10min。
3、42℃热激90S。
4、冰浴3min。
5、加入800μL LB 液体培养基,37℃培养复苏60min。
6、离心浓缩后,留下大约100μL 悬起细胞,超净台中涂布于含有卡那霉素的平板上。
7、37℃倒置培养16-20 h。
五、实验结果及分析
本次转化结果不是很好,平板上过夜长的菌都比较小且很少,可能是连接效果不好,也可能是转化所用感受态细胞活力不高。故将所有的单克隆都挑出,放入LB培养基中扩大培养,注意做好标记。然后吸出少量菌液进行菌落PCR鉴定,而后提取重组质粒进行酶切鉴定,通过鉴定结果判断单克隆是否正确。
实验四、重组质粒鉴定及转化
一、实验目的
掌握快速细胞破碎法测定大小不等的众多的质粒DNA;和菌落PCR 快速鉴定克隆。
二、实验原理
在这个实验方法中,用设计好的引物,做菌落PCR 快速鉴定克隆;然后将有扩增信号的菌落经培养后提取质粒,再进行酶切进一步鉴定;最终将确定好的重组子转入表达菌株中。
三、实验材料、仪器及试剂
(一)材料
大肠杆菌菌株BL21(DE3);BL21(DE3)plysiS
(二)仪器
1、电泳仪
2、1.5ml 离心管
3、培养皿
4、PCR 扩增仪
5、台式离心机
6、凝胶成像仪
(三)试剂
1、点样缓冲液Loading buffer(10×)
2、2×Mix Taq DNA 聚合酶
3、TBE 电泳缓冲液(5×)
4、引物F1: 5'-CATGCCATGGGCGAGGGCAAAGCCCGCAC-3’ ;
R1: 5'-CCGCTCGAGTCAGACATAAGAAAAGCCATTGG-3’
5、卡那霉素(100 毫克/毫升)
6、NcoⅠ酶,XhoⅠ酶(Takara)
四、实验步骤
(一)菌落PCR 快速鉴定法
1、直接用牙签或接种针挑取少许菌体加入1.5mL LB液体培养基中37℃摇约3h。
2、吸取1μL菌液作为模板加入20μL PCR体系中(剩余菌液继续摇):
设置PCR 程序:
3、运行PCR 程序
4、反应结束后,取5μLPCR 产物进行1 %琼脂糖电泳分析。
(二)重组质粒酶切鉴定
1、重组质粒提取
挑取菌落PCR 鉴定的阳性克隆,进行培养后提重组质粒,重组质粒提取参见前述质粒提取的方法和步骤。
2、重组质粒的酶切鉴定
按下表将各种试剂分别加入每个200μl 的Eppendorf 管中。
加样后混匀,置于37℃水浴中,保温5~6 h。然后进行琼脂糖电泳分析。
(三)重组质粒的转化
用重组质粒转化表达菌BL21(DE3)和BL21(DE3)pLysS,感受态的制备及转化参考实验三进行。BL21(DE3)pLysS菌株携带pLysS质粒,具有氯霉素抗性。pLysS含有表达T7溶菌酶的基因,T7溶菌酶可以作用于大肠杆菌细胞壁上的肽聚糖溶解大肠杆菌,,能够降低目的基因的背景表达水平,但不干扰IPTG诱导的表达,适合表达毒性蛋白和非毒性蛋白。该菌株染色体整合了λ噬菌体DE3区(DE3区含有T7噬菌体RNA聚合酶)。BL21(DE3)是大肠杆菌表达菌株,用于高效表达克隆于含有噬菌体T7启动子的表达载体(如pET系列)的基因,是以T7 RNA 聚合酶为表达系统的高效外源基因的蛋白表达宿主,T7噬菌体RNA聚合酶基因的表达受控于λ噬菌体DE3区的lacUV5启动子,该区整合于BL21的染色体上。该菌株适合于非毒性蛋白的表达。
五、实验结果及分析
1.菌落PCR鉴定
由上图可以看出,大部分单克隆菌是可以扩出目的基因条带的,说明连接转化成功,故可将扩大培养菌液中菌落PCR鉴定正确的菌液保留提取质粒,不正确的丢弃。
2.重组质粒酶切鉴定
重组质粒酶切鉴定,预计结果应是:双酶切切出两条带,分别是目的基因和载体,单酶切只是线性化质粒,只有一条带。加上质粒对照进一步说明酶切结果的可信度。上图结果说明,重组质粒正确,可硬用于下一步的转化表达菌株进行IPTG诱导蛋白表达。
3.转化
此次转化结果较上次好一些,单克隆很多且菌落比较大。可以用于下一步蛋白诱导。
实验五、目的蛋白的诱导及表达
一、实验目的
1.学习用诱导物诱导外源基因表达;
2.掌握SDS-PAGE 原理和技术,
3.应用于基因工程产物的分析鉴定。
二、实验原理
SDS-PAGE(sodium dodecyl sulphate-polyacrylamide gel electrophpresis)是目前用于测定蛋白质分子量的一种最好方法。该技术在1967 年由Shapiro 等建立,此方法用于多肽分子量的测定,变性蛋白的分离,和溶解在离子去污剂中的膜蛋白和层析分离的蛋白和酶的纯化控制。
SDS 是一种阴离子去污剂,作为蛋白的变性剂和助溶剂,它能断裂多肽分子内和分子间的氢键,破坏蛋白的二级,三级结构,使的多肽链失去天然构型折叠。强的还原剂例如巯基乙醇(β-mercaptoethanal)或者二硫苏糖醇(dithiothretol,DTT)多肽链间和链内的二硫键断裂。当样品和凝胶中加入还原剂和SDS 后,分子解聚并结合SDS,形成蛋白质-SDS 胶束,带有大量负电荷的SDS 掩盖了蛋白质本身所带电荷,这一胶束在水溶液中,短轴对不同蛋白亚基均为,18A O;而长轴则与亚基分子量大小成正比。根据经验所得,当SDS 的浓度在8×10-4 mol/L 以上时,1g 蛋白质几乎恒定的结合1.4g 的SDS。当处理好的样品进行SDS-PAGE 时,不同亚基将根据所带负电荷和和凝胶介质的分子筛效应而相互分离,其中浓缩胶和分离胶,PH 值的不连续凝胶系统使的各亚基得到更好的分离。
三、试剂与仪器
(一)试剂
1、标准分子量蛋白溶液
2、Tris-Gly 电极缓冲液:Tris 6g,Gly 28.8g,SDS 1g,ddH2O 溶解后,用HCL 调PH 至
8.3,水定容至1000 mL。
3、30%(w/v)凝胶贮存液:Acr 30g,Bis 0.8g 加蒸馏水溶解至100 mL。过滤,棕色
瓶4℃保存。
4、Tris-HCL 分离胶缓冲液(3mol/L pH8.7):Tris 36.3g, 1 mol/L HCL 48 mL,加ddH2O
至100 mL。
5、Tris-HCL 浓缩胶缓冲液(0.5mol/L pH6.7):Tris 5.98g, 1 mol/L HCL 48 mL,加
ddH2O 至100 mL。
6、10%SDS:1g SDS 加水10 mL 溶解。
7、10%过硫酸铵(AP):1g AP 加水10 mL 溶解(现配)。
8、四甲基乙二胺(TEMED)4℃棕色瓶中贮存。
9、样品处理液:Tris-HCL 浓缩胶缓冲液20 mL, β-巯基乙醇10ml,SDS 2g,甘
油20 mL,溴酚蓝0.1g,加ddH2O 至100 mL。
10、0.05%(W/V)考马斯亮蓝染色液:考马斯亮蓝R-250 0.5g 异丙醇250 ml,冰乙酸
110ml,蒸馏水740 mL。
11、脱色液:异丙醇100 mL,冰乙酸100 mL,蒸馏水800 mL。
12、标准分子量蛋白溶液
13、卡那霉素(100 毫克/毫升)
14、IPTG(1M,0.1M)
15、LB 液体培养基
(二)仪器
1、稳压稳流电泳仪
2、垂直板电泳槽
3、烧杯(50mlx2)
4、脱色摇床
5、台式高速离心机
6、恒温摇床
7、无菌操作台(含酒精灯、)
四、实验步骤
(一)目的蛋白的诱导
1、分别挑取空载菌和重组菌菌落,接入5ml 含Kan(50μg/ml)的LB 培养液,37℃振荡培养过夜,同时设置空菌对照,接入不含Kan的LB培养基作为空白对照。
2、取5ml 过夜培养物接入500ml 含Kan(50μg/ml)的LB 培养液,37℃振荡培养2h左右,至对数中期(OD600=0.5~0.6)。
3、向诱导管中加入0.1和1M的IPTG,同时设置不加IPTG的阴性对照管,25℃振荡培养过夜。
(二)SDS-PAGE 检测目的基因的表达
1、将制胶装置固定在制胶架上。
2、按照下表配制分离胶。(注意TEMED和APS最后加,防止凝胶)
将分离胶注入玻璃夹层中。上部25%乙醇或蒸馏水封面,保持胶面水平,待分离胶聚合
好,再配制浓缩胶。
3、配制浓缩胶(4%。15ml)
灌入浓缩胶,插入梳子。胶凝固后待用。点样前再拔掉梳子。
4、样品处理
收集过夜诱导的菌液,10000rpm 离心1min收集菌体,而后倒掉上清,加入200μL的蒸馏水混匀后,加入loading buffer,100℃水浴5 分钟,然后插入冰浴冷却后离(10000r/min.5min),取上清备用。
5.加样
电泳槽中加入电极缓冲液,拔掉点样梳,用微量进样器点样,上样量40μL,蛋白Marker
9μL。
点样顺序按照:①Marker、②DE3空菌+IPTG、③pET28a空载+IPTG、
④pET28a-IPTG、⑤重组质粒5DE3-IPTG、⑥5DE3+IPTG、⑦18DE3-IPTG、
⑧18DE3+IPTG、⑨19DE3-IPTG、⑩19DE3+IPTG。
6、电泳
接好电路,打开电源,在低电压100V 下电泳,至样品在浓缩胶部分聚集成线,改用电压140V 电泳,待溴酚蓝前沿到达凝胶底部时停止电泳。
7、剥胶和染色
倒掉电极缓冲液,轻轻敲开玻璃板,取出凝胶并在角上做好记号(注意不要污染了凝胶);
用蒸馏水洗涤凝胶;然后将凝胶置于染色液中,振荡染色2 小时。 8、脱色
取出凝胶,先用蒸馏水漂洗数次,然后置于脱色液中振荡脱色至背景干净,条带清晰。 9、照相保存 五、实验结果及分析
目的蛋白大小为60KD 左右,本次蛋白胶结果不好,可能由于上清较为粘稠(尽管已经离心),但没有过柱子进一步纯化,导致上样样品较粘;且点样时存在飘样情况,这对于胶图结果也有影响。空载泳道在目的蛋白区无明显条带,符合预期结果,但其他泳道加IPTG 诱导和未加IPTG 诱导区分不是很明显,理论上未加IPTG 诱导应该无目的蛋白或含量极少,这有可能是由于点样时产生的飘样,也可能表达的蛋白未经纯化浓缩,导致胶图上出现很多杂带。从上图来看,66KD-45KD 区域有蛋白条带,但量不是很大,也可以初步判断目的蛋白表达。如果要进一步确认目的蛋白的表达及其表达量,则可以进行western blot 验证,将蛋白胶转膜后采用目的蛋白的特异抗体与其杂交,只有目的蛋白部分能杂交上带,照相后可以看出是否有目的蛋白以及它的含量。
致谢:感谢学院提供的实验平台,特别感谢张老师一周以来的实验讲授和指导,从目的基因的获得到载体酶切验证再到蛋白表达,一个基本完整的实验流程走下来收获很多,而且此次制蛋白胶也没有出现生化实验中多次反复胶未混匀不凝的情况,说明多联系还是有用的;此外,对于一些实验突发状况,如载体出现问题,老师为保证实验进度做处理方法:一边保存菌液培养,一边进行酶切和PCR 验证,而后综合两者,获得正确重组质粒。既保证了质量,又节省了时间,通过这点也学到了一些处理方法。总之,通过本次大实验,在生化实验的基础上又新学到了很多技能,而且对于以后的实验也是非常有帮助的,再次感谢老师!
116KD 66KD
45KD
35KD
25KD 18KD 14KD
小学自然实验报告模板 教学模式是在一定的教学思想或教学理论的指导下建立起来的,较为稳定的教学活动结构框架和活动程序。“结构框架”意在从宏观把握教学活动整体各要素之间的内部关系;“活动程序”意在突出教学模式的有序性和可行性。 自然学科是人类在认识自然的过程中所积累的知识。它与人的认识过程有较高的一致性,最适用于发现式的学习方法。实验是传授自然科学知识和培养与发展学生各种能力的重要手段。我校的教研组推出的四环节实验课教学模式,以其较完美的操作性、开放性、优效性和灵活性形成了自然实验课的基本框架,较好地揭示课堂教学的一般程序、课堂教学诸因素的内在联系和课堂教学的普遍规律。现就模式谈一下我在教学中的实践与几点体会。 一、教学模式的四个环节在实践中的具体运用 (一)提出问题阶段 提出问题阶段是当研究一个问题时,为了激发学生的求知欲望,引导学生探索并调动他们积极性的阶段。教师可结合要研究的问题,用生动形象的语言恰如其分地提问,让学生在观察和思维中发现问题。 例如,《物体的热胀冷缩》一课,先进行演示实验,在铁架台上放一平底烧瓶,瓶中装满水,用酒精灯加热,水还没烧开,瓶中的水就往外溢。教师接着问大家,你们看了这个现象有什么想法?学生一下子提出许多问题:“为什么水加热后往上溢呢?”
“水难道会变多吗?” 教学时,为了激发学生探求知识的欲望,应千方百计创造性地运用各种方法,如:做游戏、讲故事、变魔术、猜谜语、出示挂图、运用幻灯等。引起学生要研究问题的兴趣,提出自己的想法。 (二)作出假设阶段 学生提出了问题,但在还没有学习有关的知识时,教师引导学生对自己的问题作出假设的回答。教师再从学生假设中引导学生逐渐进入要研究的问题中去。 例如,《水蒸气的凝结》,教师将还在冒白气的温水杯加盖,过一会儿再揭开盖,请同学们看盖上的水珠,水蒸气碰到什么样的物体在上面结成水珠呢?引导学生作出假设,发表不同意见。有的同学说:“水蒸气遇到热的物体结成水珠。”有的说:“水蒸气遇到冷的物体结成水珠。”教师接着说:“那么我们就一起研究一下,水蒸气在什么条件下能变成水呢?”这样就逐渐地把学生引入要研究的课题。 在这个阶段中,学生根据已有知识的经验,通过演绎、归纳、推理而提出的假设,不少带有猜测的性质。此时教师要引导学生积极作出假设,不应压抑学生的思维,不管是对是错,都不要忙于作出评价。 (三)设计实验阶段
基因工程实验报告 、
小麦GAPDH截短体的重组与表达 摘要:本实验通过基因工程(genetic engineering)手段对小麦总RNA进行提取、PCR扩增及与质粒载体的重组构建的操作,并将重组质粒以氯化钙法导入大肠杆菌感受态细胞,诱导目的基因表达,并在蛋白水平进行Western检测。通过本对实验的实践,我们对基因工程技术将会有一个比较全面的认识和了解。 关键字:小麦基因;载体;感受态 前言 基因工程(genetic engineering)又称基因拼接技术和DNA重组技术。为在分子水平上对基因进行操作的复杂技术,是将外源基因通过体外重组后导入受体细胞内,使这个基因能在受体细胞内复制、转录、翻译表达的操作。它是用人为的方法将所需要的某一供体生物的遗传物质——DNA大分子提取出来,在离体条件下用适当的工具酶进行切割后,把它与作为载体的DNA分子连接起来,然后与载体一起导入某一更易生长、繁殖的受体细胞中,以让外源物质在其中“安家落户”,进行正常的复制和表达,从而获得新物种的一种崭新技术。它克服了远缘杂交的不亲和障碍。 (一)实验过程
1.实验部分流程:
2.小麦总RNA提取(Trizol法) 2.1 材料 小麦幼苗 2.2 试剂配制及器具处理 ① 0.1%的DEPC H2O(DEPC:焦碳酸二乙酯) ②器具处理:试剂瓶、量筒、研钵、大小枪头和1.5ml和0.2ml 的EP管等用纱布包裹,在 0.1%的DEPC H2O中浸泡过夜(37℃),高压灭菌,80℃烘干备用。剪刀、镊子和药匙等160℃烘烤6h以上。 ③无RNA酶灭菌水(DEPC H2O):用将高温烘烤的玻璃瓶(180℃×2h)装蒸馏水,然后加入 0.1%的DEPC(体积/体积),处理过夜后高压灭菌。 ④Trizol ⑤ 75%乙醇:用新打开的无水乙醇和DEPC处理过的水配制75%乙醇(用高温灭菌器皿配制),然后装入高温烘烤的玻璃瓶中,存放于低温冰箱。 ⑥氯仿(最好用新的)。 ⑦异丙醇(最好用新的)。 2.3 操作步骤: ①先在研钵中加入液氮,再将小麦叶片剪成小段在液氮中磨成粉末,用液氮预冷的药匙取50~100mg组织粉末加入已盛有1ml的Trizol液的EP管中(注意研磨粉末总体积不能超过所用Trizol体积的10%),充分混合均匀。 ②室温放置5min,然后加入200μL的氯仿,盖紧EP管并剧烈摇荡15秒钟。 ③ 12000rpm离心10min,取上层水相于一新的EP管中(千万不要将中间的沉淀层和下层液混入,否则重新离心分离),加入500μL异丙醇,温和颠倒混匀。室温放置10min,12000rpm 离心10min。 ④小心地弃去上清液,加入1ml的75%乙醇,涡旋混匀,4℃下12000rpm离心5min。 ⑤重复步骤④。 ⑥弃去上清液(尽量将残余液体除去),室温或真空干燥5~10min(注意不要干燥过分,否则会降低RNA的溶解度)。用30μL DEPC处理过的水将RNA溶解,必要时可55℃~60℃水浴10min。RNA可进行mRNA分离,或贮存于70%乙醇并保存于-70℃。 3. RT-PCR扩增目的基因cDNA 3.1 试剂 ① RNA模板 ②Olig(dT)18 ③反转录缓冲液 ④dNTP ⑤ M-MULV反转录酶 ⑥ RNA抑制剂(RNasin) ⑦Premix EX Taq DNA聚合酶 ⑧ PCR特异引物 3.2操作步骤: 3.2.1 RNA的反转录 采用Thermo Scientific(Fermentas)RevertAid First Strand cDNA Synthesis Kit Total RNA 6μL(需加入RNA约1μg) OligodT primer 1μL H2O(nuclease-free)5μL 12μL 65℃ 5min,补加下列试剂: 5× Reaction buffer 4μL RibolockRNase Inhibitor 1μL 10mM dNTP Mix 2μL RevertAid M-MuLV Reverse Transcriptase 1μL 20μL 42℃ 60min 70℃,5min,﹣20℃保存
一、大肠杆菌质粒DNA的提取 质粒DNA的提取是从事基因工程工作中的一项基本实验技术,但提取方法有很多种,以下介绍一种最常用的方法:碱裂解法。此方法适用于小量质粒DNA的提取,提取的质粒DNA可直接用于酶切、PCR扩增、银染序列分析。方法如下: 1、接1%含质粒的大肠杆菌细胞于2ml LB培养 基。 2、37℃振荡培养过夜。 3、取1.5ml菌体于Ep管,以4000rpm离心3 min,弃上清液。 4、加0.lml溶液I(1%葡萄糖,50mM/L EDTA pH8.0,25mM/L Tris-H Cl pH8.0)充分混合。 5、加入0.2ml溶液 II(0.2 mM/L NaOH,1% SDS),轻轻翻转混匀,置于冰浴5 min 。 6、加入0.15m1预冷溶液III(5 mol/L KAc,p H4.8),轻轻翻转混匀,置于冰浴5 min 。 7、以10,000rpm离心20min,取上清液于另 一新Ep管 8、加入等体积的异戊醇,混匀后于?0℃静置1 0min。 9、再以10,000rpm离心20min,弃上清。 10、用70%乙醇0.5ml洗涤一次,抽干所有 液体。 11、待沉淀干燥后,溶于0.05mlTE缓冲液中 二、质粒DNA琼脂糖凝胶电泳鉴定 琼脂糖是从海藻中提取出来的一种线状高聚物,应选用电泳纯的,琼脂糖此级产品筛除了抑制物和核酸酶,而且用溴化乙锭染色后荧光背景最小。 (1)琼脂糖凝胶电泳装置
由于琼脂糖凝胶电泳既要求不高,而适应性又强,在过去15年里已成功地设计了形形色色及大大小小的电泳槽。对这些装置的选择主要是依据个人的喜恶。使用最普遍的装置是Walt er Schaffner发明的水平板凝胶。 水平板凝胶通常在一块可安放于电泳槽平台的玻璃板或塑料盘上灌制。在有些装置中,则可将凝胶直接铺在平台上。凝胶恰好浸在缓冲液液面下进行电泳。凝胶的电阻几乎与缓冲液的电阻相同,所以有相当一部分的电流将通过凝胶的全长。 (2)琼脂糖凝胶的制备 琼脂糖凝胶的制备是将琼脂糖在所需缓冲液中熔化成清澈、透明的溶液。然后将熔化液倒入胶模中,令其固化。凝固后,琼脂糖形成一种固体基质,其密度取决于琼脂糖的浓度。通贯凝胶的电场接通后,在中性pH值下带负电荷的DNA向阳极迁移。 (3)琼脂糖凝胶的染色 电泳完毕,将琼脂糖凝胶转移入含EB的染液中,染色10分钟,取出紫外灯下观察。 三、质粒DNA热激法转化大肠杆菌 感受态的细胞可以摄入外部溶液中的DNA,而常态的细胞却不能,所以要转化质粒DNA进入大肠杆菌必须首先制备感受态的大肠杆菌细胞。 1、取1%大肠杆菌E.coli接种于含2ml LB培 养基的试管中,37℃振荡培养过夜 2、取0.1ml过夜培养物转种于含10ml LB培 养基的三角瓶中,37℃振荡培养3h至OD600=0. 3 3、然后把培养物倒入1.5ml离心管中,冰浴1 0min。 4、在4℃下以4000rpm离心5min,去上清液 5、把菌体悬浮于15m1冰冷的0.1M CaCl2溶液 中,置冰上30min 6、然后再在4℃下以4000rpm离心10min,去 上清液
word基本操作实验报告 一、实验目的与要求 1.掌握word的基本操作; 2.掌握字符格式、段落格式和页面格式等排版技术; 3.掌握图文混排、表格处理和邮件合并技术; 4.熟悉个人名片或毕业论文的设计与制作; 5.学会自己提出问题,并得出解决问题的方法。 二、实验内容与方法 1.word的基本操作,通过上机摸索,并查阅书籍网络了解。 2.word的字符格式,段落格式和页面格式等排版技术,通过上机摸索,并查阅书籍网络了解。 3.word的图文混排、表格处理和邮件合并技术,通过上机摸索,并查阅书籍网络了解。 4. 通过word进行个人名片或毕业论文的设计与制作,通过上机摸索,并查阅书籍网络了解。 三、实验步骤与过程 1.word的基本操作:①启动word软件 (1) 启动“开始”菜单中的microsoft word程序 (2) 双击资源管理器或“我的电脑”中的c:\program files\microsoft office\office11\winword.exe程序 (3) 双击word 文档文件(*.doc) (4) 双击桌面上的word图标 (5)开始-运行-输入“winword”②认识word2003窗口(1)标题栏位于屏幕最顶端的是标题栏,由控制菜单图标、文件名、最小化按钮、最大化(还原)按钮、关闭按钮组成。(2)菜单栏 菜单栏位于标题栏下面。使用菜单栏可以执行word的许多命令。菜单栏共有九个菜单:文件、编辑、视图、插入、格式、工具、表格、窗口、帮助。当鼠标指针移到菜单标题上时,菜单标题就会凸起,单击后弹出下拉菜单。在下拉菜单中移动鼠标指针时,被选中的菜单项就会高亮显示,再单击,就会执行该菜单所代表的命令。如“文件”—“打开”,就会弹出“打开”文件对话框。(3)工具栏 标题栏下面的是工具栏,使用它们可以很方便地进行工作。通常情况下,word会显示【常用】和【格式】两个工具栏。 “常用”工具栏:新建、打开、复制、粘贴、打印、撤消、恢复等“格式”工具栏:字体、字号、下划线、边框、对齐方式等 如果想了解工具栏上按钮的简单功能,只需将鼠标指针移到该按钮上,过一会儿旁边会出现一个小框,显示出按钮的名称或功能。 word窗口中可以有许多工具栏,可以根据需要在“视图”—“工具栏”中增加或减少工具栏。每一个工 具栏都可以用鼠标拖动到屏幕的任意位置,所以又称为浮动工具栏。工具栏内图标按钮体现了“菜单栏”中的一些主要功能。我们可以利用这些按钮进行相应操作。如我要打开一个文件,除了可以使用菜单栏外,还可以使用工具栏上的按钮。 (4)编辑窗口 再往下的空白区域就是word的编辑窗口,输入的文字就显示在这里。文档中闪烁的竖线称为光标,代表文字的当前输入位置。(5)标尺 在编辑窗口的上面和左面有一个标尺,分别为水平标尺和垂直标尺,用来查看正文的高度和宽度,以及图片、文本框、表格的宽度,还可以用来排版正文。( 6)滚动条在编辑窗口的右面和下面有滚动条,分别为垂直滚动条和水平滚动条,用来滚动文档,显示在屏幕中看不到的内容。可以单击滚动条中的按钮或者拖动滚动框来浏览文档。(7)显示方式按钮
——凯1.简述本学期从基因组DNA提取到重组质粒鉴定的实验流程?(实验题目的总结) 答:①基因组DNA的提取;②PCR扩增目的基因;③凝胶电泳分离纯化PCR扩增的DNA片段以及DNA的体外连接;④重组质粒的转化及转化子的筛选;⑤重组质粒的抽提;⑥重组质粒的酶切鉴定。 2.如何正确使用微量移液器?(自己写的) 答:①选取合适量程的移液器;②根据取液量设定量程;③安装(吸液)枪头;④按至第一档,将枪头垂直伸入液面下适当位置吸液;⑤按至第二档将液体打入容器;⑥弃掉枪头;⑦将量程调至最大,放回原处。 3.在琼脂糖凝胶电泳点样时,DNA通常和什么试剂混匀,其主要成分和作用是什么? 答:loading Buffer。主要成分为溴酚蓝,二甲苯青和甘油。 溴酚蓝和二甲苯青起指示作用;甘油加大样品密度,从而沉降于点样孔中,以免浮出。 4.简述制作1%的琼脂糖凝胶电泳的操作步骤。(题目有歧义) 答:①取0.5g琼脂粉置于锥形瓶,量取50ml 1×TBE溶液于瓶中,微波炉加热至琼脂溶解; ②将移胶板放入胶室中,选取合适梳子垂直安插在移胶板上方,待琼脂降温至55℃下后,缓慢导入该胶室里;③量取合适量1×TBE溶液导入洗净的电泳槽,并正确插好电泳线;④等凝胶凝固后,将梳子垂直拔出;⑤点样;⑥轻放移胶板至电泳槽的合适位置;⑦打开电泳仪的开关,调好参数,开始电泳;⑧一定时间后,停止电泳,取出凝胶板,然后经BE染色放入成像系统显色、观察。 5.琼脂糖凝胶电泳中DNA分子迁移率受哪些因素的影响?(实验书P75) 答:①样品DNA的大小和构象;②琼脂糖浓度;③电泳电场;④温度;⑤缓冲液;⑥嵌入染料的存在与否; 6.在使用苯酚进行DNA抽提时应注意什么?(实验书P31) 答:注意不要吸取中间的变性蛋白质层。 7.在基因组DNA提取过程中常用酚、氯仿、异戊醇试剂,它们各有什么作用? 答:酚——是蛋白质变性,抑制DNA酶的降解作用;氯仿——除去脂类,同时加速有机相与水相的分层;异戊醇——降低表面张力,从而减少气泡的产生。 8.提取DNA实验中,通常可选用哪些试剂沉淀DNA? 答:冷的无水乙醇,冷的异丙醇,终浓度为0.1~0.25mol/L 的NaCl 9.简述在DNA提取实验中个试剂的作用(SDS,EDTA,酚/氯仿/异戊醇、无水乙醇,70%乙醇)。 答:SDS——破坏细胞膜,解聚核蛋白;EDTA——整合金属离子,抑制DNase活性;酚/氯仿/异戊醇——见第7题;无水乙醇——沉淀DNA;70%乙醇——洗涤DNA沉淀。 10.简述PCR扩增技术的原理及各种试剂的作用(Mg2+,dNTP,引物,DNA,缓冲液,Taq
科技实验报告 一、定义与作用 实验报告,就是在某项科研活动或专业学习中,实验者把实验的目的、方法。步骤、结果等,用简洁的语言写成书面报告。 实验报告必须在科学实验的基础上进行。成功的或失败的实验结果的记载,有利于不断积累研究资料,总结研究成果,提高实验者的观察能力。分析问题和解决问题的能力,培养理论联系实际的学风和实事求是的科学态度。 二、写作要求 实验报告的种类繁多,其格式大同小异,比较固定。实验报告,一般根据实验的先后顺序来写,主要内容有: 1.实验名称名称,要用最简练的语言反映实验的内容。如验证某定律,可写成“验证×××”;如测量的实验报告,可写成 “×××的测定。” 2.实验目的实验目的要明确,要抓住重点,可以从理论和实践两个方面考虑。在理论上,验证定理定律,并使实验者获得深刻和系统的理解,在实践上,掌握使用仪器或器材的技能技巧。 3.实验用的仪器和材料如玻璃器皿。金属用具、溶液、颜料、粉剂、燃料等。 4.实验的步骤和方法这是实验报告极其重要的内容。这部分要写明依据何种原理。定律或操作方法进行实验,要写明经过哪儿个
步骤。还应该画出实验装置的结构示意图,再配以相应的文字说明,这样既可以节省许多文字说明,又能使实验报告简明扼要。清楚明白。 5.数据记录和计算指从实验中测到的数据以及计算结果。 6.结果即根据实验过程中所见到的现象和测得的数据,作出结论。 7.备注或说明可写上实验成功或失败的原因,实验后的心得体会、建议等。 有的实验报告采用事先设计好的表格,使用时只要逐项填写即可。 三、撰写时应注意事项 写实验报告是一件非常严肃。认真的工作,要讲究科学性、准确性。求实性。在撰写过程中,常见错误有以下几种情况:1.观察不细致,没有及时、准确、如实记录。 在实验时,由于观察不细致,不认真,没有及时记录,结果不能准确地写出所发生的各种现象,不能恰如其分。实事求是地分析各种现象发生的原因。故在记录中,一定要看到什么,就记录什么,不能弄虚作假。为了印证一些实验现象而修改数据,假造实验现象等做法,都是不允许的。 2.说明不准确,或层次不清晰。 比如,在化学实验中,出现了沉淀物,但没有准确他说明是“晶体沉淀”,还是“无定形沉淀”。说明步骤,有的说明没有按照操作顺序分条列出,结果出现层次不清晰。凌乱等问题。
1.简述本学期从基因组DNA提取到重组质粒鉴定的实验流程? 答:①基因组DNA的提取;②PCR扩增目的基因;③凝胶电泳分离纯化PCR扩增的DNA片段以及DNA的体外连接;④重组质粒的转化及转化子的筛选;⑤重组质粒的抽提;⑥重组质粒的酶切鉴定。 2.如何正确使用微量移液器? 答:①选取合适量程的移液器;②根据取液量设定量程;③安装(吸液)枪头;④按至第一档,将枪头垂直伸入液面下适当位置吸液;⑤按至第二档将液体打入容器;⑥弃掉枪头;⑦将量程调至最大,放回原处。 3.在琼脂糖凝胶电泳点样时,DNA通常和什么试剂混匀,其主要成分和作用是什么? 答:loading Buffer。主要成分为溴酚蓝,二甲苯青和甘油。 溴酚蓝和二甲苯青起指示作用;甘油加大样品密度,从而沉降于点样孔中,以免浮出。 4.简述制作1%的琼脂糖凝胶电泳的操作步骤。 答:①取0.5g琼脂糖置于锥形瓶,量取50ml 1×TBE溶液于瓶中,微波炉加热至琼脂糖溶解;②将移胶板放入胶室中,选取合适梳子垂直安插在移胶板上方,待琼脂降温至55℃下后,缓慢导入该胶室里;③量取合适量1×TBE溶液导入洗净的电泳槽,并正确插好电泳线; ④等凝胶凝固后,将梳子垂直拔出;⑤点样;⑥轻放移胶板至电泳槽的合适位置;⑦打开电泳仪的开关,调好参数,开始电泳;⑧一定时间后,停止电泳,取出凝胶板,然后经BE染色放入成像系统显色、观察。 5.琼脂糖凝胶电泳中DNA分子迁移率受哪些因素的影响?(实验书P75) 答:①样品DNA的大小和构象;②琼脂糖浓度;③电泳电场;④温度;⑤缓冲液;⑥嵌入染料的存在与否; 6.在使用苯酚进行DNA抽提时应注意什么?(实验书P31) 答:注意不要吸取中间的变性蛋白质层。 7.在基因组DNA提取过程中常用酚、氯仿、异戊醇试剂,它们各有什么作用? 答:酚——是蛋白质变性,抑制DNA酶的降解作用;氯仿——除去脂类,同时加速有机相与水相的分层;异戊醇——降低表面张力,从而减少气泡的产生。 8.提取DNA实验中,通常可选用哪些试剂沉淀DNA? 答:冷的无水乙醇、冷的异丙醇、终浓度为0.1~0.25mol/L 的NaCl 9.简述在DNA提取实验中个试剂的作用(SDS,EDTA,酚/氯仿/异戊醇、无水乙醇,70%乙醇)。 答:SDS——破坏细胞膜,解聚核蛋白;EDTA——整合金属离子,抑制DNase活性;酚/氯仿/异戊醇——见第7题;无水乙醇——沉淀DNA;70%乙醇——洗涤DNA沉淀。 10.简述PCR扩增技术的原理及各种试剂的作用(Mg2+,dNTP,引物,DNA,缓冲液,Taq DNA聚合酶)。 答:(1)利用半保留复制的原理,以待扩增的DNA为模板,通过一系列酶在体外引物介导下,
基因工程实验报告
————————————————————————————————作者:————————————————————————————————日期: 2
基因工程实验报告 、
小麦GAPDH截短体的重组与表达 摘要:本实验通过基因工程(genetic engineering)手段对小麦总RNA进行提取、PCR扩增及与质粒载体的重组构建的操作,并将重组质粒以氯化钙法导入大肠杆菌感受态细胞,诱导目的基因表达,并在蛋白水平进行Western检测。通过本对实验的实践,我们对基因工程技术将会有一个比较全面的认识和了解。 关键字:小麦基因;载体;感受态 前言 基因工程(genetic engineering)又称基因拼接技术和DNA重组技术。为在分子水平上对基因进行操作的复杂技术,是将外源基因通过体外重组后导入受体细胞内,使这个基因能在受体细胞内复制、转录、翻译表达的操作。它是用人为的方法将所需要的某一供体生物的遗传物质——DNA大分子提取出来,在离体条件下用适当的工具酶进行切割后,把它与作为载体的DNA分子连接起来,然后与载体一起导入某一更易生长、繁殖的受体细胞中,以让外源物质在其中“安家落户”,进行正常的复制和表达,从而获得新物种的一种崭新技术。它克服了远缘杂交的不亲和障碍。 (一)实验过程
1.实验部分流程: 片段胶 小麦幼苗小麦总RNA RT-PCR扩增小麦pGEX-4T-1 表达载体 表达菌株 目的蛋白 目的蛋白 Western
2.小麦总RNA提取(Trizol法) 2.1 材料 小麦幼苗 2.2 试剂配制及器具处理 ① 0.1%的DEPC H2O(DEPC:焦碳酸二乙酯) ②器具处理:试剂瓶、量筒、研钵、大小枪头和1.5ml和0.2ml 的EP管等用纱布包裹,在 0.1%的DEPC H2O中浸泡过夜(37℃),高压灭菌,80℃烘干备用。剪刀、镊子和药匙等160℃烘烤6h以上。 ③无RNA酶灭菌水(DEPC H2O):用将高温烘烤的玻璃瓶(180℃×2h)装蒸馏水,然后加入 0.1%的DEPC(体积/体积),处理过夜后高压灭菌。 ④Trizol ⑤ 75%乙醇:用新打开的无水乙醇和DEPC处理过的水配制75%乙醇(用高温灭菌器皿配制),然后装入高温烘烤的玻璃瓶中,存放于低温冰箱。 ⑥氯仿(最好用新的)。 ⑦异丙醇(最好用新的)。 2.3 操作步骤: ①先在研钵中加入液氮,再将小麦叶片剪成小段在液氮中磨成粉末,用液氮预冷的药匙取50~100mg组织粉末加入已盛有1ml的Trizol液的EP管中(注意研磨粉末总体积不能超过所用Trizol体积的10%),充分混合均匀。 ②室温放置5min,然后加入200μL的氯仿,盖紧EP管并剧烈摇荡15秒钟。 ③ 12000rpm离心10min,取上层水相于一新的EP管中(千万不要将中间的沉淀层和下层液混入,否则重新离心分离),加入500μL异丙醇,温和颠倒混匀。室温放置10min,12000rpm 离心10min。 ④小心地弃去上清液,加入1ml的75%乙醇,涡旋混匀,4℃下12000rpm离心5min。 ⑤重复步骤④。 ⑥弃去上清液(尽量将残余液体除去),室温或真空干燥5~10min(注意不要干燥过分,否则会降低RNA的溶解度)。用30μL DEPC处理过的水将RNA溶解,必要时可55℃~60℃水浴10min。RNA可进行mRNA分离,或贮存于70%乙醇并保存于-70℃。 3. RT-PCR扩增目的基因cDNA 3.1 试剂 ① RNA模板 ②Olig(dT)18 ③反转录缓冲液 ④dNTP ⑤ M-MULV反转录酶 ⑥ RNA抑制剂(RNasin) ⑦Premix EX Taq DNA聚合酶 ⑧ PCR特异引物 3.2操作步骤: 3.2.1 RNA的反转录 采用Thermo Scientific(Fermentas)RevertAid First Strand cDNA Synthesis Kit Total RNA 6μL(需加入RNA约1μg) OligodT primer 1μL H2O(nuclease-free)5μL 12μL 65℃ 5min,补加下列试剂: 5× Reaction buffer4μL RibolockRNase Inhibitor 1μL 10mM dNTP Mix 2μL RevertAid M-MuLV Reverse Transcriptase 1μL 20μL 42℃ 60min 70℃,5min,﹣20℃保存
基因工程测试题 一、选择题: 1.人的糖蛋白必须经内质网和高尔基体进一步加工合成。通过转基因技术可以使人的糖蛋白基因得以表达的受体细胞是( ) A.大肠杆菌 B.酵母菌 C.肺炎双球菌 D.乳酸菌 2.下列有关基因工程的叙述,正确的是( ) A.DNA连接酶将碱基对之间的氢键连接起来B.目的基因导入受体细胞后,受体细胞即发生基因突变C.限制性核酸内切酶识别序列越短,则该序列在DNA 中出现的几率就越大 D.常用的载体有大肠杆菌、噬菌体和动植物病毒等 3.我国科学家运用基因工程技术,将苏云金芽孢杆菌的抗虫基因导入棉花细胞并成功表达,培育出了抗虫棉。下列叙述不正确的是( ) A.抗虫基因的提取和运输需要专用的工具酶和载体 B.重组DNA 分子中替换一个碱基对,不一定导致毒蛋白的毒性丧失 C.抗虫棉的抗虫基因可通过花粉传递到近缘作物,从而造成基因污染 D.转基因抗虫棉是否具有抗虫特性是通过检测棉花对抗生素抗性来确定的
4.如图是获得抗虫棉的技术流程示意图。卡那霉素抗性基因(kan r)常作为标记基因,只有含卡那霉素抗性基因的细胞才能在卡那霉素培养基 生长。下列叙述正确的是( ) A.构建重组质粒过程中需要限制性核酸内切酶和DNA 连接酶 B.愈伤组织的分化产生了不同基因型的植株 C.卡那霉素抗性基因(kan r)中有该过程所利用的限制性核酸内切酶的识别位点 D.抗虫棉有性生殖后代能保持抗虫性状的稳定遗传 5.上海医学研究所成功培育出第一头携带人白蛋白基因的转基因牛。他们还研究出一种可大大提高基因表达水平的新方法,使转基因动物乳汁中的药物蛋白含量提高30 多倍,以下与此有关的叙述中正确的是( ) A.“转基因动物”是指体细胞中出现了新基因的动物 B.“提高基因表达水平”是指设法使牛的乳腺细胞中含有更多的人白蛋白基因 C.只有从转基因牛乳汁中才能获取人白蛋白,是因为人白蛋白基因只在牛乳腺细胞中含有
基因工程综合实验报告 A型产气荚膜梭菌α毒素基因克隆及表达 班级生物工程081班 姓名盖雪 学号08771029 指导教师高凤山 实验时间2011.10.10-10.14 成绩
一、实验原理 二、主要试剂 DNA Ligation Kit Ver.2.0; Eco RI、Bam HI限制性内切酶;含15%甘油的 0.1mol/L CaCl2,20-30mL。无菌;0.1mol/L CaCl2 , 20-30mL ;50%甘油(无菌,保存菌种用,50mL)4×25mL LB液体培养基(现配现用),卡那霉素(Kan)100mg/mL配2mL(过滤),X-gal 二甲基甲酰胺配成20mg/mL 配2mL; IPTG 24mg/mL, 配2mL(需过滤);蛋白Marker; 0.5M EDTA,pH8.0; 溴化乙锭溶液(EB) (贮存浓度:10mg/mL,使用浓度0.5μg/mL)
三、仪器设备 紫外成像系统,高速冷冻离心机,恒温震荡培养箱,高压灭菌锅,冰箱,水浴锅,微波炉,电炉子,试管架,tube 架,试管,瓶塞,锥形瓶,胶板,电泳槽(包括琼脂糖凝胶和SDS-PAGE),电泳仪,培养皿,移液枪,枪头(各种规格),玻璃涂棒,记号笔,标签纸,卫生纸,水漂(水浴用),试纸,称量纸,一次性手套,酒精灯,火柴,药勺,搅拌子,量筒,烧杯,镊子,tip, tube(1.5mL, 2mL) 五、实验步骤 (一)准备工作 LB培养基配制;LB固体培养基配置;接菌(制备感受态用) 1)LB固体配制 配制固体培养基100mL 加入蒸馏水100mL溶解,用2mol/L NaOH调pH值至7.4,121℃灭菌20min。 灭菌结束后,待温度降至80℃以下时,方能取出,在超净台上,当培养基凉至50-60℃时,迅速加入Kan 30μL(若氨苄,加100ul),摇匀,倒板(4个)。凝固后放入4℃冰箱。 2)LB液体配制 配制100mL液体LB培养基 加入蒸馏水100mL溶解,用2mol/L NaOH调pH值至7.4。 然后分装,每管5mL,每人分装2管,一共12管;另外分装30mL LB与三角瓶中,余下的LB在原三角瓶中与试管等一起高压,121℃,20min。高压后,将剩余三角瓶中的LB分装至1.5mL tube中,每管800μL LB (共10个)。在时间允许的情况下,将高压后的LB试管加入卡那,每管1.5μL。 总结:需要灭菌的东西-液体培养基(试管、30mL三角瓶及剩余液体LB的三角瓶)-固体培养基、离心管(至少30个)、各种规格的枪头。 3)接菌 下午,接种BL21感受态于1管5mL培养基中,37℃震荡培养。 (二)感受态细胞制备、转化、重组菌接种 1)感受态细胞的制备 1.从大肠杆菌DE3平板上挑取一个单菌落接种于5mL LB液体培养基的试管
实验报告 (2013 / 2014 学年第二学期) 课程名称Java语言程序设计 实验名称综合图形界面程序设计 实验时间2014年5月5日 指导单位计算机学院软件教学中心 指导教师薛景 学生姓名臧玉付班级学号12001037 计算机科学与技术学院(系)计算机学院专业 (计算机通信)
2、编写一个简单的计算器软件,实现简单的四则运算。(请在下方空白处填写本程序的全部 ..程序代码及软件界面截图) import java.awt.BorderLayout; import java.awt.GridLayout; import java.awt.event.ActionEvent; import java.awt.event.ActionListener; import javax.swing.JButton; import javax.swing.JFrame; import javax.swing.JPanel; import javax.swing.JTextArea; import javax.swing.JTextField; public class test extends JFrame { private final int BUTTON_WIDTH=50; private final int BUTTON_HEIGHT=40; JButton one=new JButton("1"); JButton two=new JButton("2"); JButton three=new JButton("3"); JButton four=new JButton("4"); JButton five=new JButton("5"); JButton six=new JButton("6"); JButton seven=new JButton("7"); JButton eight=new JButton("8"); JButton nine=new JButton("9"); JButton zero=new JButton("0"); JButton DOT=new JButton("."); JButton ADD=new JButton("+"); JButton SUB=new JButton("-"); JButton MUL=new JButton("*"); JButton DIV=new JButton("/"); JButton EQU=new JButton("=");
《基因工程》实验指导 湖南师范大学生命科学学院 遗传与发育生物学系 2009年5月
基因工程课程综合实验---转基因斑马鱼的构建 一、实验目的 本课程的教学目的是让学生对基因工程技术所涉及的主要环节的基本原理、完整流程和基本技术进行系统地学习和掌握,培养学生具有通过这些原理进行基因工程实验和研究方面的设计能力。在基因工程理论课程的讲授和实践课程的实际操作过程中对学生进行基因操作与社会伦理方面的训练和教育,重在素质和能力的培养。 二、实验原理 转基因动物(transgenic animal)是指动物所有细胞基因组中整合有外源基因的一类动物,具有将外源基因遗传给子代的能力,整入动物基因的外源基因被称为转基因(transgene)。转基因动物技术是常规分子生物学技术的延伸和拓展,是基因工程技术的核心内容之一,它不仅为人们研究生命科学提供了一个更有效的工具,转基因技术是生物学领域最新重大进展之一,已能渗透到生物学、医学、畜牧学等学科的广泛领域。转基因动物已成为探讨基因调控机理、致癌基因作用和免疫系统反应的有力工具。同时人类遗传病的转基因动物模型的建立,为遗传病的基因治疗打下坚实的理论和实验基础。转基因技术涉及外源基因的获取、重组载体的构建与检测鉴定、受体系统的准备、显微注射基因导入、供转基因胚胎发育的体外培养系统和宿主动物的饲养等方面的内容。 三、材料
限制性内切酶:Eco R I、Sal I、Age I、Not I、Bam H I;T4 DNA聚合酶;LA DNA聚合酶混合物均为大连TaKaRa公司产品; 3. 2菌株及细胞系 DH5α感受态细胞:由本实验室自行制备并存于-20℃; 3. 3 质粒与表达载体系统 3. 3.1 pEGFP-N1载体 pEGFP- N1载体是一种把异源性的蛋白质融合至EGFP的N端的哺乳动物表达载体,为Clontech公司的产品。含有人类巨细胞病毒(CMV)启 图1 含有绿色荧光蛋白基因的卡那霉素抗性的pEGFP-N1质粒 动子,SV40 Poly A尾,pUC复制起始点(原核)和SV40复制起始点(真核),20个多克隆位点,具有筛选标志卡那霉素(原核)和新霉素(真核)的抗性基因,见图1。异源性蛋白与EGFP阅读框一致地克隆入pEGFP-N1,形成的表达重组体在CMV启动子启动下,表达EGFP和目标蛋白的融合蛋白。该融合蛋白保持了EGFP的荧光特性,可对融合蛋白进行活细胞内
一、实验名称: 重组DNA技术 二、实验目的: 1.了解掌握DNA重组技术理论基础; 2.掌握质粒载体、外源DNA的准备、酶切、连接技术方法; 3.掌握连接产物的转化方法及操作; 4.掌握阳性重组体的的鉴定和筛选方法; 三、实验原理: 1.重组DNA技术 重组DNA技术是指在体外通过人工“剪切”和“拼接”等方法,对各种生物的核酸(基因)进行改造和重新组合,然后导入微生物或真核细胞内,使重组基因在细胞内表达,产生出人类需要的基因产物,或者改造、创造新特性的生物类型的技术。它主要包括以下几个步骤: ①目的基因的获取:主要有化学合成、PCR、基因组文库、cDNA文库构建等。cDNA文库是以mRNA为模板,利用反转录酶合成与mRNA互补的DNA,再复制成双链cDNA片段,与适当载体连接后转入受体菌,这些受体菌包含了所有cDNA信息,总称cDNA文库。常用于筛选编码蛋白质的结构基因。基因组DNA文库是利用限制性核酸内切酶将组织或细胞染色体DNA切割后,与适当载体连接后转入受体菌,这些受体菌包含了所有基因组DNA信息,因此称为基因组DNA文库。 ②基因载体的选择与构建:常用载体有质粒、噬菌体、病毒DNA等。分为克隆载体和表达载体。克隆载体:用于目的基因的克隆、扩增、序列分析和体外定点突变等。表达载体:用于在宿主细胞中表达外源目的基因,获得大量表达产物。选择好的载体与目的基因利用限制性内切酶切割成合适片段。
③目的基因与载体的拼接:通过粘性末端连接法(同源互补粘性末端连接、非同源互补粘性末端连接)、平端连接、人工接头连接、同聚物接尾、经部分补平的不匹配末端的连接等将目的基因与载体进行连接。 ④重组DNA分子导入受体细胞:将连接有目的DNA的载体导入宿主细胞,主要有以下几种方法:a、转化:将质粒或其它外源DNA导入宿主细胞(常用大肠杆菌),并使其获得新的表型的过程。b、转染:将外源DNA导入真核细胞的过程。c、感染:以λ噬菌体、柯斯质粒和病毒为载体的重组DNA分子,在体外经过包装成具有感染能力的病毒或噬菌体颗粒,才能感染适当的细胞,并在细胞内扩增。 ⑤重组体的筛选:可通过遗传标记如抗药性标志选择、营养缺陷型的互补筛选法及分子标记(PCR、分子杂交)等直接筛选或是根据免疫化学法、酶联免疫检测法等进行间接筛选。 ⑥无性繁殖转化子(含重组分子的受体细胞) ⑦目的基因的表达 2、质粒酶切及鉴定原理 限制性内切酶是一种工具酶,其特点是具有能够识别双链DNA分子上的特异核苷酸序列的能力,能在这个特异性核苷酸序列内,切断DNA双链,形成一定长度的DNA序列。根据限制性内切酶的识别切割特性、催化条件及是否具有修饰酶活性可分为Ⅰ、Ⅱ、Ⅲ三类,II型限制性内切酶只需要二价镁离子的激活,酶在其识别序列内切割双链DNA,产生的各种DNA片段具有相同的末端结构,而且大多数的II型酶可提供粘性未端,有利于片段再连接,限制性内切酶对环状质粒DNA产生的酶切片段数与切口数一致。因此,鉴定酶切后的片段在电泳凝胶的区带数,就可以推断切口的数目;从片段迁移率可判断酶切片段大小。用已知分子量的线状DNA为对照,通过电泳迁移率的比较,可以粗略地测出分子形状相同的未知DNA的相对分子大小。本实验采用的限制性内切酶是Bam HI 和Hind III。 对于DNA回收,回收的目的是为了纯化提取的质粒,以用于以后的分子杂交、重组质粒的构建、序列分析等。目前常用的回收技术有:柱纯化回收法、电洗脱法、低熔点琼脂糖凝胶法、DEAE滤膜插片法等,其中柱纯化回收法、电
实用文档 《数据库系统》实验报告五
实用文档 salary表中表具有查询权限,A.course对A.instructor对设置同学同学2. AB 使用命令检查授权是否成功。B字段具有更新权限;同学grant select on course to cs113; 实用文档
表具有插入数据、删除数据的权限,同对B. instructorB3. 同学授权同学A 用命令试验能否完成相应操作。学Aselect * from cs113.instructor; insert into cs113.instructor values(21313,'JDY','Comp. Sci.',745363); select * from cs113.instructor; cs113.instructor where salary = 92000; delete from select * from cs113.instructor; 实用文档
表具有增、删、改、查的权限,并允许他对B. studentB5. 同学授权同学A并试验能否将权限授予A将权限授权给其它同学。同学验证授权是否成功,。C其它同学(例如同学) 实用文档select * from cs113.student; insert into cs113.student values(13221,'KJDFH','Comp. Sci.',123); update cs113.student set tot_cred = 456 where ID = 13221; select * from cs113.student; delete from cs113.student where ID = 13221; select * from cs113.student;
实验报告模板 不知道如何写实验报告的朋友,下面请看我给大家整理收集的实验报告模板,希望对大家有帮助。 实验报告模板1 一、演示目的 气体放电存在多种形式,如电晕放电、电弧放电和火花放电等,通过此演示实验观察火花放电的发生过程及条件。 二、原理 首先让尖端电极和球型电极与平板电极的距离相等。尖端电极放电,而球型电极未放电。这是由于电荷在导体上的分布与导体的曲率半径有关。导体上曲率半径越小的地方电荷积聚越多(尖端电极处),两极之间的电场越强,空气层被击穿。反之越少(球型电极处),两极之间的电场越弱,空气层未被击穿。当尖端电极与平板电极之间的距离大于球型电极与平板电极之间的距离时,其间的电场较弱,不能击穿空气层。而此时球型电极与平板电极之间的距离最近,放电只能在此处发生。 三、装置 一个尖端电极和一个球型电极及平板电极。 四、现象演示 让尖端电极和球型电极与平板电极的距离相等。尖端电极放电,而球型电极未放电。接着让尖端电极与平板电极之间的距离大于球型电极与平板电极之间的距离,放电在球型电极与平板电极之间发生
雷电暴风雨时,最好不要在空旷平坦的田野上行走。为什么? 实验报告模板2 一、实验目的及要求: 本实例是要创建边框为1像素的表格。 二、仪器用具 1、生均一台多媒体电脑,组建内部局域网,并且接入国际互联网。 2、安装windows xp操作系统;建立iis服务器环境,支持asp。 3、安装网页三剑客(dreamweaver mx;flash mx;fireworks mx)等网页设计软件; 4、安装acdsee、photoshop等图形处理与制作软件; 5、其他一些动画与图形处理或制作软件。 三、实验原理 创建边框为1像素的表格。 四、实验方法与步骤 1) 在文档中,单击表格""按钮,在对话框中将"单元格间距"设置为"1"。 2) 选中插入的表格,将"背景颜色"设置为"黑色"(#0000000)。 3) 在表格中选中所有的单元格,在"属性"面版中将"背景颜色"设置为"白色"(#ffffff)。 4) 设置完毕,保存页面,按下"f"键预览。 五、实验结果
xxxXXXXX 学校XXXX 年学年度第二学期第二次月考 XXX 年级xx 班级 姓名:_______________班级:_______________考号:_______________ 一、选择题 (每空? 分,共? 分) 1、下列有关基因工程和蛋白质工程的叙述,正确的是 A .蛋白质工程的流程和天然蛋白质合成的过程是相同的 B .基因工程合成的是天然存在的蛋白质,蛋白质工程合成的可以不是天然存在的蛋白质 C .基因工程是分子水平操作,蛋白质工程是细胞水平(或性状水平)操作 D .基因工程完全不同于蛋白质工程 2、PCR 是一种体外迅速扩增DNA 片段的技术,下列有关PCR 过程的叙述,不正确的是 A .变性过程中破坏的是DNA 分子内碱基对之间的氢键 B .复性过程中引物与DNA 模板链的结合是依靠碱基互补配对原则完成 C .延伸过程中需要DNA 聚合酶、ATP 、四种核糖核苷酸 D .PCR 与细胞内 DNA 复制相比所需要酶的最适温度较高 3、35.采用基因工程技术将人凝血因子基因导入山羊受精卵,培育出了转基因羊。但是人凝血因子只存在于该转基因羊的乳汁中。下列有关叙述,正确的是( ) A .人体细胞中凝血因子基因的碱基对数目,小于凝血因子氨基酸数目的3倍 B .可用显微注射技术将含有人凝血因子基因的重组DNA 分子导入羊的受精卵 C .在该转基因羊中,人凝血因子基因只存在于乳腺细胞,而不存在于其他体细胞中 D .人凝血因子基因开始转录后,DNA 连接酶以DNA 分子的一条链为模板合成mRNA
4、ch1L基因是蓝细菌拟核DNA上控制叶绿素合成的基因.为研究该基因对叶绿素合成的控制,需要构建该种生物缺失ch1L基因的变异株细胞.技术路线如图所示,对此描述错误的是() 5、下图表示基因工程中目的基因的获取示意图,不正确的是: A、同种生物的基因组文库大于cDNA文库 B、③表示PCR技术,用来扩增目的基因 C、从基因文库中要得到所需目的基因,可根据目的基因的有关信息来获取 D、只要基因的核苷酸序列已知,就只能通过人工合成的方法获取 6、图1表示含有目的基因D的DNA片段长度(bp即碱基对)和部分碱基序 列,图2表示一种质粒的结构和部分碱基序列。现有MspⅠ、BamHⅠ、MboⅠ、SmaⅠ4种限制性核酸内切酶,它们识别的碱基序列和酶切位点分别为:C↓CGG、G↓GATCC、↓GATC、CCC↓GGG。下列分析中正确的是: