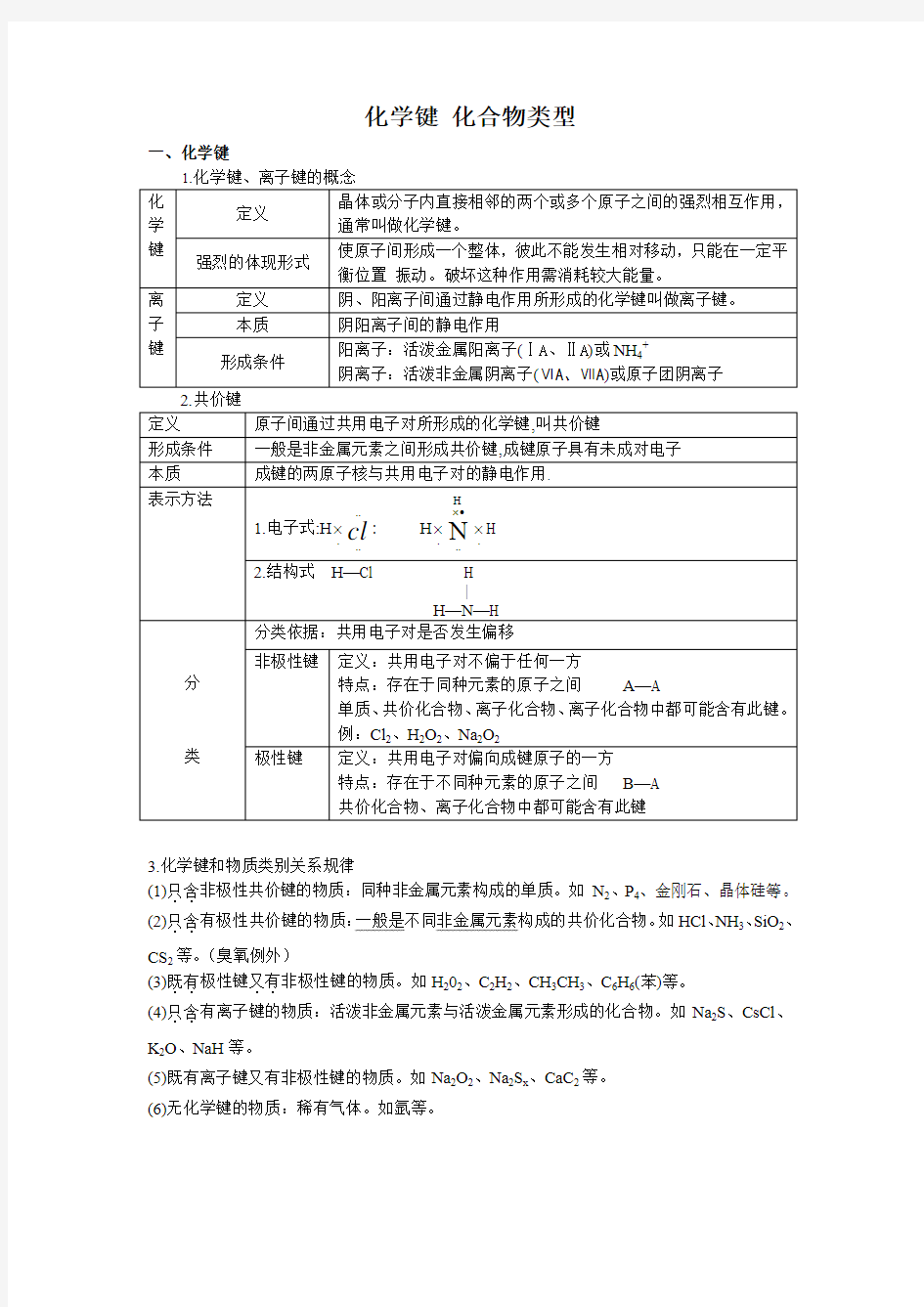

化学键化合物类型
一、化学键
3.化学键和物质类别关系规律
(1)只含
..非极性共价键的物质:同种非金属元素构成的单质。如N2、P4、金刚石、晶体硅等。
(2)只含
..有极性共价键的物质:一般是不同非金属元素构成的共价化合物。如HCl、NH3、SiO2、CS2等。(臭氧例外)
(3)既有
..非极性键的物质。如H202、C2H2、CH3CH3、C6H6(苯)等。
..极性键又有
(4)只含
..有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物。如Na2S、CsCl、K2O、NaH等。
(5)既有离子键又有非极性键的物质。如Na2O2、Na2S x、CaC2等。
(6)无化学键的物质:稀有气体。如氩等。
4.电子式的书写
(1)原子的电子式:在元素符号的周围画小黑点(或×)表示原子的最外层电子。如:
(2)离子的电子式:阳离子的电子式一般用它的离子符号表示;在阴离子或原子团外加方
括弧,并在方括弧的右上角标出离子所带电荷的电性和电量。如:
(3)分子或共价化合物电子
式:正确标出共用电子对数目。
(4)离子化合价电子式,阳离子的外层电子不再标出,只在元素符号右上角标出正电荷,而阴离子则要标出外层电子,并加上方括号,在右上角标出负电荷。阴离子电荷总数与阳离子电荷总数相等,因为化合物本身是电中性的。
(5)用电子式表示单质分子或化合物的形成过程
击破考点:化学键基本概念辨析
例1:关于化学键的下列叙述中,正确的是 ( )
A .离子化合物中可能含有共价键
B .共价化合物中可能含有离子键
C .离子化合物中只含离子键
D .共价键只能存在于化合物中
【变式训练1】下列叙述不正确...
的是 ( ) A .氯化氢溶于水需要破坏化学键 B .Na 2O 2中既含有离子键,又含有非极性键
C .1
1H 、2 1H 、H +、H 2是氢的四种同位素 D .阳离子N 5+中的氮原子间以共价键结合 击破考点:判断物质中所含有的化学键类型,或根据化学键判断化合物类型
例2:下列化合物中既存在离子键,又存在极性键的是
A.H2O B.NH4Cl C.NaOH D.Na2O2
【变式训练1】下列物质中,既含有离子键,又含有非极性共价键的是
A.NaOH B.Na2O2C.CaCI2D.H2O2
【变式训练2】2007年9月,美国科学家宣称:普通盐水在无线电波照射下可燃烧,这伟大的发现,有望解决用水作人类能源的重大问题。无线电频率可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种频率下持续燃烧。上述“结合力”实质是
A.分子间作用力B.氢键C.非极性共价键D.极性共价键击破考点:电子式的书写的考查
例1:下列物质的电子式书写正确的是
A.NaCl B.H2S C.-CH3 D.NH4I
【变式训练1】(2010年上海)下列分子的电子式书写正确的是
【变式训练2】下列电子式书写错误的是
【课堂训练】
1、下列说法正确的是()
A、含有金属元素的化合物一定是离子化合物
B、ⅠA族和ⅦA族原子化合时,一定生成离子键
C、由非金属元素形成的化合物一定不是离子化合物
D、活泼金属与非金属化合时,能形成离子键
2.下列说法正确的是()。
A、含有共价键的化合物一定是共价化合物
B、分子中只有共价键的化合物一定是共价化合物
C、含离子键的化合物一定是离子化合物
D、在共价化合物中也可能含有离子键
3.下列关于化学键的说法正确的是
A.构成单质分子的微粒一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.化合物分子里的化学键一定是极性键
4. .下列化合物中,阳离子与阴离子半径之比最大的是
A.LiCl B.NaBr C.KI D.CaF2
5.在共价化合物中,元素化合价有正负的主要原因是
A.电子有得失
B.共用电子对有偏移
C.电子既有得失又有电子对偏移
D.有金属元素的存在
6.下列说法中正确的是( )
A .以极性键结合起来的分子一定是极性分子
B .失电子难的原子获得电子的能力一定强
C .盐酸中含有H +和Cl -,故HCl 为离子化合物
D .电子层结构相同的不同离子,其半径随核电荷数增多而减小
7.含有下列键型的物质,可能为单质的是( )
A .只有离子键的物质 B.既有离子键,又有非极性键的物质
C .既有极性键,又有离子键的物质 D.只有非极性键的物质
8.下列性质中,可以证明某化合物内一定存在离子键的是( )
A .可溶与水 B.具有较高的熔点
C .水溶液能导电 D.熔融状态能导电
9.下列电子式书写正确的是( )
A . ∶N ∶∶∶N ∶ B.
C . H +[∶O ∶]2-H + D. Na +[∶Cl ∶]-
10.下列电子式中,正确的是 ( )
11.下列物质中,既含有离子键,又含有共价键的是 ( )
12.M 元素的一个原子失去2个电子,该2个电子转移到Y 元素的2个原子中去,形成离子化合物Z ,下列说法中,正确的是
A .Z 的熔点较低
B .Z 可表示为M 2Y
C .Z 一定溶于水中
D .M 形成+2价阳离子
13.下列各数值表示有关元素的原子序数,能以离子键相互结合成稳定化合物的是( )。
A.10与19
B.6与16
C. 11与17
D.14与8
14.下列分子中,① HCl ②H 2O 2 ③NH 4Cl ④Na 2O 2 ⑤KOH ⑥CO 2 ⑦CCl 4 ⑧CH 2Cl 2含有离子键的物质是____ ____,含有极性键和非极性键的物质是_____ ___,由极性键构成的非极性分子是___ _____,含有极性键的极性分子是_____ ___.
‥ ‥ ‥ ‥
15.在短周期元素中,由三种非金属元素组成的既有离子键又有共价键,且阴阳离子含电子总数相等的物质是____________,该物质的电子式是______________________。
16.据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排列成V形。如果5个N结合后都达到8个电子结构,且含有2个氮氮叁键,则“N5”分子碎片所带电荷是,写出它的电子式。
17.己知A、B、C、D是中学化学中常见的四种不同粒子。它们之间存在如下转化关系:
⑴如果A、B、C、D、均是10电子的粒子,请写出:
A的结构式;D的电子式。
⑵如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
①A与B在溶液中反应的离子方程式;
②根据上述离子方程式,可以判断C与B结合质子的能力大小是>.(用化学式或离子符号表示)