配位化合物与配位平衡
- 格式:pdf
- 大小:223.76 KB
- 文档页数:2


化学反应的平衡与配位化合物在化学领域中,反应的平衡以及配位化合物是两个重要的概念。
本文将探讨化学反应平衡和配位化合物的定义、性质以及在实际应用中的重要性。
一、化学反应的平衡化学反应的平衡是指在封闭系统中,反应物与生成物之间的浓度、压力或其他重要参数保持稳定的状态。
达到平衡的反应通常会出现正向反应和逆向反应同时进行,并且反应速率相等。
根据勒夏特列现象,当达到平衡时,反应物与生成物的浓度比例将会保持不变。
平衡常数是衡量平衡体系中物质浓度变化程度的指标。
对于一般的化学反应aA + bB ↔ cC + dD,平衡常数Kc的表达式为:Kc =[C]^c[D]^d / [A]^a[B]^b。
平衡常数的数值越大,说明反应向生成物方向偏移的程度越大。
平衡常数的大小受到温度的影响,根据热力学原理,温度升高有助于平衡常数的增大。
平衡常数对反应条件的敏感性使得工业上可以通过调节温度、压力或浓度等因素来控制化学反应的平衡。
二、配位化合物配位化合物是指由一个或多个配体与中心金属离子通过配位键构成的化合物。
配体是指能够通过一个或多个孤对电子与中心金属离子形成配位键的化合物,如氨、水、氯等。
配位化合物具有许多独特的性质和应用。
首先,配位化合物通常具有显著的颜色。
这是由于配体与中心金属离子之间的电荷转移引起的。
其次,配位化合物可以形成稳定的络合物,增加了化学反应的速率和选择性。
最后,配位化合物在生物学、医药和工业等领域具有广泛的应用,例如催化剂、药物和材料等。
三、平衡反应中的配位化合物在一些反应中,平衡态下的配位化合物起到了重要的作用。
例如,氨合铜离子与水合铜离子在溶液中可以互相转化。
这个平衡反应可以表示为:[Cu(NH3)4]2+ + 4H2O ↔ [Cu(H2O)4]2+ + 4NH3。
在该反应中,氨和水是配体,铜离子是中心金属离子。
根据反应平衡原理,当反应达到平衡时,配体和中心金属离子的浓度比例将保持不变。
通过控制反应温度、溶液pH值和浓度等因素,可以调节氨合铜离子和水合铜离子之间的转化比例。
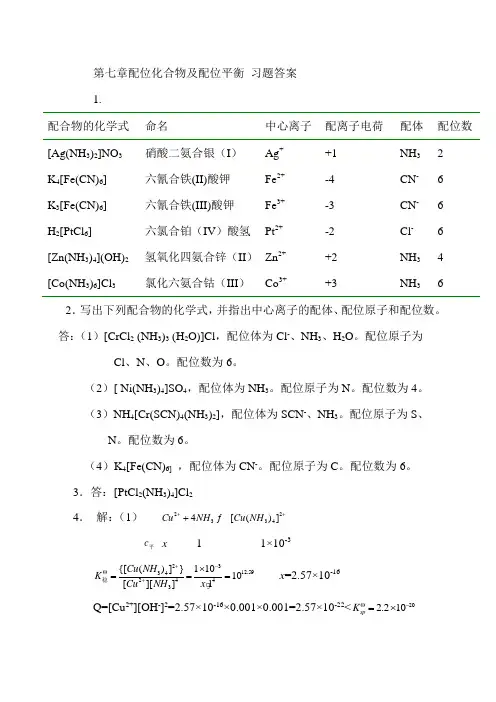
第七章配位化合物及配位平衡 习题答案 1.配合物的化学式 命名 中心离子 配离子电荷 配体 配位数 [Ag(NH 3)2]NO 3 硝酸二氨合银(I ) Ag + +1 NH 3 2 K 4[Fe(CN)6] 六氰合铁(II)酸钾 Fe 2+ -4 CN - 6 K 3[Fe(CN)6] 六氰合铁(III)酸钾Fe 3+-3 CN - 6 H 2[PtCl 6] 六氯合铂(IV )酸氢 Pt 2+ -2 Cl - 6 [Zn(NH 3)4](OH)2 氢氧化四氨合锌(II ) Zn 2+ +2 NH 3 4 [Co(NH 3)6]Cl 3氯化六氨合钴(III )Co 3++3NH 362.写出下列配合物的化学式,并指出中心离子的配体、配位原子和配位数。
答:(1)[CrCl 2 (NH 3)3 (H 2O)]Cl ,配位体为Cl -、NH 3、H 2O 。
配位原子为Cl 、N 、O 。
配位数为6。
(2)[ Ni(NH 3)4]SO 4,配位体为NH 3。
配位原子为N 。
配位数为4。
(3)NH 4[Cr(SCN)4(NH 3)2],配位体为SCN -、NH 3。
配位原子为S 、N 。
配位数为6。
(4)K 4[Fe(CN)6] ,配位体为CN -。
配位原子为C 。
配位数为6。
3.答:[PtCl 2(NH 3)4]Cl 24. 解:(1) 223344[()]Cu NH Cu NH +++ c 平 x 1 1×10-32312.59342443{[()]}11010[][]1Cu NH K Cu NH x +-Θ+⨯=== 稳x =2.57×10-16 Q=[Cu 2+][OH -]2=2.57×10-16×0.001×0.001=2.57×10-22<202.210sp K Θ-=⨯无沉淀。
(2) Q=[Cu 2+][S 2-]=2.57×10-16×0.001=2.57×10-19>366.310sp K Θ-=⨯,有沉淀。

第 4 章配合物[ 教学要求]1 .掌握配位化合物的基本概念,组成,命名,分类。
2 .掌握配位化合物价键理论和晶体场理论的基本内容。
[ 教学重点]1 .配合物的异构问题2 .配合物的价键理论[ 教学难点]配合物的几何异构和对映异构[ 教学时数] 4 学时[ 主要内容]1 .配位化合物的基本概念:什么叫配合物,组成,命名。
2 .配合物的价键理论:配合物的立体结构和几何异构,配合物类型简介(简单配离子、螯合物、多核配合物)。
3 .晶体场理论要点:简介d 轨道的能级分裂和晶体场效应:八面体场的分裂、四面体场的分裂、平面四边形场的分裂;分裂能和影响分裂能的因素,稳定化能;晶体场理论对配合物性质的解释(颜色、磁性)。
[ 教学内容]4-1 配合物的基本概念“科学的发生和发展一开始就是由生产所决定的”。
配合物这门科学的诞生和发展,也是人类通长期过生产活动,逐渐地了解到某些自然现象和规律,加以总结发展的结果。
历史上有记载的最早发现的第一个配合物就是我们很熟悉的亚铁氰化铁Fe4[Fe(CN)6]3 ( 普鲁士蓝) 。
它是在1704 年普鲁士人狄斯巴赫在染料作坊中为寻找蓝色染料,而将兽皮、兽血同碳酸纳在铁锅中强烈地煮沸而得到的。
后经研究确定其化学式为Fe4[Fe(CN)6]3。
近代的配合物化学所以能迅速地发展也正是生产实际需要的推动结果。
如原子能、半导体、火箭等尖端工业生产中金属的分离楼术、新材料的制取和分析;50 年代开展的配位催比,以及60 年代蓬勃发展的生物无机化学等都对配位化学的发展起了促进作用。
目前配合物化学已成为无机化学中很活跃的一个领域。
今后配合物发展的特点是更加定向综合,它将广泛地渗透到有机化学、生物化学、分析化学以及物理化学、量子化学等领域中去。
如生物固氮的研究就是突出的一例。
4-1-1 配合物的定义当将过量的氨水加入硫酸铜溶液中,溶液逐渐变为深蓝色,用酒精处理后,还可以得到深蓝色的晶体,经分析证明为[Cu(NH3)4]SO4。



姓名:学号:班级:一、实验目的1.拿握配合物的生成和离解,以及配离子与简单离子的区别。
2.加深理解配合物的组成和稳定性,了解配合物形成时的特征。
3.加深理解沉淀溶解平衡和溶度积的概念,掌握溶度积规则及其应用4.学习利用沉淀反应和配位溶解的方法分离常见混合阳离子5.学习离心机的使用和固液分离的操作方法二、实验原理1.配位化合物与配位平衡配位化合物(简称配合物)的组成一般可分为内界和外界两个部分,中心离子与一定数目的配位体组成配合物的内界(一般为配离子或分子配合物除中心离子和配位体以外的部分为外界。
内界和外界以离子键结合,在水溶液中完全解离而配离子很稳定,在水溶液中像弱电解质一样分步解离,即配离子在溶液中存在着配合和解离平衡。
可用稳定常数K来描述配离子的稳定性。
对于相同类型的配离子,K数值愈大,配离子就愈稳定。
和所有化学平衡一样,当条件改变时,配位平衡会发生移动。
当简单离子(或化合物)形成配离子(或配合物)后,其某些性质会发生改变,如颜色、溶解性、酸性以及氧化还原性等。
在水溶液中,配合物的生成反应主要有配位体的取代反应和加合反应。
整合物又称内配合物,它是由中心离子和多基配位体配合而成的具有环状结构的配合物,它比一般的配合物稳定,很多金属整合物具有特征的颜色。
整合物的环上有几个原子,就称为几元环。
一般五元环和六元环的整合物比较稳定2.沉淀溶解平衡在含有难溶电解质(AB)晶体的饱和溶液中,难溶电解质与溶液中相应离子间的平衡称为沉淀溶解平衡。
在一定的温度下,沉淀的生成或溶解可以根据溶度积规则来判断。
当体系中离子浓度的幂的乘积大于溶度积数,即Q>K二时有沉淀生成,平衡向左移动:当<K时,无沉淀生成,或平衡向右移动,原来的沉淀溶解:当QK二时,处于平衡状态,溶液为饱和溶液。
设法降低难溶电解质溶液中某一相关离子的浓度可以将沉淀溶解,溶解沉淀的常见方法有酸、碱溶解法,氧化还原溶解法,配位溶解法,沉淀转化溶解法和多元溶解法等。

配位化合物之配位平衡习题目录一判断题;二选择题;三填空题;四计算和回答问题一判断题(返回目录)1 在1.0L0.10mol·L-1[Ag(NH3)2]Cl溶液中,通入2.0molNH3(g)达到平衡时各物质浓度大小的关系是c(NH3)>c(Cl-)≈c([Ag(NH3)2]+)>c(Ag+)。
()2 某配离子的逐级稳定常数分别为K、K、K、K,则该配离子的不稳定常数K=K·K·K·K。
()3 某配离子的逐级不稳定常数分别为K、K、K、K,则该配离子总的稳定常数K=1/(K·K·K·K)。
()4 在1.0L6.0mol·L-1氨水溶液中溶解0.10molCuSO4固体,假定Cu2+全部生成[Cu(NH3)4]2+,则平衡时NH3的浓度至少为5.6mol·L-1。
()5 金属离子A3+、B2+可分别形成[A(NH3)6]3+和[B(NH3)6]2+,它们的稳定常数依次为4⨯105和2⨯1010,则相同浓度的[A(NH3)6]3+和[B(NH3)6]2+溶液中,A3+和B2+的浓度关系是c(A3+)>c(B2+)。
()6 已知[HgCl4]2-的K=1.0⨯10-16,当溶液中c(Cl-)=0.10mol·L-1时,c(Hg2+)/c([HgCl4]2-)的比值为1.0⨯10-12。
()7 对于电对Ag+/Ag来说,当Ag(Ⅰ)生成配离子时,Ag的还原性将增强。
()8 对于电对Cu2+/Cu来说,当Cu(Ⅱ)生成配离子时,Cu(Ⅱ)的氧化性将增强。
()9 在某些金属的难溶盐中,加入含有可与该金属离子配位的试剂时,有可能使金属难溶盐的溶解度增大。
()10 所有物质都会因生成某一配合物而使溶解度增大。
()11 所有配合物在水中都有较大的溶解度。
()12 在含有少量AgCl沉淀的溶液中,加入适量的氨水,可以使AgCl溶解,如果再加入适量的HNO3溶液,又可看到AgCl沉淀生成。