《配位化合物与配位滴定法》习题答案
- 格式:doc
- 大小:171.00 KB
- 文档页数:8

第六章配位滴定法计算pH=5时EDTA的酸效应系数αY(H)。
若此时EDTA各种存在形式的总浓度为·L-1,则[Y4-]为多少pH=5时,锌和EDTA配合物的条件稳定常数是多少假设Zn2+和EDTA的浓度皆为10-2 mol·L-1(不考虑羟基配位等副反应)。
pH=5时,能否用EDTA标准溶液滴定Zn2+假设Mg2+和EDTA的浓度皆为10-2 mol·L-1,在pH=6时,镁与EDTA配合物的条件稳定常数是多少(不考虑羟基配位等副反应)并说明在此pH条件下能否用EDTA 标准溶液滴定Mg2+。
如不能滴定,求其允许的最小pH。
试求以EDTA滴定浓度各为mol·L-1的Fe3+和Fe2+溶液时所允许的最小pH。
计算用mol·L-1 EDTA标准溶液滴定同浓度的Cu2+离子溶液时的适宜酸度范围。
称取0.1005g纯CaCO3溶解后,用容量瓶配成100mL溶液。
吸取25mL,在pH﹥12时,用钙指示剂指示终点,用EDTA标准溶液滴定,用去。
试计算:(1)EDTA溶液的浓度;(2)每毫升EDTA溶液相当于多少克ZnO和Fe2O3。
用配位滴定法测定氯化锌(ZnCl2)的含量。
称取0.2500g试样,溶于水后,稀释至250mL,吸取,在pH=5~6时,用二甲酚橙作指示剂,用mol·L-1 EDTA标准溶液滴定,用去。
试计算试样中含ZnCl2的质量分数。
称取1.032g氧化铝试样,溶解后移入250mL容量瓶,稀释至刻度。
吸取,加入T Al2O3=mL的EDTA标准溶液,以二甲酚橙为指示剂,用Zn(OAc)2标准溶液进行返滴定,至红紫色终点,消耗Zn(OAc)2标准溶液。
已知1mL Zn(OAc)2溶液相当于EDTA溶液。
求试样中Al2O3的质量分数。
用mol·L-1 EDTA标准溶液滴定水中钙和镁的含量,取水样,以铬黑T为指示剂,在pH=10时滴定,消耗EDTA 。

第六章 配位滴定法思考题与习题1.简答题:(1)何谓配位滴定法?配位滴定法对滴定反应有何要求?答:以配位反应为基础的地点分析方法称为配位滴定法。
配位滴定法要求配位反应按一定的反应式定量进行,且能进行完全;反应必须迅速;可以用适当的方法确定终点。
(2)EDTA 与其金属离子配合物的特点是什么?答:E DT A具有广泛的配位性能;EDTA 与金属离子配位时可生成的螯合物稳定性高,配位反应的完全程度高;E DTA 与金属离子形成配位化合物的配位比几乎均为1:1;ED TA 与金属离子形成的配合物大多能溶于水;配位反应迅速;EDTA 与无色离子形成的配合物也无色,便于用指示剂确定终点。
(3)配位滴定可行性的判断条件是什么?答:MYM K c lg ≥6 (4)配位滴定中可能发生的副反应有哪些?从理论上看,哪些对滴定分析有利?答:配位滴定副反应包括:EDTA 的酸效应,金属离子的水解效应,金属离子与其他配位剂的配位反应,干扰离子效应,配合物与氢离子、氢氧根离子的副反应等。
配合物与氢离子、氢氧根离子的副反应对滴定分析有利。
(5)何谓指示剂的封闭现象?怎样消除封闭?答:如果指示剂与某些金属离子形成的配位化合物极其稳定,以至于加入过量的滴定剂也不能将金属离子从金属-指示剂配合物中夺取出来,溶液在化学计量点附近就没有颜色变化,这种现象称为指示剂受到了封闭。
可加掩蔽剂消除指示剂的封闭现象。
(6)提高配位滴定选择性的条件与措施有哪些?答:1)控制酸度;2)分别采用配位掩蔽法、沉淀掩蔽法、氧化还原掩蔽法掩蔽干扰离子;3)分离干扰离子。
2.名词解释(1)酸效应答:由于H +的存在使配位剂参加主反应能力降低的现象。
(2)酸效应系数答:定量表示酸效应进行的程度的系数称为酸效应系数。
(3) 配位效应答:由于存在其他配位剂L 与金属离子M 配位使金属离子参加主反应能力降低的现象。
(4)配位效应系数答:定量表示配位效应进行的程度的系数称为配位效应系数。

第八章配位化合物与配位滴定法【知识导航】本章知识在《中国药典》(2010年版)中主要应用于含金属离子药物的含量测定,以配位反应为基础的滴定分析法。
目前多用氨羧配位剂为滴定液,其中以乙二胺四醋酸(EDTA)应用最广。
《中国药典》中使用直接滴定法对葡萄糖酸钙、葡萄糖酸钙口服液、葡萄糖酸钙含片、葡萄糖酸钙注射剂、葡萄糖酸钙颗粒、葡萄糖酸锌、葡萄糖酸锌口服液、葡萄糖酸锌片、葡萄糖酸锌颗粒进行含量测定;使用间接滴定法对氢氧化铝、氢氧化铝片、氢氧化铝凝胶进行含量测定。
在历年执业药师考试中也有相关考题出现。
学好本章内容有利于掌握配位滴定法的原理、配位滴定法在药物分析中的应用以及备战执业药师考试。
【重难点】1.配位化合物(coordination compound)简称配合物,以具有接受电子对的空轨道的原子和离子为中心(中心离子),与一定数量的可以给出电子对的离子或分子(配体)按一定的组成和空间构型形成的化合物。
配位键的形成:中心离子(原子)提供空轨道,配位体上的配位原子提供孤对电子。
例如:[Cu(NH3)4]SO4、K3[Fe(NCS)6]等。
这些化合物与简单的化合物区别在于分子中含有配位单元,而简单化合物中没有这些配位单元。
以[Cu(NH3)4]SO4为例:[Cu (NH3)4 ] SO4↓ ↓↓内界配体外界配位体中提供孤电子对的,与中心离子以配位键结合的原子称为配位原子。
一般常见的配位原子是电负性较大的非金属原子。
常见配位原子有C、N、O、P及卤素原子。
由于不同的配位体含有的配位原子不一定相同,根据一个配位体所提供的配位原子的数......目.,可将配位体分为单齿配位体(unidentate ligand)和多齿配位体(multidentate ligand)。
只含有一个配位原子配位体称单齿配位体如H2O、NH3、卤素等。
有两个或两个以上的配位原子配位体称多齿配位体,如乙二胺NH2一CH2一CH2一NH2(简写为en),草酸根C2O42-(简写为ox)、乙二胺四醋酸根(简称EDTA)等。
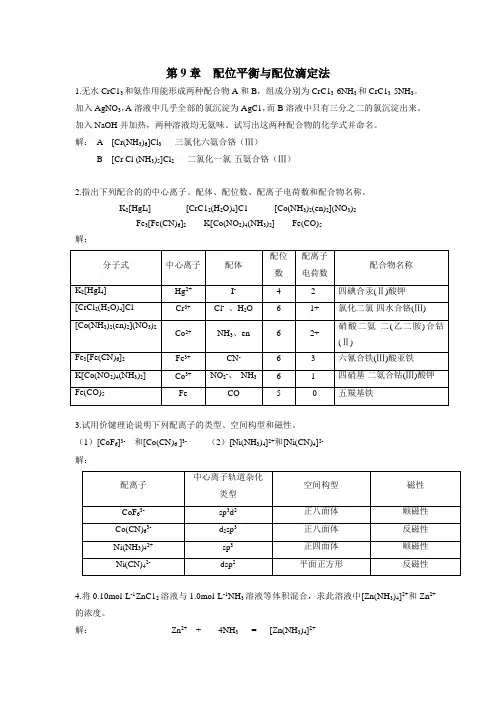
第9章配位平衡与配位滴定法1.无水CrC13和氨作用能形成两种配合物A和B,组成分别为CrC13·6NH3和CrC13·5NH3。
加入AgNO3,A溶液中几乎全部的氯沉淀为AgC1,而B溶液中只有三分之二的氯沉淀出来。
加入NaOH并加热,两种溶液均无氨味。
试写出这两种配合物的化学式并命名。
解:A [Cr(NH3)6]Cl3三氯化六氨合铬(Ⅲ)B [Cr Cl (NH3)5]Cl2二氯化一氯·五氨合铬(Ⅲ)2.指出下列配合的的中心离子、配体、配位数、配离子电荷数和配合物名称。
K2[HgI4] [CrC12(H2O)4]C1 [Co(NH3)2(en)2](NO3)2Fe3[Fe(CN)6]2K[Co(NO2)4(NH3)2] Fe(CO)5解:3.试用价键理论说明下列配离子的类型、空间构型和磁性。
(1)[CoF6]3-和[Co(CN)6 ]3- (2)[Ni(NH3)4]2+和[Ni(CN)4]2-解:4.将0.10mol·L-1ZnC12溶液与1.0mol·L-1NH3溶液等体积混合,求此溶液中[Zn(NH3)4]2+和Zn2+的浓度。
解:Zn2++ 4NH3= [Zn(NH3)4]2+平衡浓度/mol·L -1 x 0.5-4×0.05+4x ≈0.3 0.05-x ≈0.0594342243109230050⨯=⋅==++..x .)NH (c )Zn (c ))NH (Zn (c K f θx =c(Zn 2+)=2.13×10-9mol·L -15.在100mL0.05mol·L -1[Ag(NH 3)2]+溶液中加入1mL 1mol·L -1NaC1溶液,溶液中NH 3的浓度至少需多大才能阻止AgC1沉淀生成?解: [Ag(NH 3)2]++Cl - = AgCl + 2NH 3 平衡浓度/mol·L -1 0.05 0.01 c(NH 3)107233210771101111-+-⨯⨯⨯===..K K ))NH (Ag (c )Cl (c )NH (c K sp f j 11073510107711011010050--⋅=⨯⨯⨯⨯=Lmol .....)NH (c6.计算AgC1在0.1mol·L -1氨水中的溶解度。

第五章配位滴定法习题答案练习题答案1. __________________________________________________ EDTA与金属离子形成螯合物时,其螯合比一般为____________________________ 。
(1:1)2. ___________________________________________________ EDTA与金属离子络合时,一分子的EDTA可提供_____________________________ 配位原子。
(6)3. 在非缓冲溶液中,用EDTA滴定金属离子时溶液的pH值将降低4. 当M与丫反应时,溶液中有另一络合剂L存在,若M(L)=1表示 ___________ 0 (M 与L没有副反应)5. 两种金属离子M和N共存时,只有稳定常数的差值满足△Igk》5时才可用控制酸度的方法进行分别滴定6. 以下表达式中正确的是:(B)A K MY ' =MY/C M C YB K MY ' =[MY' ]/([M]+ [ML i])( [Y]+ [H i Y])C K MY ' =[MY' ]/([MY]+ [ML i])( [Y]+ [H i Y])D K MY ' =[MY]/([M]+ [ML i])( [Y]+ [H i Y]+[MY])7. 在pH = 10.0 的氨性溶液中,已计算出Zn(NH3) = 104'7,Zn(OH) = 102'4,Y(H)=10°5,已知lgK znY=16.5;在此条件下,IgK znY'为 ____________ 。
(11.3)8. 络合滴定中,若封闭现象是由被测离子引起的,则可米用回滴定法进行9. 络合滴定法直接滴定Zn2+,铬黑T In-作指示剂,其滴定终点所呈现的颜色实际上是:(D)A. ZnIn的颜色B. In-的颜色C. ZnY的颜色D. ZnIn和In-的颜色10.在EDTA法中,当MIn溶解度较小时,会产生( B )A 封闭现象B僵化现象C掩蔽现象 D 络合效应和酸效应11.当K MIn>K MY时,易产生(A )A 封闭现象B僵化现象C掩蔽现象 D 络合效应和酸效12.下列指示剂中,全部适用于络合滴定的一组是:(C)A 甲基橙、二苯胺磺酸钠、EBTB 酚酞、钙指示剂、淀粉C 二甲酚橙、铬黑T、钙指示剂D PAN、甲基红、铬酸钾13.在金属离子M和N等浓度的混合液中,以HIn为指示剂,用EDTA标准溶液直接滴定其中的M,要求(C)A pH=pK' MYB K' MY<K' MInC lgK MY HgK NY 514.在氨性缓冲液中,用( D)A [Zn2+]=[Y 4-]C [Zn2+]2=[ZnY]/K ZnYD NIn 和HIn 的颜色应有显著差别EDTA滴定乙门2+至化学计量点时,以下关系正确的是:B [Zn2+‘]=[Y '] D [Zn '2+]2=[ZnY]/K 'ZnY15.在pH=5.0 的乙酸缓冲溶液中,用0.002mol/L 的EDTA 滴定同浓度的Pb2+ 已知( B )lgK pbY=18.0, lg Y(H)=6.6, lg Pb(Ac)=2.0,在化学计量点时,溶液中pPb'值应为A 8.2 B 6.2 C 5.2 . D 3.216 .在pH=10.0的氨性缓冲溶液中,以0.01mol/LEDTA滴定同浓度Zn2+溶液两份。


配位化合物与配位滴定法一、单项选择题:1.配位化合物中一定含有:A、金属键B、离子键C、氢键D、范德华作用力E、配位键2.在[Co(en)2Cl2]Cl中,中心原子的配位数是:A、2B、4C、5D、6E、33.K4[Fe(CN)6]中配离子电荷数和中心原子的氧化数分别为:A、-2,+4B、-4,+2C、+3,-3D、-3,+3E、+2,-34.K4[HgI4]的正确命名是:A、碘化汞钾B、四碘化汞钾C、四碘合汞(Ⅱ)酸钾D、四碘一汞二钾E、四碘合汞(Ⅱ)化钾5.配位滴定中为维持溶液的pH在一定范围内需加入:A、酸B、碱C、盐D、缓冲溶液E、胶体溶液6.下列物质中,能做螯合剂的是:A、NH3B、HCNC、HClD、EDTAE、H2O7.在EDTA的各种存在形式中,直接与金属离子配位的是:A、Y8.在Cu4B、H6Y2C、H4YD、H2Y2E、H3Y24NH3==[Cu(NH3)4]2平衡体系中加稀HCl,可产生的结果是:A、沉淀析出B、配离子解离C、有NH3放出D、颜色加深E、平衡不受影响9.在pH>11的溶液中,EDTA的主要存在形式是:A、Y4B、H6Y22C、H4YD、H2Y2E、H3Y210.在Cu2、Mg混合液中,用EDTA滴定Cu,要消除Mg2的干扰,宜采用:A、控制酸度法B、沉淀掩蔽法C、配位掩蔽法D、氧化还原掩蔽法E、解蔽法11.在pH<1的溶液中,EDTA的主要存在型体是A、H6Y2B、H2Y2C、H4YD、H3YE、Y412.在pH=10氨的缓冲溶液中,以EBT为指示剂,可用EDTA直接滴定的是A、Fe3+B、Al3+C、Hg2+D、Bi3+E、Mg2+13.对金属指示剂叙述错误的是A、指示剂本身颜色与其生成的配位物颜色应显著不同B、指示剂应在一适宜pH范围内使用C、MIn稳定性要略小于MY的稳定性D、MIn的稳定性要大于MY的稳定性E、指示剂与金属离子的显色反应有良好的可逆性14.EDTA滴定Ca2+、Mg2+总量时,以EBT作指示剂,指示终点颜色的物质是A、Mg-EBTB、Ca-EBTC、EBTD、MgYE、CaY15.EDTA在酸度很高的水溶液中的主要型体是A、H2Y2B、H6Y16.有关EDTA叙述正确的是A、EDTA在溶液中总共有7种型体存在B、EDTA是一个二元有机弱酸C、在水溶液中EDTA一共有5级电离平衡D、EDTA不溶于碱性溶液中E、EDTA易溶于酸性溶液中17.以二甲酚橙为指示剂,用EDTA直接滴定金属离子时终点颜色变化应为A、由无色变为红色B、由红色变蓝色C、由蓝色变亮黄色D、由红色变亮黄色E、由亮黄色变无色18.EDTA不能直接滴定的金属离子是A、Fe3+B、Na+C、Zn2+D、Mg2+E、Ca2+19.配位滴定中溶液酸度将影响A、EDTA的离解B、金属指示剂的电离C、金属离子的水解D、A+CE、A+B+C20.用EDTA返滴定法测Al3+时,以二甲酚橙为指示剂,调节溶液pH 的是A、NH3·H2O~NH4ClB、HClC、HAc~NaAcD、NaOHE、HNO321.EDTA与无色金属离子生成的配位物颜色是A、颜色加深B、无色C、紫红色D、纯蓝色E、亮黄色22.EDTA与有色金属离子生成的配位物颜色是A、颜色加深B、无色C、紫红色D、纯蓝色E、亮黄色2C、H5YD、H3YE、Y423.EDTA与金属离子刚好能生成稳定的配合物时溶液的酸度称为A、最佳酸度B、最高酸度C、适宜酸度D、水解酸度E、最低酸度24.标定EDTA滴定液的浓度应选择的基准物质是A、氧化锌B、硼砂C、邻苯二甲酸氢钾D、碳酸钠E、重铬酸钾25.下列关于条件稳定常数叙述正确的是A、条件稳定常数是经副反应系数校正后的实际稳定常数B、条件稳定常数是经酸效应系数校正后的实际稳定常数C、条件稳定常数是经配位效应系数校正后的实际稳定常数D、条件稳定常数是经水解效应数校正后的实际稳定常数E、条件稳定常数是经最低pH校正后的实际稳定常数26.配位滴定中能够准确滴定的条件是6A、配位物稳定常数KMY>108B、配位物条件稳定常数K′MY>108C、配位物稳定常数KMY≥106D、配位物条件稳定常数K′MY≥108E、配位物条件稳定常数K′MY=1027.影响配位滴定突跃大小的因素是A、配位物条件稳定常数B、金属离子浓度C、金属指示剂D、A+BE、A+B+C28.铬黑T指示剂在纯水中的颜色是A、橙色B、红色C、蓝色D、黄色E、无色29.EDTA中含有配位原子的数目的是A、2个氨基氮B、8个羧基氧原子C、4个羧基氧原子D、2个氨基氮与8个羧基氧原子共10个E、2个氨基氮与4个羧基氧原子共6个30.乙二胺四乙酸二钠盐的分子简式可以表示为-A、Na2Y2B、H4YC、Na2H4Y2+D、Na2H2Y·2H2OE、H6Y2+31.用ZnO标定EDTA溶液浓度时,以EBT作指示剂,调节溶液酸度应用A、六次甲基四胺B、氨水C、氨-氯化铵缓冲溶液D、A+BE、B+C32.EDTA滴定Ca2+时,以铬黑T为指示剂,则需要加入少量镁盐,是因为A、为使滴定反应进行完全B、为使CaY的稳定性更高C、为使终点显色更加敏锐D、为使配位物CaIn更加稳定E、为了控制溶液的酸度二、多项选择题1.对金属指示剂叙述错误的是:A、MIn的变色原理与酸碱指示剂相同B、指示剂应在一适宜的pH范围内使用C、MIn的稳定性要大于MY100倍D、MIn的稳定性要小于MY100倍E、指示剂本身颜色与其生成的配合物颜色明显不同2.有关酸效应的叙述正确的是:A、pH越大,酸效应系数越大B、pH越大,酸效应系数越小C、酸效应系数越大,配合物越稳定D、酸效应系数越大,配合物越不稳定E、酸效应系数越大,配位滴定的突跃范围越大3.下列说法正确的是:A、配位数就是配位体的数目B、只有金属离子才能做中心原子C、配合物中内界与外界电荷的代数和为零D、配离子电荷数等于中心原子的电荷数E、配合物中配位键的数目称为配位数4.下列物质中,配位数为六的配合物是:A、[CaY]2-B、[FeF6]3-C、[Ag(CN)2]-D、[Zn(NH3)4]2-E、[Ni(CN)4]2-5.标定EDTA滴定液常用的基准物是:A、ZnB、K2Cr2O7C、ZnOD、AgNO3E、Na2CO36.影响条件稳定常数大小的因素是:A、配位物稳定常数B、酸效应系数C、配位效应系数D、金属指示剂E、掩蔽剂7.影响配位滴定中pM’突跃大小的因素有:A、配位物稳定常数B、金属离子浓度C、溶液的pH值D、其他配位剂E、解蔽剂8.EDTA与大多数金属离子反应的优点是:A、配位比为1:1B、配合物稳定性很高C、配合物水溶性好D、选择性差E、配合物均无颜色9.配位滴定中,消除共存离子干扰的方法有:A、控制溶液酸度B、使用沉淀剂C、使用配位掩蔽剂D、使用解蔽剂E、使用金属指示剂10.EDTA不能直接滴定的金属离子是:A、Fe3+B、Al3+C、Na+D、Mg2+E、Ag+三、判断题:1.EDTA滴定中,金属离子开始水解时的pH值称为最小pH。

配位滴定法练习题一、选择题1、某溶液主要含有Ca2+、Mg2+及少量Fe3+、Al3+,今在pH=10的加入三乙醇胺,以EDTA滴定,用铬黑T为指示剂,则测出的是()A、Mg2+量B、Ca2+量C、Ca2+、Mg2+总量D、Ca2+、Mg2+、Fe3+、Al3+总量2、准确滴定单一金属离子的条件是()A、lgc M K′MY≥8B、lgc M K MY≥8C、lgc M K′MY≥6D、lgc M K MY≥63、在配位滴定中,直接滴定法的条件包括()A、lgcK'MY≤ 8B、溶液中无干扰离子C、有变色敏锐无封闭作用的指示剂D、反应在酸性溶液中进行4、EDTA 滴定Zn2+时,加入NH3-NH4Cl可()A、防止干扰B、控制溶液的pH值C、使金属离子指示剂变色更敏锐D、加大反应速度5、取水样100mL,用C(EDTA)=0.02000mol/L,标准溶液测定水的总硬度,用去4.00毫升,计算水的总硬度是( )(用CaCO3 mg/L表示)A、20mg/LB、40 mg/LC、60 mg/LD、80mg/L6、配位滴定终点所呈现的颜色是()A、游离金属指示剂的颜色B、EDTA与待测金属离子形成配合物的颜色C、金属指示剂与待测金属离子形成配合物的颜色D、上述A与C的混合色7、在EDTA配位滴定中,下列有关酸效应系数的叙述,正确的是()A、酸效应系数越大,配合物的稳定性愈大B、酸效应系数越小,配合物的稳定性愈大C、pH值愈大,酸效应系数愈大D、酸效应系数愈大,配位滴定曲线的pM突跃范围愈大8、以配位滴定法测定Pb2+时,消除Ca2+、Mg2+干扰最简便的方法是()A、配位掩蔽法B、控制酸度法C、沉淀分离法D、解蔽法9、EDTA的有效浓度[Y]与酸度有关,它随着溶液pH值增大而()A、增大B、减小C、不变D、先增大后减小10、EDTA法测定水的总硬度是在pH=( )的缓冲溶液中进行,钙硬度是在pH =( )的缓冲溶液中进行。

习题答案1计算pH=时EDTA 的酸效应系数αY(H)。
若此时EDTA 各种存在形式的总浓度为·L -1,则[Y 4-]为多少? 解:(1)EDTA 的61~K K :,,,,,61~ββ:,,,,,pH=时:()66554433221H Y ]H []H []H []H []H []H [1ββββββ++++++++++++=α=1++++++ =(2)[Y 4-] =45.610020.0=×10-9(mol·L -1)2. pH=时,锌和EDTA 配合物的条件稳定常数是多少?假设Zn 2+和EDTA 的浓度皆为10-2mol·L -1(不考虑羟基配位等副反应)。
pH = 时,能否用EDTA 标准溶液滴定Zn 2+? 解: 查表5-2: 当pH = 时,lg αY(H) = ,Zn 2+与EDTA 浓度皆为10-2mol·L -1, lg K ’= lg K 稳-lg αY(H) =- = >8,可以准确滴定。
3. 假设Mg 2+和EDTA 的浓度皆为10-2mol·L -1,在pH= 时,镁与EDTA 配合物的条件稳定常数是多少(不考虑羟基配位等副反应)?并说明在此pH 条件下能否用EDTA 标准溶液滴定Mg 2+。
如不能滴定,求其允许的最小pH 。
解:(1)查表5-2: 当pH = 时,lg αY(H) = ,lg K ’= lg K 稳-lg αY(H) = - = ,lg K ’<8, ∴不能准确滴定(2)lg αY(H) = lg K 稳-8 = ,查表5-2或114页林邦曲线得pH ≈ 。
4.试求以EDTA 滴定浓度各为mol·L -1的Fe 3+和Fe 2+溶液时所允许的最小pH 。
解:(1)Fe 3+:lg αY(H) = lg K 稳-8 =-8 = ,查表5-2或114页林邦曲线得pH ≈ (2)Fe 2+:lg αY(H) = lg K 稳-8 =-8 = ,查表5-2或114页林邦曲线得pH ≈5.计算用mol·L -1EDTA 标准溶液滴定同浓度的Cu 2+离子溶液时的适宜酸度范围。

第4章配位滴定法部分思考题参考答案1.金属离子与EDTA形成的配合物有何特点?答:EDTA与金属离子形成螯合物时,它的两个氨基氮和四个羧基氧都能与金属离子键合,形成配位数为4或6的稳定的配合物。
EDTA 与金属离子的配位反应具有如下特点:(1)EDTA与许多金属离子可形成配位比为1:1的稳定配合物。
只有极少数高氧化值金属离子与EDTA(2)EDTA的稳定性。
(3)EDTA2.配合物的条件稳定常数是如何得到的?为什么要使用条件稳定常数?答:在配位滴定法中,如果没有副反应,溶液中M和EDTA的主反应进行的程度用稳定常数K MY表示。
K MY值越大,形成的配合物越稳定。
但是在实际反应中总会存在许多副反应,对主反应就会有不同程度的影响,K MY就不能客观地反映主反应进行的程度。
因此,需要对配合物的稳定常数进行修正。
若仅考虑EDTA 的副反应(酸效应和共存离子效应)和金属离子的配位效应的影响,则得到下式:MY K Y M MY '='']][[][ 上式中Y M ''和分别表示M 和Y 的总浓度,MYK '称为条件稳定常数,是考虑了酸效应和配位效应后EDTA 与金属离子配合物的实际稳定常数,采用MYK '能更正确地判断金属离子和EDTA 的配位情况。
3. 简述金属指示剂的作用原理。
答:在配位滴定法中,剂,铬黑T 在2+, Zn 2+等金属离子T 指而大多数金属离随着EDTA 的不断滴入,游离金属离子逐步被配位。
当游离的金属离子几乎完全配位后,继续递加EDTA 时,由于EDTA 与金属离子形成的配合物(M-EDTA )的条件稳定常数大于铬黑T 与金属离子形成的配合物(M-铬黑T )的条件稳定常数,因此,EDTA 夺取M-铬黑T 中的金属离子,从而将指示剂释放出来,溶液显示出游离铬黑T 的蓝色,指示滴定终点的到达。
反应方程式如下;M-铬黑T + EDTA M-EDTA + 铬黑T4.什么是金属指示剂的封闭和僵化?如何避免?答:如果指示剂与金属离子形成的配合物的稳定性太高,会使终点拖后,而且有可能虽加入过量的EDTA也不能夺走其中的金属离子,得不到滴定终点,这种现象称为指示剂的封闭。

第八章 配位化合物与配位滴定习题1:配位化合物部分1 无水CrCl 3和氨作用能形成两种配合物A 和B ,组成分别为CrCl 3·6NH 3和CrCl 3·5NH 3。
加入AgNO 3,A 溶液中几乎全部氯沉淀为AgCl ,而B 溶液中只有2/3的氯沉淀出来。
加入NaOH 并加热,两种溶液均无氨味。
试写出这两种配合物的化学式并命名。
解:因加入AgNO 3,A 溶液中几乎全部氯沉淀为AgCl ,可知A 中的三个Cl -全部为外界离子,B 溶液中只有2/3的氯沉淀出来,说明B 中有两个Cl -为外界,一个Cl -属内界。
加入NaOH ,两种溶液无氨味,可知氨为内界。
因此A 、B 的化学式和命名应为,A :[Cr(NH 3)6]Cl 3 三氯化六氨合铬(Ⅲ) B :[Cr(NH 3)5Cl]Cl 2 二氯化一氯五氨合铬(Ⅲ)2 指出下列配合物的中心离子、配体、配位数、配离子电荷数和配合物名称。
解:3 试用价键理论说明下列配离子的类型、空间构型和磁性。
解:(1)CoF 63-和Co(CN)63-CoF 63-为外轨型,空间构型为正八面体,顺磁性,磁矩=B μ90.4)24(4=+。
Co(CN)63-为内轨型,空间构型为正八面体,抗磁性,磁矩为零。
(2)Ni(NH 3)42+和Ni(CN)42-Ni(NH 3)42+为外轨型,正四面体型,顺磁性,磁矩=B μ83.2)22(2=+。
Ni(CN)42-为内轨型,平面正方型,抗磁性,磁矩为零。
4 将0.1mol·L -1ZnCl 2溶液与1.0 mol·L -1NH 3溶液等体积混合,求此溶液中Zn(NH 3)42+和Zn 2+的浓度。
解:等体积混合后,ZnCl 2和NH 3各自的浓度减半,生成的Zn(NH 3)42+的浓度为0.05 mol·L -1,剩余的NH 3的浓度为0.3 mol·L -1,设Zn 2+的浓度为x mol·L -1。
配位滴定法练习题一、选择题1、某溶液主要含有Ca2+、Mg2+及少量Fe3+、Al3+,今在pH=10的加入三乙醇胺,以EDTA滴定,用铬黑T为指示剂,则测出的是()A、Mg2+量B、Ca2+量C、Ca2+、Mg2+总量D、Ca2+、Mg2+、Fe3+、Al3+总量2、准确滴定单一金属离子的条件是()A、lgc M K′MY≥8B、lgc M K MY≥8C、lgc M K′MY≥6D、lgc M K MY≥63、在配位滴定中,直接滴定法的条件包括()A、lgcK'MY≤ 8B、溶液中无干扰离子C、有变色敏锐无封闭作用的指示剂D、反应在酸性溶液中进行4、EDTA 滴定Zn2+时,加入NH3-NH4Cl可()A、防止干扰B、控制溶液的pH值C、使金属离子指示剂变色更敏锐D、加大反应速度5、取水样100mL,用C(EDTA)=0.02000mol/L,标准溶液测定水的总硬度,用去4.00毫升,计算水的总硬度是( )(用CaCO3 mg/L表示)A、20mg/LB、40 mg/LC、60 mg/LD、80mg/L6、配位滴定终点所呈现的颜色是()A、游离金属指示剂的颜色B、EDTA与待测金属离子形成配合物的颜色C、金属指示剂与待测金属离子形成配合物的颜色D、上述A与C的混合色7、在EDTA配位滴定中,下列有关酸效应系数的叙述,正确的是()A、酸效应系数越大,配合物的稳定性愈大B、酸效应系数越小,配合物的稳定性愈大C、pH值愈大,酸效应系数愈大D、酸效应系数愈大,配位滴定曲线的pM突跃范围愈大8、以配位滴定法测定Pb2+时,消除Ca2+、Mg2+干扰最简便的方法是()A、配位掩蔽法B、控制酸度法C、沉淀分离法D、解蔽法9、EDTA的有效浓度[Y]与酸度有关,它随着溶液pH值增大而()A、增大B、减小C、不变D、先增大后减小10、EDTA法测定水的总硬度是在pH=( )的缓冲溶液中进行,钙硬度是在pH =( )的缓冲溶液中进行。
配位滴定法课后练习题及参考答案配位滴定法课后练习题及参考答案一、选择题1.直接与金属离子配位的EDTA型体为()(A)H6Y2+ (B)H4Y(C)H2Y2-(D)Y4-2.一般情况下,EDTA与金属离子形成的络合物的络合比是()(A)1:1 (B)2:1 (C)1:3 (D)1:23.铝盐药物的测定常用配位滴定法。
加入过量EDTA,加热煮沸片刻后,再用标准锌溶液滴定。
该滴定方式是()。
(A)直接滴定法(B)置换滴定法(C)返滴定法(D)间接滴定法4.αM(L)=1表示()(A)M与L没有副反应(B)M与L的副反应相当严重(C)M的副反应较小(D)[M]=[L]5.以下表达式中正确的是()(A)>(B)>(C)>(D)>6.用EDTA直接滴定有色金属离子M,终点所呈现的颜色是()(A)游离指示剂的颜色(B)EDTA-M络合物的颜色(C)指示剂-M络合物的颜色(D)上述A+B的混合色7.配位滴定中,指示剂的封闭现象是由()引起的(A)指示剂与金属离子生成的络合物不稳定(B)被测溶液的酸度过高(C)指示剂与金属离子生成的络合物翁定性小于MY的稳定性(D)指示剂与金属离子生成的络合物稳定性大于MY的稳定性8.下列叙述中错误的是()(A)酸效应使络合物的稳定性降低(B)共存离子使络合物的稳定性降低(C)配位效应使络合物的稳定性降低(D)各种副反应均使络合物的稳定性降低9.用Zn2+标准溶液标定EDTA时,体系中加入六次甲基四胺的目的是()(A)中和过多的酸(B)调节pH值(C)控制溶液的酸度(D)起掩蔽作用10.在配位滴定中,直接滴定法的条件包括( )≤8 (B)溶液中无干扰离子(A)>(C)有变色敏锐无封闭作用的指示剂(D)反应在酸性溶液中进行11.测定水中钙硬时,Mg2+的干扰用的是( )消除的。
(A)控制酸度法(B)配位掩蔽法(C)氧化还原掩蔽法(D)沉淀掩蔽法12.配位滴定中加入缓冲溶液的原因是()(A)EDTA配位能力与酸度有关(B)金属指示剂有其使用的酸度范围(C)EDTA与金属离子反应过程中会释放出H+>(D)会随酸度改变而改变>13.产生金属指示剂的僵化现象是因为()(A)指示剂不稳定(B)MIn溶解度小(C)KˊMIn < KˊMY (D)KˊMIn >KˊMY14.已知M=81.38g/mol,用它来标定0.02mol的EDTA溶液,宜称取ZnO为()ZnO(A)4g(B)1g (C)0.4g (D)0.04g15.某溶液主要含有Ca2+、Mg2+及少量Al3+、Fe3+,今在pH=10时加入三乙醇胺后,用EDTA滴定,用铬黑T为指示剂,则测出的是( )(A)Mg2+的含量(B)Ca2+、Mg2+的含量(C)Al3+、Fe3+的含量(D) Ca2+、Mg2+、Al3+、Fe3+的含量二、填空题1.EDTA是()的英文缩写,配制EDTA标准溶液时,常用()。
第五章 配位滴定法习题答案1计算pH=5.0时EDTA 的酸效应系数αY(H)。
若此时EDTA 各种存在形式的总浓度为0.0200mol·0.0200mol·LL -1,则[Y 4-]为多少?为多少?解:(1)EDTA 的61~K K :1010.26,106.16,102.67,102.0,101.6,100.961~ββ:1010.26,1016.42,1019.09,1021.09,1022.69,1023.59 pH=5.0时:时:()66554433221H Y ]H []H []H []H []H []H [1ββββββ++++++++++++=a=1+105.26+106.42+104.09+101.09+10-2.31+10-6.41=106.45 (2)[Y 4-] =45.610020.0=7.1×=7.1×1010-9(mol·mol·L L -1)2. . pH=5.0pH=5.0时,锌和EDT A 配合物的条件稳定常数是多少?假设Zn 2+和EDT A 的浓度皆为10-2 mol·mol·L L -1(不考虑羟基配位等副反应)。
pH = 5.0时,能否用EDTA 标准溶液滴定Zn 2+?解: 查表5-2: 当pH = 5.0时,lg αY(H) = 6.45,Zn 2+与EDTA 浓度皆为10-2 mol·mol·L L -1, lg K ’=’= lg lg K 稳-lg αY(H) =16.50-6.45 = 10.05>8,可以准确滴定。
,可以准确滴定。
3. 假设Mg 2+和EDT A 的浓度皆为10-2 mol·mol·L L -1,在pH= pH= 6.06.0时,镁与EDT A 配合物的条件稳定常数是多少(不考虑羟基配位等副反应)(不考虑羟基配位等副反应)?并说明在此?并说明在此pH 条件下能否用EDTA 标准溶液滴定Mg 2+。
习 题八一、选择题(将正确答案的序号填在括号内) 1.下列配合物中心离子的配位数有错误的是( )a.[Co(NO 2)3(NH 3)3];b.K 2[Fe(CN)5NO];c.[CoCl 2(NH 2)2(en)2];d.[Co(NH 3)4Cl 2]Cl 。
2.关于配合物,下列说法错误的是( )a.配体是一种可以给出孤对电子或π健电子的离子或分子;b.配位数是指直接同中心离子相连的配体总数;c.广义地讲,所有金属离子都可能生成配合物;d.配离子既可以存在于晶体中,也可以存在于溶液中。
3.关于外轨型与内转型配合物的区别,下列说法不正确的是( )a.外轨型配合物中配位原子的电负性比内轨型配合物中配位原子的电负性大;b.中心离子轨道杂化方式在外轨型配合物是ns 、np 、nd 轨道杂化,内轨型配合物是(n-1)d 、ns 、np 轨道杂化;c.一般外轨型配合物比内轨型配合物键能小;d.通常外轨型配合物比内轨型配合物磁矩小。
4.当下列配离子浓度及配体浓度均相等时,体系中Zn 2+离子浓度最小的是( )a.()+243NH Zn ; b.()+22en Zn ;c. ()-24CN Zn d.()-24OH Zn。
5.Fe(Ⅲ)形成配位数为6的外轨型配合物中,Fe 3+离子接受孤对电子的空轨道是( )a.d 2sp 3;b.sp 3d 2;c.p 3d 3d.sd 5 6.下列配离子能在强酸性介质中稳定存在的是( )a.()-3232O S Ag ; b.()+243NH Ni ; c.()-3342O C Fe ; d.-24HgCl 。
7.测得()+363NH Co 的磁矩µ=0.0B· M,可知Co 3+离子采取的杂化类型为( )a.d 2sp 3;b.sp 3d 2;c.sp 3 ;d.dsp 2 8.下列物质具有顺磁性的是( )a.()+23NH Ag ; b.()-46CN Fe ; c.()+243NH Cu ; d.()-24CN Zn9.下列物质中,能作为螯合剂的为( )a.HO-OH ;b.H 2N-NH 2;c.(CH 32)2N-NH 2;d.H 2N-CH 2-CH 2-NH 2。
第九章 配位化合物与配位滴定法习题1. 是非判断题1-1中心离子的未成对电子数越多,配合物的磁矩越大。
1-2配合物由内界和外界组成。
1-3配位数是中心离子(或原子)接受配位体的数目。
1-4配位化合物K s [Fe(CN) 5CO]的名称是五氰根•一氧化碳和铁(H)酸钾。
1-5 一般说来,内轨型配合物比外轨型配合物稳定。
1-6配合物中由于存在配位键,所以配合物都是弱电解质。
1-7同一种中心离子与有机配位体形成的配合物往往要比与无机配合体形成的配合物更稳定。
1- 8配合物的配位体都是带负电荷的离子,可以抵消中心离子的正电荷。
1- 9电负性大的元素充当配位原子,其配位能力强。
1- 10在螯合物中没有离子键。
1- 11配位物中心离子所提供杂化的轨道,其主量子数必须相同。
1- 12配合物的几何构型取决于中心离子所采用的杂化类型。
1- 13外轨型配离子磁矩大,内轨型配合物磁矩小。
1- 14配离子的配位键越稳定,其稳定常数越大。
1-15氨水溶液不能装在铜制容器中,其原因是发生配位反应,生成[Cu(NH 3)4]2+,使铜溶解。
1- 16在配离子[Cu(NH 3)4]2+解离平衡中,改变体系的酸度,不能使配离子平衡发生移动。
1- 17 已知[HglJ 2-的 4 =K 1, [HgClf -的 4 =K ?,,则反应[HgCI 4] 2-+4l -=[Hgl d 2-+4CI -的平衡常数为 K/K 20 1- 18 [Cu(NH 3)3]2+ 的积累稳定常数 B 3是反应[C U (NH 3)2]2+ +NH 3?[C U (NH 3)3]2+ 的平衡常数。
3 2 2[Fe(C 2C 4)3] + e=[Fe(C 20)2] +C 2O 4,在标准状态时,_ 2+21- 20 已知 Hg +2e=Hg, =; [HgCI 4] -+2e=Hg+4CI -,电池反应[HgCI 4]2 ?Hg 2+ + 4CI 的平衡常数计算式为2 0.85 0.38IgK0.0592。
《配位化合物与配位滴定法》习题答案9-1 命名下列配合物,并指出中心离子、配位体、配位原子和中心离子的配位数。
(1)[CoCl 2(H 2O)4]Cl (2)[PtCl 4(en)] (3)[Ni Cl 2(NH 3)2] (4)K 2[Co(SCN)4] (5)Na 2[SiF 6] (6)[Cr(H 2O)2(NH 3)4]2 (SO 4)3(7)K 3[Fe(C 2O 4)3] (8)(NH 4)3[SbCl 6]·2H 2O9-2 已知磁矩,根据价键理论指出下列配离子中中心离子的杂化轨道类型和配离子的空间构型。
(1)[Cd(NH 3)4]2+ (μ=0 B M) (2)[PtCl 4]2- (μ=0 B M) (3)[Mn(CN)6]4- (μ=1.73 BM)(4)[CoF 6]3- (μ=4.9 B M)(5)[BF 4]- (μ=0 BM) (6)[Ag(CN)2]- (μ=0 B M)9-3 解释下列名词(1)配位原子 (2)配离子 (3)配位数(4)多基(齿)配位体 (5)螯合效应 (6)内轨型和外轨型配合物(7)高自旋和低自旋配合物 (8)磁矩 答:见教材。
9-4 选择适当试剂,实现下列转化。
Ag →AgNO 3→AgCl ↓→[Ag(NH 3)2]Cl →AgBr ↓→Na 3[Ag(S 2O 3)2]→AgI ↓→K[Ag(CN)2] →Ag 2S ↓ 答:转化路线:↓−→−−−→−→−→−−−→−↓−→−−−−→−↓−→−−−→−-----⋅S Ag ]K[Ag(CN)AgI ])O [Ag(S Na AgBr ]Cl )[Ag(NH AgCl AgNO Ag 22232323NH 32232233S KCNI O S Br OH Cl HNO 要点:应记忆题给各常见配合物和沉淀物的稳定转化顺序。
9-11 用EDTA 标准溶液滴定金属离子M ,试证明在化学计量点时, (1)()'21MY pK pMY pM -=(2))(lg 2lg )(lg M c K MY c MY += 证明:(1)化学计量点处,由于EDTA 和金属离子都恰好完全反应,因此由EDTA 和金属离子引起的副反应效应非常小,可以忽略不计;此时的金属离子和EDTA 的浓度主要取决于配合物的解离。
∵)'()'()('Y c M c MY c K MY=∴'22')()()()()'()'()(MYMYK MY c M c M c MY c Y c M c MY c K =⇒== 两边取负对数,得:()''212MYMY pK pMY pM pK pMY pM -=⇒-= (2)由于化学计量点处副反应效应很小可以忽略不计,根据第一步的证明结果可得:22')()()()()'()'()(M c K MY c M c MY c Y c M c MY c K K MY MY MY ⋅=⇒=== 两边取对数得:)(lg 2lg )(lg M c K MY c MY +=9-13 向0.10 mol ·L -1[Ag(NH 3)2] +,0.1 mol ·L -1 Cl -和5.0 mol ·L -1NH 3·H 2O 溶液中滴加HNO 3至恰好有白色沉淀生成。
近似计算此时溶液的pH(忽略体积的变化)。
解:设恰好有白色沉淀时,Ag +浓度为c(Ag +),Cl -浓度为c(Cl -),则应有:10θsp 101.770.1)c(Ag )c(Cl )c(Ag (AgCl)K -+-+⨯=⨯=•= 因此,c(Ag +)=1.77x10-9mol/L 。
由于此时Ag +参与配位反应,设此时NH 3浓度为c(NH 3),[Ag(NH 3)2] +浓度为)])(([23+NH Ag c 则:()()()723923231012.1/)(1077.110.0/)(/)()])(([⨯=•⨯≈•+=-+θθθθc NH c c NH c Ag c NH Ag c K f因此,L mol /246.2)c(NH 3=,由于NH 3的初始浓度为5.0mol/L ,可知随着HNO 3的加入,有5.0-2.246=2.754mol/L 的NH 3转化为等物质的量的NH 4+,所以,此时溶液酸度为:()()()17.9246.2754.2lg 108.1/10lg /)(/lg 51434=-⨯-=-=--+θθθc NH c c NH c PK PH a 9-14 计算含有1.0 mol ·L -1NH 3的1.0×10-3 mol ·L -1[Zn(NH 3)4]2+溶液和含有0.10 mol ·L -1NH 3的1.0×10-3 mol ·L -1[Zn(NH 3)4]2+中Zn 2+的浓度分别是多少? 解:设含有1.0 mol ·L -1NH 3的1.0×10-3 mol ·L -1[Zn(NH 3)4]2+溶液中,Zn 2+的浓度为x ,则:()()x.x .x --⨯+⨯=+++33-243321001401 mol/L /平衡浓101.0 1.0 0 mol/L /起始浓])[Zn(NH 4NH Zn 度度由于溶液中Zn 2+浓度很低,所以:mol/L.xmol/L mol/L .mol/L.xmol/L mol/L .331001100101401--⨯≈-⨯≈+代入平衡常数表达式:()()94343243f 1088.20.1100.1/])([⨯=•⨯=⎪⎭⎫⎝⎛•=-+x c NH c c Zn c c NH Zn c K θθθθ解方程得到:L mol x /1047.313-⨯=类似的,设含有0.1mol ·L -1NH 3的1.0×10-3 mol ·L -1[Zn(NH 3)2]2+溶液中,Zn 2+的浓度为y ,则:()()92323223f 1088.21.0100.1/])([⨯=•⨯=⎪⎭⎫⎝⎛•=-+y c NH c c Zn c c NH Zn c K θθθθ解方程得到:L mol y /1047.39-⨯=答:含有 1.0 mol ·L -1NH 3的 1.0×10-3 mol ·L -1[Zn(NH 3)4]2+溶液和含有0.10mol ·L -1NH 3的1.0×10-3 mol ·L -1[Zn(NH 3)4]2+中Zn 2+的浓度分别是L mol /1047.313-⨯和L mol /1047.39-⨯。
9-15 10 mL 0.05 mol ·L -1[Ag(NH 3)2]+溶液与1 mL 0.1 mol ·L -1NaCl 溶液混合,此混合液中NH 3的浓度为多少,才能防止AgCl 沉淀生成?解1:设刚开始生成AgCl 沉淀时,NH 3、Ag +、Cl -和[Ag(NH 3)2]+浓度分别为c(NH 3)、c(Ag +)、c(Cl -)和c( [Ag(NH 3)2]+ ),根据体系中存在的配位和沉淀反应平衡知:)(K )c(Ag )c(Cl sp -AgCl cc θθθ=⋅+ ()+++=⋅⎪⎭⎫ ⎝⎛])[Ag(NH c )(c )()/c ])[Ag(NH c(232323θθθθf K Ag c NH c联立解方程组得:()++⨯=])[Ag(NH )(K ) l )c( ])[Ag(NH c()(23sp -233θθf K AgCl C NH c (1) 由于10 mL 0.05 mol ·L -1[Ag(NH 3)2]+溶液与1 mL 0.1 mol ·L -1NaCl 溶液混合后,各离子浓度为:()L mol /1009.91110.1)c(Cl 3--⨯=⨯=()L mol /1055.411100.05) ])[Ag(NH c(223-+⨯=⨯=将两个浓度数据及两个稳定常数带入方程(1),得:()()L mol K AgCl C NH c f /46.0 1012.11077.11009.91055.4])[Ag(NH )(K ) l )c( ])[Ag(NH c()(7103223sp -233=⨯⨯⨯⨯⨯⨯=⨯=---++θθ解1:反应体系中同时存在配位平衡和沉淀平衡两个反应,其总反应方程式为:3232])([NH AgCl Cl NH Ag +↓=+-+其反应平衡常数为:()()()()()()()()θθspf sp f K K NH Ag c Cl c NH c K K Ag c Ag c NH Ag c Cl c NH c NH Ag c Cl c NH c K ⋅=⇒⋅=⋅==+-+++-+-])([)(1])([)(])([)(23323232323即解法1中的公式(1),其余计算同解法1。
9-16 通过计算,判断下列反应的方向。
(1)[HgCl 4]2-+4I - →[HgI 4]2-+4Cl - (2)[Cu(CN)2]- +2NH 3 →[Cu(NH 3)2]++ 2CN - (3)[Cu(NH 3)4]2+ + Zn 2+→[Zn(NH 3)4]2++ Cu 2+ (4)[FeF 6] 3-+6CN - →[Fe(CN)6]3-+6F - 解:(1)本反应实质上是[HgCl 4]2-和[HgCl 4]2-之间的相互转化,在各离子浓度都一致的情况下,[HgCl 4]2-解离的Hg 2+浓度c1为:16154-241055.81017.11][][HgCl 1--⨯=⨯=⋅=Cl K c f θ [HgI 4]2-解离的Hg 2+浓度c2为:30294-241048.11076.61][][HgCl 2--⨯=⨯=⋅=I K c f θ 可以看出,在离子浓度完全一致的情况下,[HgI 4]2-的稳定性远远高于[HgCl 4]2-,因此题给反应应该向正方向进行。
但是,如果各离子浓度不一致而且差别较大时,应该根据具体离子浓度进行计算。
计算过程同(1),(2)反应朝负方向进行,(3)反应朝负方向进行,(4) 反应朝正方向进行。
9-17 将100 mL0.020 mol ·L -1 Cu 2+溶液与100 mL 0.28 mol ·L -1氨水混合,求混合溶液中Cu 2+的平衡浓度。
解:等体积混合后,Cu 2+与氨水的浓度分别减半,为0.01mol/L 和0.14mol/L 。