(完整版)配位化合物与配位滴定法
- 格式:doc
- 大小:349.51 KB
- 文档页数:15








第八章配位平衡与配位滴定法§8-1 配合物教学目的及要求: 1.掌握配合物及其组成。
2.掌握配合物命名。
教学重点:配合物命名。
教学难点:配合物命名。
一、配合物及其组成1.中心离子中心离子绝大多数为金属离子特别是过渡金属离子。
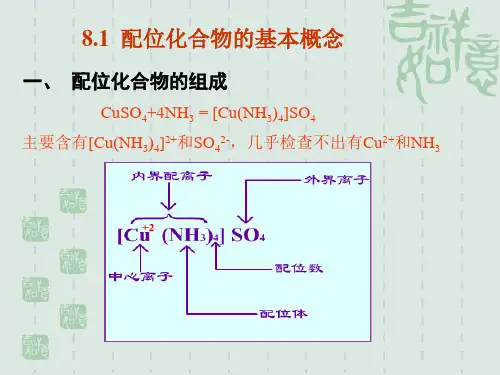
2.配体和配位原子配合物中同中心离子直接结合的阴离子或中性分子叫配体,配体中具有孤电子对并与中心离子形成配位键的原子称为配位原子(单基(齿)配体,多基(齿)配体)3.配位数配合物中直接同中心离子形成配位键的配位原子的总数目称为该中心离子的配位数配位数 =配位体数×齿数4.配离子的电荷数配离子的电荷等于中心离子和配体电荷的代数和。
[Cu (NH3)4 ] SO 4K 3 [Fe(CN) 6 ]↑ ↑↑ ↑↑ ↑ ↑ ↑中配配中配配心心位位离离体数体数子子内界外界外界内界配合物配合物二、配合物的命名配离子按下列序依次命名:阴离子配体→中性分子配体→“合”→中心离子(用数字明氧化数) 。
氧化数无化的中心离子可不注明氧化数。
若有几种阴离子配体,命名序是:离子→ 复离子→ 有机酸根离子;若有几种中性分子配体,命名序是:NH 3→ H 2O→有机分子。
各配体的个数用数字一、二、三⋯⋯写在种配体名称的前面。
整个配合物的命名与一般无机化合物的命名相同,称某化某、某酸某和某某酸等。
由于配离子的成复,有其特定的命名原,搞清楚配离子的名称后,再按一般无机酸、碱和的命名方法写出配合物的名称。
例: K 4[Fe(CN) 6 ]六合 ( Ⅱ) 酸H[AuCl 4]四合金 (Ⅲ )酸[CoCl 2(NH 3)3(H 2O)]Cl化二三氨一水合(Ⅲ)[PtCl(NO 2)(NH 3)4]CO 3碳酸一一硝基四氨合(Ⅳ )[Ni(CO) 4]四基合§8-2配离子的配位离解平衡教学目的及要求:1.理解配位平衡常数。
2.掌握配位平衡的移。
教学重点:1.配位平衡常数的算。
2.配位平衡的移。
第八章配位化合物与配位滴定法【知识导航】本章知识在《中国药典》(2010年版)中主要应用于含金属离子药物的含量测定,以配位反应为基础的滴定分析法。
目前多用氨羧配位剂为滴定液,其中以乙二胺四醋酸(EDTA)应用最广。
《中国药典》中使用直接滴定法对葡萄糖酸钙、葡萄糖酸钙口服液、葡萄糖酸钙含片、葡萄糖酸钙注射剂、葡萄糖酸钙颗粒、葡萄糖酸锌、葡萄糖酸锌口服液、葡萄糖酸锌片、葡萄糖酸锌颗粒进行含量测定;使用间接滴定法对氢氧化铝、氢氧化铝片、氢氧化铝凝胶进行含量测定。
在历年执业药师考试中也有相关考题出现。
学好本章内容有利于掌握配位滴定法的原理、配位滴定法在药物分析中的应用以及备战执业药师考试。
【重难点】1.配位化合物(coordination compound)简称配合物,以具有接受电子对的空轨道的原子和离子为中心(中心离子),与一定数量的可以给出电子对的离子或分子(配体)按一定的组成和空间构型形成的化合物。
配位键的形成:中心离子(原子)提供空轨道,配位体上的配位原子提供孤对电子。
例如:[Cu(NH3)4]SO4、K3[Fe(NCS)6]等。
这些化合物与简单的化合物区别在于分子中含有配位单元,而简单化合物中没有这些配位单元。
以[Cu(NH3)4]SO4为例:[Cu (NH3)4 ] SO4↓ ↓↓内界配体外界配位体中提供孤电子对的,与中心离子以配位键结合的原子称为配位原子。
一般常见的配位原子是电负性较大的非金属原子。
常见配位原子有C、N、O、P及卤素原子。
由于不同的配位体含有的配位原子不一定相同,根据一个配位体所提供的配位原子的数......目.,可将配位体分为单齿配位体(unidentate ligand)和多齿配位体(multidentate ligand)。
只含有一个配位原子配位体称单齿配位体如H2O、NH3、卤素等。
有两个或两个以上的配位原子配位体称多齿配位体,如乙二胺NH2一CH2一CH2一NH2(简写为en),草酸根C2O42-(简写为ox)、乙二胺四醋酸根(简称EDTA)等。
由中心离子与多齿配位体键合而成,并具有环状结构的配合物称为螯合物(chelate compound)。
螯合物的稳定性与环的数目、大小有很大的关系。
五元环和六元环的张力相对小,比三元环和四元环的螯合物要稳定。
因为环的数目越多,则需要的配位原子就越多,中心离子所受的作用力就越大,越不容易脱开,因而更稳定。
配合物的命名遵循一般无机化合物的命名原则。
阴离子在前,阳离子在后,两者之间加“化”或者是“酸”。
2.配位平衡及其影响因素配位平衡(coordination equilibrium )Cu 2+ + 4NH 3 [Cu (NH 3)4]2+ ,在水溶液中,配离子是以比较稳定的结构单元存在的,但是仍然有一定的解离现象。
配离子的形成是分步进行的,每一步都有稳定常数,称为逐级稳定常数θn K 稳,。
与其他化学平衡一样,配位平衡也是一种动态平衡,当平衡体系的条件(如浓度、酸度等)发生改变,平衡就会发生移动,例如向存在下述平衡:M n ++x L - ML x (n-x)的溶液中加入某种试剂,使金属离子M n +生成难溶化合物,或者改变M n +的氧化态,都可使平衡向左移动。
改变溶液的酸度使配位体L -生成难电离的弱酸,同样也可以使平衡向左移动。
此外,如加入某种试剂能与M n +生成更稳定的配离子时,也可以改变上述平衡,使)(x n x ML -遭到破坏。
由此可见,配位平衡只是一种相对的平衡状态,溶液的pH 值变化、另一种配位剂或金属离子的加入,氧化剂或还原剂的存在都对配位平衡有影响。
3. 氨羧配位剂---EDTA目前使用的最多的是氨羧配位剂,其中最常用的是乙二胺四乙酸根(ethylene diamine tetraacetic acid )简称EDTA 。
EDTA 是一个四元酸,通常用H 4Y 表示。
两个羧基上的H +转移到氨基氮上,形成双偶极离子。
当溶液的酸度较大时,两个羧酸根可以再接受两个H +。
这时的EDTA 就相当于六元酸,用H 6Y 2+表示。
EDTA 在水中的溶解度很小(0.02g/100mL 水,22︒C ),故常用溶解度较大的二钠盐(Na 2H 2Y·2H 2O ,11.1g/100mL 水,22︒C )作为配位滴定的滴定剂。
EDTA 在配位滴定中有广泛的应用,基于以下几个特点:(1)普遍性 、(2)组成恒定、(3)可溶性、(4)稳定性高、(5)配合物的颜色。
EDTA 的解离平衡 在酸度很高的水溶液中,EDTA 有六级解离平衡:在pH<0.90的强酸性溶液中,EDTA 主要以H 6Y 2+型式存在,在pH 为0.97~1.60的溶液中,主要以型式H 5Y +存在;在pH 为1.60~2.00溶液中,主要以H 4Y 型式存在,在pH 为2.00~2.67的溶液中,主要以H 3Y -型式存在,在pH 为2.67~6.16的溶液中,主要以H 2Y 2-型式存在, 在pH 为6.16~10.26的溶液中,主要以HY 3-型式存在,在pH≥12的溶液中,才主要以Y 4-型式存在。
EDTA 各种型式的分布系数与溶液pH 的关系4. 配位滴定法以EDTA 作为滴定剂,在测定金属离子的反应中,由于大多数金属离子与其生成的配合物具有较大的稳定常数,因此反应可以定量完成。
但在实际反应中,不同的滴定条件下,除了被测金属离子与EDTA 的主反应外,还存在许多副反应,使形成的配合物不稳定,它们之间的平衡关系可用下式表示:主反应 M + YMYOH - ↙↘ L H +↙↘N H +↙↘OH - 副反应 M (OH ) ML HY NY MHY MOHY: : :M (OH )n ML n H 6YEDTA 的酸效应:由于H+存在使EDTA 与金属离子配位反应能力降低的现象;共存离子效应:由于其他金属离子存在使EDTA 参加主反应配位能力降低的现象如果只考虑配位剂Y 的酸效应:准确滴定某一金属的条件:根据终点误差理论可推断,要想用EDTA 成功滴定M (即误差≤0.1%) ,则必须6'10)(≥⋅θMY K M c 。
当金属离子浓度c (M )=0.01mol·L -1时,此配合物的条件稳定常数必须等于或大于108即: 8lg '≥θMY K在酸碱滴定反应中,化学计量点附近溶液中pH 值会发生突变。
而在配位滴定中,随着滴定剂EDTA 的不断加入,在化学计量点附近,溶液中金属离子M的浓度发生急剧变化。
如lg lg lg lg lg MYMY M Y MY K K ααα'=--+()lg lg lg MYMY Y H K K α'=-[()][][]MY MY K M Y ''=''果以pM 为纵坐标,以加入标准溶液EDTA 的量)(Y c 为横坐标作图,则可得到与酸碱滴定曲线相类似的配位滴定曲线。
4.金属离子指示剂金属离子指示剂:配位滴定中,能与金属离子生成有色配合物从而指示滴定过程中金属离子浓度变化的显色剂(多为有机染料、弱酸)。
特点:(与酸碱指示剂比较)金属离子指示剂——通过[M +]的变化确定终点;酸碱指示剂——通过[H +] 的变化确定终点。
指示剂的封闭现象:化学计量点时不见指示剂变色,产生原因:干扰离子KNIn > KNY →指示剂无法改变颜色,消除方法:加入掩蔽剂;指示剂的僵化现象:化学计量点时指示剂变色缓慢,产生原因:MIn 溶解度小→与EDTA 置换速度缓慢→终点拖后,消除方法:加入有机溶剂或加热→提高MIn 溶解度→加快置换速度。
常用金属离子指示剂有:EBT (铬黑T )、二甲酚橙。
下面以铬黑T 在滴定反应中的颜色变化来说明金属指示剂的变色原理。
铬黑T 是弱酸性偶氮染料,其化学名称是1-(1-羟基-2-萘偶氮)-6-硝基-2-萘酚-4-磺酸钠。
铬黑T 的钠盐为黑褐色粉末,带有金属光泽。
在不同的pH 值溶液中存在不同的解离平衡。
当pH<6时,指示剂显红色,而它与金属离子所形成的配合物也是红色,终点无法判断;在pH 值为7~11的溶液里指示剂显蓝色,与红色有极明显的色差,所以用铬黑T 作指示剂应控制pH 在此范围内;当pH>12时,则显橙色,与红色的色差也不够明显。
实验证明,以铬黑T 作指示剂,用EDTA 进行直接滴定时pH 值在9~10.5之间最合适。
-H+ -H+H 2In -HIn In 3-+H+ +H+ (红色) (蓝色) (橙色)pH<6 pH 7~11 pH>12铬黑T 可作Zn 2+、Cd 2+、Mg 2+、Hg 2+等离子的指示剂,它与金属离子以1:1 配位。
例如,以铬黑T 为指示剂用EDTA 滴定Mg 2+(pH=10时),滴定前溶液显酒红色,Mg 2+ + HIn 2- MgIn - + H +(蓝色) (酒红色)滴定开始后,Y 4-先与游离的Mg 2+配位,Mg 2+ + HY 3- MgY 2- + H +在滴定终点前,溶液中一直显示MgIn -的酒红色,直到化学计量点时,Y 4-夺取MgIn -中的Mg 2+,由MgIn -的红色转变为HIn 2-的蓝色,MgIn - + HY 3- MgY 2- + HIn 2-(酒红色) (蓝色)在整个滴定过程中,颜色变化为酒红色→紫色→蓝色。
因铬黑T水溶液不稳定,很易聚合,一般与固体NaCl以1:100比例相混,配成固体混合物使用,也可配成三乙醇胺溶液使用。
【例题分析】例题来源:主管药师考试模拟题1、配位滴定法中常用的滴定剂是(C )。
A.氨基二乙酸二钠B.二乙酸四乙胺二钠C.乙二胺四醋酸二钠D.EDATE.DETA解析:本题考查的是配位滴定分析在药物分析中的应用情况,EDTA(乙二胺四醋酸二钠)是常用的配位剂,考查学生的对EDTA的熟练情况,并且设置干扰项增加本题难度,考生务必看清选项。
2、配离子[Ni (en) 2]2+中心离子的配位数是(2009年安徽中医学院专升本)A、2B、4C、6D、8解析:因为en(乙二胺)为二齿配体,一个分子可以提供两个N原子去形成配位键,所以配位数为配体个数(2)× 2 = 43、配位滴定法的直接滴定法,其滴定终点所呈现的颜色是__E__(1999年专升本)A 金属指示剂与被测金属离子形成的配位物的颜色B 游离金属指示剂的颜色C EDTA与被测金属离子形成的配位物的颜色D 上述A和B的混合色E 上述B和C的混合色解析:该题重点考查在配位滴定过程中金属离子指示剂与被测金属离子的结合、EDTA争夺被测金属离子的过程。
金属指示剂是一种能与金属离子形成有色配合物的一类有机配位剂,与金属离子形成的配合物与其本身颜色有显著不同,从而指示溶液中金属离子的浓度变化,确定滴定的终点。