配位化合物与配位滴定法
- 格式:doc
- 大小:122.50 KB
- 文档页数:8


第八章配位化合物与配位滴定法【知识导航】本章知识在《中国药典》(2010年版)中主要应用于含金属离子药物的含量测定,以配位反应为基础的滴定分析法。
目前多用氨羧配位剂为滴定液,其中以乙二胺四醋酸(EDTA)应用最广。
《中国药典》中使用直接滴定法对葡萄糖酸钙、葡萄糖酸钙口服液、葡萄糖酸钙含片、葡萄糖酸钙注射剂、葡萄糖酸钙颗粒、葡萄糖酸锌、葡萄糖酸锌口服液、葡萄糖酸锌片、葡萄糖酸锌颗粒进行含量测定;使用间接滴定法对氢氧化铝、氢氧化铝片、氢氧化铝凝胶进行含量测定。
在历年执业药师考试中也有相关考题出现。
学好本章内容有利于掌握配位滴定法的原理、配位滴定法在药物分析中的应用以及备战执业药师考试。
【重难点】1.配位化合物(coordination compound)简称配合物,以具有接受电子对的空轨道的原子和离子为中心(中心离子),与一定数量的可以给出电子对的离子或分子(配体)按一定的组成和空间构型形成的化合物。
配位键的形成:中心离子(原子)提供空轨道,配位体上的配位原子提供孤对电子。
例如:[Cu(NH3)4]SO4、K3[Fe(NCS)6]等。
这些化合物与简单的化合物区别在于分子中含有配位单元,而简单化合物中没有这些配位单元。
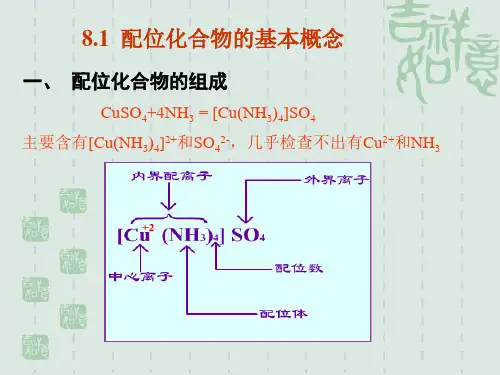
以[Cu(NH3)4]SO4为例:[Cu (NH3)4 ] SO4↓ ↓↓内界配体外界配位体中提供孤电子对的,与中心离子以配位键结合的原子称为配位原子。
一般常见的配位原子是电负性较大的非金属原子。
常见配位原子有C、N、O、P及卤素原子。
由于不同的配位体含有的配位原子不一定相同,根据一个配位体所提供的配位原子的数......目.,可将配位体分为单齿配位体(unidentate ligand)和多齿配位体(multidentate ligand)。
只含有一个配位原子配位体称单齿配位体如H2O、NH3、卤素等。
有两个或两个以上的配位原子配位体称多齿配位体,如乙二胺NH2一CH2一CH2一NH2(简写为en),草酸根C2O42-(简写为ox)、乙二胺四醋酸根(简称EDTA)等。



第九章配位化合物与配位滴定法习题及答案(总10页)-CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除第九章 配位化合物与配位滴定法习题1.是非判断题1-1中心离子的未成对电子数越多,配合物的磁矩越大。
1-2配合物由内界和外界组成。
1-3配位数是中心离子(或原子)接受配位体的数目。
1-4配位化合物K 3[Fe(CN)5CO]的名称是五氰根·一氧化碳和铁(Ⅱ)酸钾。
1-5一般说来,内轨型配合物比外轨型配合物稳定。
1-6配合物中由于存在配位键,所以配合物都是弱电解质。
1-7同一种中心离子与有机配位体形成的配合物往往要比与无机配合体形成的配合物更稳定。
1-8配合物的配位体都是带负电荷的离子,可以抵消中心离子的正电荷。
1-9电负性大的元素充当配位原子,其配位能力强。
1-10在螯合物中没有离子键。
1-11配位物中心离子所提供杂化的轨道,其主量子数必须相同。
1-12配合物的几何构型取决于中心离子所采用的杂化类型。
1-13外轨型配离子磁矩大,内轨型配合物磁矩小。
1-14配离子的配位键越稳定,其稳定常数越大。
1-15氨水溶液不能装在铜制容器中,其原因是发生配位反应,生成[Cu(NH 3)4]2+,使铜溶解。
1-16在配离子[Cu(NH 3)4]2+解离平衡中,改变体系的酸度,不能使配离子平衡发生移动。
1-17已知[HgI 4]2-的4θβ=K 1,[HgCl 4]2-的4θβ=K 2,,则反应[HgCl 4]2-+4I -=[HgI 4]2-+4Cl -的平衡常数为K 1/K 2。
1-18 [Cu(NH 3)3]2+ 的积累稳定常数β3是反应[Cu(NH 3)2]2+ + NH 3[Cu(NH 3)3]2+的平衡常数。
1-19已知θϕ[Fe 3+/Fe 2+]=,电极反应[Fe(C 2O 4)3]3-+ e=[Fe(C 2O 4)2]2-+ C 2O 42-,在标准状态时,θϕ的计算式为:θθθθθϕϕc O C c c O C Fe c c O C Fe c Fe F /)(/])([/])([lg 0592.0)/e 2422242334223---+⋅++(= 。




配位化合物与配位滴定法一、单项选择题:1.配位化合物中一定含有:A 、金属键B 、离子键C 、氢键D 、范德华作用力E 、配位键2.在[Co(en ) 2 Cl 2 ]Cl 中,中心原子的配位数是:A 、2B 、4C 、5D 、6E 、33.K 4[Fe(CN ) 6 ]中配离子电荷数和中心原子的氧化数分别为:A 、 -2,+4B 、 -4,+2C 、 +3,-3D 、 -3,+3E 、+2,-34. K 4[HgI 4] 的正确命名是:A 、碘化汞钾B 、四碘化汞钾C 、四碘合汞(Ⅱ)酸钾D 、四碘一汞二钾E 、四碘合汞(Ⅱ)化钾5.配位滴定中为维持溶液的pH 在一定范围内需加入:A 、酸B 、碱C 、盐D 、缓冲溶液E 、胶体溶液6.下列物质中,能做螯合剂的是:A 、NH 3B 、HCNC 、HClD 、EDTAE 、 H 2O7.在EDTA 的各种存在形式中,直接与金属离子配位的是:A 、-4YB 、+26Y HC 、Y H 4D 、-22Y HE 、-Y H 3 8.在324NH Cu ++== +243])([NH Cu 平衡体系中加稀HCl ,可产生的结果是:A 、沉淀析出B 、 配离子解离C 、 有3NH 放出D 、颜色加深E 、 平衡不受影响9.在pH > 11 的溶液中,EDTA 的主要存在形式是:A 、-4YB 、+26YH C 、Y H 4 D 、-22Y H E 、-Y H 3 10.在+2Cu 、+2Mg 混合液中,用EDTA 滴定+2Cu ,要消除+2Mg 的干扰,宜采用:A 、控制酸度法B 、沉淀掩蔽法C 、 配位掩蔽法D 、氧化还原掩蔽法E 、解蔽法11.在pH<1的溶液中,EDTA 的主要存在型体是A 、+26Y HB 、-22Y HC 、H 4YD 、-Y H 3E 、-4Y12.在pH=10氨的缓冲溶液中,以EBT 为指示剂,可用EDTA 直接滴定的是A 、Fe 3+B 、Al 3+C 、Hg 2+D 、Bi 3+E 、Mg 2+13.对金属指示剂叙述错误的是A 、指示剂本身颜色与其生成的配位物颜色应显著不同B 、指示剂应在一适宜pH 范围内使用C 、MIn 稳定性要略小于MY 的稳定性D 、MIn 的稳定性要大于MY 的稳定性E 、指示剂与金属离子的显色反应有良好的可逆性14.EDTA 滴定Ca 2+、Mg 2+总量时,以EBT 作指示剂,指示终点颜色的物质是A 、Mg-EBTB 、Ca-EBTC 、EBTD 、MgYE 、CaY15.EDTA 在酸度很高的水溶液中的主要型体是A 、-22Y HB 、+26Y HC 、+Y H 5D 、-Y H 3E 、-4Y16.有关EDTA 叙述正确的是A 、EDTA 在溶液中总共有7种型体存在B 、EDTA 是一个二元有机弱酸C 、在水溶液中EDTA 一共有5级电离平衡D 、EDTA 不溶于碱性溶液中E 、EDTA 易溶于酸性溶液中17.以二甲酚橙为指示剂,用EDTA 直接滴定金属离子时终点颜色变化应为A 、由无色变为红色B 、由红色变蓝色C 、由蓝色变亮黄色D 、由红色变亮黄色E 、由亮黄色变无色18.EDTA 不能直接滴定的金属离子是A 、Fe 3+B 、Na +C 、Zn 2+D 、Mg 2+E 、Ca 2+19.配位滴定中溶液酸度将影响A 、EDTA 的离解B 、金属指示剂的电离C 、金属离子的水解D 、A+CE 、A+B+C20.用EDTA 返滴定法测Al 3+时,以二甲酚橙为指示剂,调节溶液pH 的是A 、NH 3·H 2O~NH 4ClB 、HClC 、HAc~NaAcD 、NaOHE 、HNO 321.EDTA 与无色金属离子生成的配位物颜色是A 、颜色加深B 、无色C 、紫红色D 、纯蓝色E 、亮黄色22.EDTA 与有色金属离子生成的配位物颜色是A 、颜色加深B 、无色C 、紫红色D 、纯蓝色E 、亮黄色23.EDTA与金属离子刚好能生成稳定的配合物时溶液的酸度称为A、最佳酸度B、最高酸度C、适宜酸度D、水解酸度E、最低酸度24.标定EDTA滴定液的浓度应选择的基准物质是A、氧化锌B、硼砂C、邻苯二甲酸氢钾D、碳酸钠E、重铬酸钾25.下列关于条件稳定常数叙述正确的是A、条件稳定常数是经副反应系数校正后的实际稳定常数B、条件稳定常数是经酸效应系数校正后的实际稳定常数C、条件稳定常数是经配位效应系数校正后的实际稳定常数D、条件稳定常数是经水解效应数校正后的实际稳定常数E、条件稳定常数是经最低pH校正后的实际稳定常数26.配位滴定中能够准确滴定的条件是A、配位物稳定常数K MY>108B、配位物条件稳定常数K´MY>106C、配位物稳定常数K MY≥106D、配位物条件稳定常数K´MY≥108E、配位物条件稳定常数K´MY=10827.影响配位滴定突跃大小的因素是A、配位物条件稳定常数B、金属离子浓度C、金属指示剂D、A+BE、A+B+C28.铬黑T指示剂在纯水中的颜色是A、橙色B、红色C、蓝色D、黄色E、无色29.EDTA中含有配位原子的数目的是A、2个氨基氮B、8个羧基氧原子C、4个羧基氧原子D、2个氨基氮与8个羧基氧原子共10个E、2个氨基氮与4个羧基氧原子共6个30.乙二胺四乙酸二钠盐的分子简式可以表示为A、Na2Y²-B、H4YC、Na2H4Y2+D、Na2H2Y·2H2OE、H6Y2+31.用ZnO标定EDTA溶液浓度时,以EBT作指示剂,调节溶液酸度应用A、六次甲基四胺B、氨水C、氨-氯化铵缓冲溶液D、A+BE、B+C32.EDTA滴定Ca2+时,以铬黑T为指示剂,则需要加入少量镁盐,是因为A、为使滴定反应进行完全B、为使CaY的稳定性更高C、为使终点显色更加敏锐D、为使配位物CaIn更加稳定E、为了控制溶液的酸度二、多项选择题1.对金属指示剂叙述错误的是:A、MIn的变色原理与酸碱指示剂相同B、指示剂应在一适宜的pH范围内使用C、MIn的稳定性要大于MY100倍D、MIn的稳定性要小于MY100倍E、指示剂本身颜色与其生成的配合物颜色明显不同2.有关酸效应的叙述正确的是:A、pH越大,酸效应系数越大B、pH越大,酸效应系数越小C、酸效应系数越大,配合物越稳定D、酸效应系数越大,配合物越不稳定E、酸效应系数越大,配位滴定的突跃范围越大3.下列说法正确的是:A、配位数就是配位体的数目B、只有金属离子才能做中心原子C、配合物中内界与外界电荷的代数和为零D、配离子电荷数等于中心原子的电荷数E、配合物中配位键的数目称为配位数4.下列物质中,配位数为六的配合物是:A、[CaY]2-B、[FeF6]3-C、[Ag(CN)2]-D、[Zn (NH3)4]2-E、[Ni(CN)4]2-5.标定EDTA滴定液常用的基准物是:A、ZnB、K2Cr2O7C、ZnOD、AgNO3E、Na2CO36.影响条件稳定常数大小的因素是:A、配位物稳定常数B、酸效应系数C、配位效应系数D、金属指示剂E、掩蔽剂7.影响配位滴定中pM’突跃大小的因素有:A、配位物稳定常数B、金属离子浓度C、溶液的pH值D、其他配位剂E、解蔽剂8.EDTA与大多数金属离子反应的优点是:A、配位比为1:1B、配合物稳定性很高C、配合物水溶性好D、选择性差E、配合物均无颜色9.配位滴定中,消除共存离子干扰的方法有:A、控制溶液酸度B、使用沉淀剂C、使用配位掩蔽剂D、使用解蔽剂E、使用金属指示剂10.EDTA不能直接滴定的金属离子是:A、Fe3+B、Al 3+C、Na+D、Mg2+E、Ag+三、判断题:1.EDTA滴定中,金属离子开始水解时的pH值称为最小pH。
2.条件稳定常数能反映配位物的实际稳定程度。
3.溶液酸度越高,对EDTA滴定就越有利。
4.金属指示剂本身颜色应与它和金属离子生成的配合物的颜色显著不同。
5.溶液酸度越低,对EDTA滴定就越有利。
6.当两种金属离子最低pH相差较大时,有可能通过控制溶液酸度进行分别滴定。
7.在pH>10的溶液中EDTA存在型体是Y4-。
8.副反应系数α越大,表明对主反应影响程度越高。
9.酸效应说明溶液中[H+]越小,副反应影响越严重。
10.金属指示剂必须在一合适pH范围内使用。
11.配位滴定突跃的大小与金属离子浓度成反比。
12.EDTA与大多数金属离子的摩尔配位比为1:1。
四、填空题:1.配合物K[ Pt Cl5 (NH3) ]的内界是,外界是,中心离子是配体是,配位原子是,配位数是,命名为。
2.PtCl4和氨水反应,生成化合物的化学式为Pt(NH3)4Cl4。
将lmol • L -1 此化合物用AgNO3处理,得到2mol A gC l。
则配合物的内界是,外界是,配位数是,配合物的化学式是。
3.常用金属指示剂二甲酚橙适用的pH值条件为,终点颜色变化为。
4.二(乙二胺)合铜(Ⅱ)离子的化学式为,铜(Ⅱ)离子的配位数为,乙二胺属于配体,与它所形成的配合物属于。
5.[Cu(NH3)4] SO4的系统命名是,其内界是,配位原子为,配体是,配位数为,外界离子是。
6.用EDTA滴定未知样品溶液时,常采用的掩蔽方法有、、。
7.常用金属指示剂铬黑T适用的pH值条件为,终点颜色变化为。
五、简答题1.EDTA与金属离子的配位反应有什么特点?2.为什么在红色的[Fe(SCN)6]3一溶液中加入EDTA后,溶液的红色会消褪?3.EDTA为什么在碱性溶液中配位能力最强?4.判断配位滴定的可行性为什么要用条件稳定常数?5.配位滴定的主反应是什么?有哪些副反应?六、计算题1.吸取水样l00.0ml,以铬黑T为指示剂,用0.01025mol/L的EDTA滴定,用去15.02ml,求以CaCO3m g • L-1表示时水的总硬度。
(CaCO3分子量为100. 1)2.称取葡萄糖酸钙样品0.5416g,溶解后,在pH=10的NH3~NH4CI缓冲溶液中,用0. 05002mol/L的EDTA滴定液滴定,用去24.01 ml,求样品中葡萄糖酸钙的含量。
(C12H22O14Ca • H2O分子量为448.4) 3.精密称取Na2SO4试样0.2032g,溶解后加0. 05000mol/L的BaCl2滴定液25.00 ml,再用0. 05000mol/L的EDTA滴定液返滴剩余的Ba2+,用去6.30 ml,求试样中Na2SO4的含量。
(Na2SO4分子量为142. 1)参考答案:一、单项选择题:1~10:EDBCD DABAA 11~20:AEDCB ADBEC21~30:BABAA DDCED 31~32:CC二、多项选择题:1~5:AC ;BD ;CE ;AB ;AC ; 6~10:ABC ;ABC ;ABC ;ABC ;BCE ;三、判断题:1、×2、√3、×4、√5、√6、×7、×8、√9、× 10、√11、× 12、√四、填空题:1、[PtCl 5(NH 3)]- 、 K + 、 Pt 4+、 Cl -,NH 3、 Cl ,N 、 6、 一氨五氯合铂(Ⅳ)酸钾2、[PtCl 2(NH 3)4]2+、Cl -、6、[PtCl 2(NH 3)4] Cl 23、pH<6、紫红到亮黄色4、[Cu(en)2]2+、4、多齿、螯合物5、硫酸四氨合铜(Ⅱ)、[Cu(NH 3)4]2+、N 、NH 3、4、SO 42-6、配位掩蔽法、沉淀掩蔽法、氧化还原掩蔽法7、 7~10、红到纯蓝色五、简答题1、EDTA 与金属离子配位反应的特点为(1)形成1:1的配合物。