铅锡合金金属相图
- 格式:doc
- 大小:108.50 KB
- 文档页数:6

一、实验目的1.用热分析法(步冷曲线法)测绘Bi-Sn二组分金属相图。
2.掌握热电偶测量温度的基本原理和自动平衡记录仪的使用方法。
二、仪器与药品计算机及接口,铂电极一支;电炉三个;调压器三个;小保温杯一个;样品玻璃试管五个;样品试管架一个;夹子;测水沸点仪一套(公用)纯锡;纯铋;松香;液体石蜡三、实验原理较为简单的二组分金属相图主要有三种;一种是液相完全互溶,凝固后,固相也能完全互深成固熔体的系统,最典型的为Cu-Ni系统;另一种是液相完全互溶而固相完全不互溶的系统,最典型的是Bi-Cd系统;还有一种是液相完全互溶,而固相是部分互溶的系统,如Pb-Sn系统,本实验研究的Bi-Sn 中最大溶解度为21%(质量分分数)。
热分析法(步冷曲线法)是绘制相图的基本方法之一。
它是利用金属及合金在加热和冷却过程中发生相变时,潜热的释出或吸收及热容的突变,来得到金属或合金中相转变温度的方法。
通常的做法是先将金融或合金全部熔化,然后让其在一定的环境中自行冷却,并在记录仪上自动画出温度随时间变化的步冷曲线。
当溶融的系统均匀冷却时,如果系统不发生相变,则系统的温度随时间的变化是均匀的,冷却速率较快(如图中ab线段);若在冷却过程中发生了相变,由于在相变过程中伴随着放热效应,所以系统的温度随时间变化的速率发生改变,系统的冷却速率减慢,步冷曲线上出现转折(如图中b点)。
当熔液继续冷却到某一点时(如图中c点)。
此时溶液系统以低共溶混合物的固体析出。
在低共熔混合物全部凝固以前,系统温度保持不变,因此步冷曲线上出现水平线段(如图中cd线段);当溶液完全凝固后,温度才迅速下降(如图中de线段)。
由此可知,对组成一定的二组分低共溶合物系统,可以根据它的步冷曲线得出有固体析出的温度和低共熔点温度。
根据一系列组成不同系统的步冷曲线的各转折点,即可画出二组分系统系列组成不同系统的步冷曲线的各转折点,即可画出二组分系统的相同。
用热分析法(步冷曲线法)绘制相图时,被测系统必须时时处于或近相平衡状态,因此冷却速率要足够慢才能得到较好的结果。

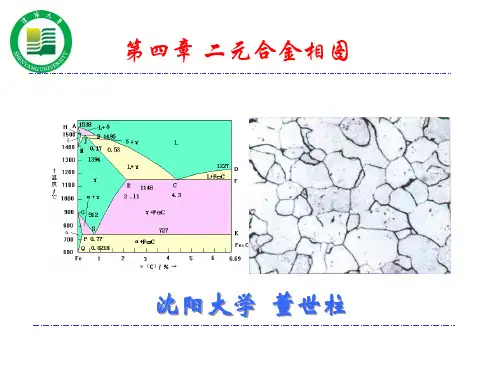
匀晶合金:W Mo Ni Fe Mo Cr Au Ag Ni Cu -----,,,,共晶合金:Si Mg Mg Al Cu Al Si Al Bi Pb Cu Ag Sb Pb Sn Pb --------,,,,,,, 包晶合金:铂银、锡锑、铜锡、铜锌等第五节共晶相图及其合金的结晶共晶相图:两组元在液态时相互无限互溶,在固态时相互有限互溶,发生共晶转变,形成共晶组织的二元系相图,称为二元共晶相图共晶合金Bi Pb Cu Ag Sb Pb Sn Pb ----,,,等合金系的相图都属于共晶相图,在铁碳、铝镁等相图中,也包含有共晶部分一,Sn Pb -二元共晶相图分析图3-33 四条线:图中AE/BE 为液相线,AMNB 为固相线,MF 为锡在铅中的溶解度曲线,也叫固溶度曲线,NG 为铅在锡中的溶解度曲线。
几个相区:1. 相图中有三个单相区:液相L 、固溶体α相、固溶体β相、α相是锡溶于铅中的固溶体,β相是铅溶于锡中的固溶体2. 各个单相区之间有三个两相区,即βαβα+++,,L L3. 在βαβα+++,,L L 两相区之间的水平线MEN 表示L ++βα三相共存区 共晶转变● 在三相共存水平线所对应的温度下,成分相当于E 点的液相E L 同时结晶出与M 点相对应的M α和N 点所对应的N β两个相,形成两个固溶体的混合物。
这种转变的反应式是N M E L βα+↔● 这种在一定的温度下,由一定成分的液相同时结晶出成分一定的两个固相的转变过程,称为共晶转变或共晶反应。
共晶组织共晶转变的产物为两个固相的混合物,称为共品组织。
共晶转变时的相律自由度:根据相律可知,在发生三相平衡转变时,自由度等于零,所以这一转变必然在恒温下进行,而且三个相的成分应为固定值,在相图上的特征是三个单相区与水平线只有一个接触点,其中液体单相区在中间,位于水平线之上,两端是两个固相单相区。
共晶线共晶点共晶温度:相图中的MEN 水平线称为共晶线,E 点称为共晶点,E 点对应的温度称为共品温度, 成分对应于共晶点的合金称为共晶合金,成分位于共晶点以左M 点以右的合金称为亚共晶合金,成分位于共晶点以右N 点以左的合金称为过共晶合金。


实验八金属相图一、实验目的1、学会用热分析法测绘铅-锡二组分金属相图;2、掌握热分析法的测量技术;3、熟悉ZR-HX金属相图控温仪、ZR-08金属相图升温电炉等仪器。
二、基本原理相图是用以研究体系的状态随浓度、温度、压力等变量的改变而发生变化的图形,它可以表示在指定条件下存在的相数和各相的组成,对蒸汽压较小的二组分凝聚体系,常以温度-组成图来描述。
热分析法是绘制相图常用的基本方法之一。
这种方法是通过观察体系在冷却时温度随时间的变化关系,来判断有无相变的发生。
通常的做法是先将体系全部融化,然后让其在一定环境中自行冷却,并每隔一定时间记录一次温度,以温度(T)为纵坐标,时间(t)为横坐标,画出步冷曲线。
当体系均匀冷却时,如果体系不发生相变,则体系的温度随时间的变化将是均匀的,冷却也较快(如图8-1中ab线段)。
若在冷却过程中发生了相变,由于在相变过程中伴随着热效应,所以体系温度的降温速度随时间的变化将发生改变,体系的冷却速度减慢,步冷曲线就出现转折(如图8-1中bc 线段)。
当熔液继续冷却到某一点时,由于此时熔液的组成已达到最低共熔混合物的组成,故有最低共熔混合物析出,在最低共熔混合物完全凝固以前,体系温度保持不变,因此步冷曲线出现平台(如图中cd线段)。
当熔液完全凝固后,温度才迅速下降(见图中de线段)。
由此可知,对组成一定的二组分低共熔混合物体系来说,可以根据它的步冷曲线,判断有固体析出时的温度和最低共熔点的温度。
如果作出一系列组成不同的体系的步冷曲线,从中找出各转折点,即能画出二组分体系最简单的相图(温度-组成图)。
不同组成熔液的步冷曲线与对应相图的关系可以从8-2中看出。
图8-2 图8-1 用热分析法测绘相图时,被测体系必须时时处于或接近相平衡状态。
因此,体系的冷却速度必须足够慢,才能得到较好的结果。
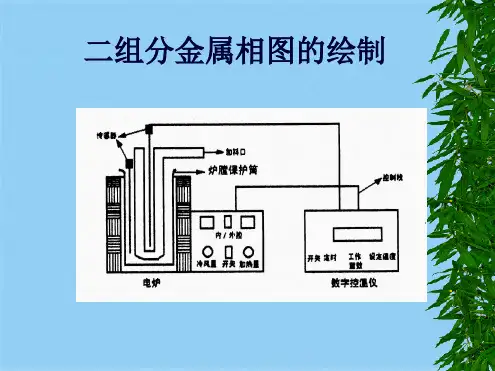
三、仪器和试剂ZR-HX金属相图控温仪ZR-08金属相图升降温电炉铅(C.P.)锡(C.P.)四、操作步骤1、配制样品:测试样品分别为纯锡、含锡量为20%、40%、61.9%、80%的铅-锡混合样和纯铅六个试样,用分析天平按质量百分比严格称取,并确保六个试样的总质量均等于180g,将样品置于升温电炉中。

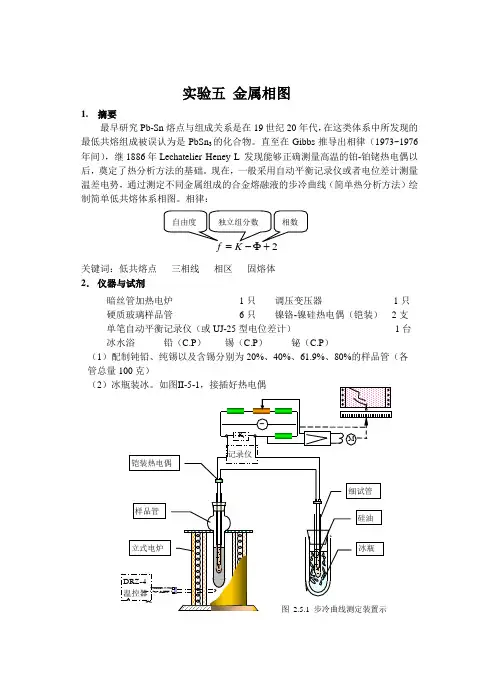
实验五 金属相图1. 摘要最早研究Pb-Sn 熔点与组成关系是在19世纪20年代,在这类体系中所发现的 最低共熔组成被误认为是PbSn 3的化合物。
直至在Gibbs 推导出相律(1973~1976年间),继1886年Lechatelier Heney L 发现能够正确测量高温的铂-铂铑热电偶以后,奠定了热分析方法的基础。
现在,一般采用自动平衡记录仪或者电位差计测量温差电势,通过测定不同金属组成的合金熔融液的步冷曲线(简单热分析方法)绘制简单低共熔体系相图。
相律:关键词:低共熔点 三相线 相区 固熔体 2. 仪器与试剂暗丝管加热电炉 1只 调压变压器 1只 硬质玻璃样品管 6只 镍铬-镍硅热电偶(铠装) 2支 单笔自动平衡记录仪(或UJ-25型电位差计) 1台 冰水浴 铅(C.P ) 锡(C.P ) 铋(C.P )(1)配制钝铅、纯锡以及含锡分别为20%、40%、61.9%、80%的样品管(各 管总量100克)(23.预习提问(1)什么叫步冷曲线,纯物和混合物的步冷曲线有何不同?(2)测定步冷曲线时应自何时开始记录数据或走纸为适宜?如何防止发生过冷现象?如有过冷发生,则相应相变点温度如何推求?(3)如何由步冷曲线绘制相图?出现固熔体的步冷曲线有何特征?(4)试述热电偶温度计的简单工作原理。
如何进行校正?(5)试述自动平衡记录仪的简单原理、使用及接线?4.操作加热使完全熔化后,轻轻搅匀,置热电偶于样品中部,注意加热惯性,控制缓慢升温超过熔点50C后冷却电炉调压,走纸,控制冷却速率为7~10C/min,直至最后折点以下均需注意热电偶的冷端为0 C5.数据和图象(1)文献数据最低共熔点:组成:61.9% 温度:456.9K(据H.穆拉契编著,原重工业部专家工作室译《有色冶金手册》P111)要求:所测最低共熔温度在455~459K,低共熔组成在61~63%(2)步冷曲线与金属相图(3)表格表2.5.1 体系步冷转折温度6..点评(2)器材选配与操作技能由于立式冷却保温电炉不能人为地控制样品与冷却电炉的温差,使得高温段如纯 铅的平台难以测准,甚至拐点不明显,所以在实验的改进是利用自动控温回转管式电炉(RJK 系列管式电阻炉和DRZ -4型电炉温度控制器,见装置图2.5.1),可以获得在较短时间内成功绘制较佳相图的效果。

铅锡合金小知识铅锡合金是以铅与锡为主要成份,辅之锑(增加硬度)和其它微量金属合成的有色金属,呈白灰色,有光泽,质软,富延展性。
流行饰品铅锡合金分一般等级分为1~6#。
1~6#含铅、锑和其它微量金属。
铅锡合金的熔点约为200~320℃;浇铸温度为380~480℃之间。
元素含量参考:1#料熔点200~220℃,适用于制作韧性强、比重轻、光面较大的各种高档饰品及工艺品。
1#A——含锡92%,含铅3%,含锑2%,其它3%;1#B——含锡90%,含铅4%,含锑3%,其它4%;1#C——含锡85%,含铅4%,含锑4%,其它5%。
2#料熔点230~250℃,适用于制作韧性较好、比重较轻、磨光面较窄或无需磨光且光面较大的各种中档饰品及工艺品。
2#A——含锡72%,含铅23%,含锑3%,其它2%;2#B——含锡63%,含铅28%,含锑4%,其它5%;2#C——含锡50%,含铅41%,含锑4%,其它5%。
3#料熔点270℃,适用于制作韧性较好、密度较小、比重较轻、磨光面较大的各种中档饰品及工艺品。
3#A——含锡35%,含铅57%,含锑4%,其它4%;3#B——含锡30%,含铅64%,含锑3%,其它3%;3#C——含锡25%,含铅71.5%,含锑2.8%,其它1%。
4#料熔点280℃,适用于制作韧性较好、比重较轻、磨光面较窄或不需磨光的各种中档饰品及工艺品。
4#A——含锡15%,含铅81%,含锑3%,其它1%;4#B——含锡12%,含铅85%,含锑3%,其它1%;4#C——含锡10%,含铅86%,含锑3%,其它1%。
5#料熔点286~290℃,适用于制作韧性较好、比重较轻、磨光面较窄或不需磨光的各种中档饰品及工艺品。
5#A——含锡8%,含铅87%,含锑3%,其它2%;5#B——含锡6%,含铅89%,含锑3%,其它2%。
6#料熔点300~320℃,适用于制作各种普通饰品。
6#A——含锡5%,含铅89%,含锑5%,其它1%;6#B——含锡3%,含铅91.5%,含锑3.5%,其它1%;6#C——含锡2%,含铅92.5%,含锑3.5%,其它1%。
金属铅锌相图实验报告引言相图是描述物质在不同温度和组分条件下的相变规律的图表。
铅锌合金是一种常见的金属合金材料,了解其相图对于理解和控制其性质和用途具有重要意义。
本实验旨在通过研究铅锌合金的相图,探究铅锌合金在不同温度和组分下的相变行为及其相图的特征。
实验目的1. 研究铅锌合金的相图特征;2. 探究铅锌合金在不同温度和组分下的相变行为;3. 分析铅锌合金的相图对合金性能和用途的影响。
实验原理铅锌合金的相行为主要受到温度和组分的影响。
当温度和组分的变化超过一定范围时,合金中的相结构会发生相变,从而影响材料的性质和用途。
相图是以温度和组分为坐标的图表,用于描述和表达合金在不同条件下的各个相出现的区域和相变关系。
实验装置和试剂实验装置:1. 电子天平2. 熔融炉3. 熔融炉温度控制装置4. 金属铅锌试样5. 金属铅锌标准参考样品试剂:1. 高纯度铅锌合金试剂2. 石英坩埚3. 氩气实验步骤1. 准备铅锌合金试样和参考样品;2. 在熔融炉中加热样品至设定温度,并保持一段时间以达到热平衡;3. 制备不同温度和组分的样品,并通过铅锌合金的共熔反应来确定相界线;4. 将实验结果整理并绘制成相图。
实验结果通过实验我们得到了铅锌合金的相图,图中清晰地展示了铅锌合金在不同温度和组分下各个相的存在区域和相变关系。
根据实验结果,我们可以得出以下结论:1. 铅锌合金存在着两个主要的相,即铅相和锌相;2. 随着温度的升高,铅锌合金中铅相的比例逐渐减少,锌相的比例逐渐增加;3. 随着锌的添加量的增加,铅锌合金的熔点逐渐降低;4. 在特定温度和组分条件下,铅锌合金可能出现共熔现象。
结论本实验通过研究铅锌合金的相图,得到了铅锌合金在不同温度和组分条件下的相变行为和相图特征。
相图的研究对于了解和控制铅锌合金的性质和用途具有重要意义。
进一步研究铅锌合金的相图可以帮助我们优化合金配方,提高其性能和应用前景。
参考文献[1] 张三,李四. 金属合金相图研究概述. 《材料科学与工程学报》, 2010, 28(1): 123-136.[2] 王五,赵六. 金属合金相图绘制方法研究综述. 《物理化学学报》, 2012, 28(2): 245-259.[3] 七八,九十. 铅锌合金相图研究进展. 《材料科学与工程进展》, 2015, 30(4): 556-568.。
铅锡合金是以铅与锡为主要成份,辅之锑(增加硬度)和其它微量金属合成的有色金属,呈白灰色,有光泽,质软,富延展性。
流行饰品铅锡合金分一般等级分为1~6#。
1~6#含铅、锑和其它微量金属。
铅锡合金的熔点约为200~320℃;浇铸温度为380~480℃之间。
元素含量参考:1#料熔点200~220℃,适用于制作韧性强、比重轻、光面较大的各种高档饰品及工艺品。
1#A——含锡92%,含铅3%,含锑2%,其它3%;1#B——含锡90%,含铅4%,含锑3%,其它4%;1#C——含锡85%,含铅4%,含锑4%,其它5%。
2#料熔点230~250℃,适用于制作韧性较好、比重较轻、磨光面较窄或无需磨光且光面较大的各种中档饰品及工艺品。
2#A——含锡72%,含铅23%,含锑3%,其它2%;2#B——含锡63%,含铅28%,含锑4%,其它5%;2#C——含锡50%,含铅41%,含锑4%,其它5%。
3#料熔点270℃,适用于制作韧性较好、密度较小、比重较轻、磨光面较大的各种中档饰品及工艺品。
3#A——含锡35%,含铅57%,含锑4%,其它4%;3#B——含锡30%,含铅64%,含锑3%,其它3%;3#C——含锡25%,含铅71.5%,含锑2.8%,其它1%。
4#料熔点280℃,适用于制作韧性较好、比重较轻、磨光面较窄或不需磨光的各种中档饰品及工艺品。
4#A——含锡15%,含铅81%,含锑3%,其它1%;4#B——含锡12%,含铅85%,含锑3%,其它1%;4#C——含锡10%,含铅86%,含锑3%,其它1%。
5#料熔点286~290℃,适用于制作韧性较好、比重较轻、磨光面较窄或不需磨光的各种中档饰品及工艺品。
5#A——含锡8%,含铅87%,含锑3%,其它2%;5#B——含锡6%,含铅89%,含锑3%,其它2%。
6#料熔点300~320℃,适用于制作各种普通饰品。
6#A——含锡5%,含铅89%,含锑5%,其它1%;6#B——含锡3%,含铅91.5%,含锑3.5%,其它1%;6#C——含锡2%,含铅92.5%,含锑3.5%,其它1%。
电镀铅基、锡基合金第一节 电镀铅锡合金铅基合金中最重要的是铅锡合金。
该合金具有浅灰色的金属光泽,比较柔软,孔隙率比单层锡或铅都低。
铅和锡的标准电极电位差只有lOmV,且氢过电位高,故可在简单的强酸性镀液中共析,只要控制铅锡离子浓度比和电流密度即可获得任一合金成分的合金镀层,电流效率接近l00%。
镀铅锡合金镀液除使用最普及的氟硼酸盐镀液外,氨基磺酸盐、酚磺酸盐、烷醇磺酸盐和柠檬酸盐镀液业已开始使用。
依合金成分不同,其用途列于表4—3—1。
表4—3—1 各种铅锡合金的用途铅锡合金的金相组织为过饱和固溶体,但在储存过程中会逐渐发生相变。
在某些特殊情况下组分也会与基体形成金属间化合物(例如锡与铜),这一特性在具有特殊要求的场合,应考虑在基体与铅锡合金镀层之间加镀中间隔离层。
(一)氟硼酸盐镀铅锡合金工艺规范(见表4—3—2)表4—3—2 氟硼酸盐镀铅锡合金的工艺规范(二)镀液的配制(1)将计算量的一半的氟硼酸倒人塑料槽中,加水稀释一倍,并稍加热。
(2)往上述液中缓慢加入碱式碳酸铜,生成氟硼酸铜,将锡粉慢慢加入该液中直到铜离子的蓝色完全消失为止,过滤除去铜渣即得到氟硼酸亚锡液。
(3)另一半氟硼酸溶解用水调成糊状的氧化铅,不断搅拌至完全溶解得到氟硼酸铅液。
(4)将(3)液倒人(2)液之中搅匀。
(5)桃胶溶于约40℃的温水中过滤后加入槽中;蛋白胨亦用温水溶解后加入。
明胶用冷水浸泡过夜,再用热水溶解后加入。
其他组分可直接加入。
(6)2-甲基醛缩苯胺光亮剂的配制:将结晶碳酸钠、水l20mL,异丙醇l00mL倒人三口烧瓶中,接回流管冷却,自漏斗中慢慢加入乙醛150mL,此为放热反应,要冷却反应釜外壁,使反应温度在15℃~20℃下。
待乙醛加完后可允许稍加热,直至出现淡黄色或灰绿色。
然后自漏斗中加入邻甲苯胺50mL及异丙醇500mL,溶液渐变为橙红色。
将混和物置于热水浴中(85℃~90℃)回流2h,用异丙醇稀至1L。
该光亮剂在冷冻介质中避光存放,可在较长时间不变质。
MT4 Phase Diagram of Pb-Sn Alloys Name:SHI Tai Student Number:52888227 1. Purposes:1. Define component, phase, diagram phase, and cooling curve. 2. Describe the phase change taking place at different point on a cooling curve. 3. Construct a diagram from cooling curves. 2. Instruments and specimens: Crucibles Thermoelectric couple Heating-furnace Multi-channel graph recorder Stirrer bar Specimens: Channel 0 1 2 3 4 5 Sn 100% 80% 62% 40% 10% -- Pn -- 20% 38% 60% 90% 100%
3. Introduction: A phase diagram is a plot of the equilibrium state of a system. A eutectic system can occur when terminal solid solutions exist on both end of the binary equilibrium phase diagram. In the Pb-Sn alloys system, there are two solid solutions-α and β. The α phase indicates a solid solution of tin in lead, whereas β presents in the opposite way. The eutectic invariant point appears at 61.9 wt% Sn. The maximum solid-state solubility both occur at 183℃ which is referred to as the eutectic temperature. At this temperature, there exists a point on the phase diagram (a single combination of composition and temperature) where three phases (the two solids and a solid) can exist simultaneously in equilibrium. This combination of temperature and composition is an invariant point on the binary diagram like the freezing point of water on the single component system the eutectic reaction where upon cooling L→α+β represents the isothermal transformation of liquid into two different solids. Depending upon the overall bulk composition of the system, a variety of different equilibrium microstructures are possible. However, as mentioned above, equilibrium requires sufficient time for the system to find the minimum in free energy. In real systems, this is not always possible and non-equilibrium microstructures are common. When this same type of reaction occurs in the solid state where one solid decomposes into two new solid phases isothermally, this is called a eutectoid reaction. γ→α+β. These relationships are determined by these principles of the thermodynamics and have practical applications in many fields of science and engineering.
4. Procedure: 1. Setting up the apparatus. 2. Switch on the bottoms to heat coil until the temperature up to around 400℃. 3. Switch on Multi-channel graph recorder and set the chart speed. 4. Control the cooling rate under 5℃ per minute. 5. Turn off the bottoms when the temperatures of the specimens fall down to 100℃. 0 1000 2000 3000 4000 0 50
100
150 200 250 300 350 400 450 0 1 2 3 4 5
Amplified Cooling Curves of Pb-Sn Alloys
Time(s)
5. Results and Discussions Figure 1 Figure 2 Temperature(℃) Table1. The composition of Pb-Sn Alloys Sample 0 1 2 3 4 5 Content (wt%) Sn 100 80 62 40 10 0 Pb 0 20 38 60 90 100
Table2. Arrest points of Pb-Sn Alloys Sample 0 1 2 3 4 5 Temperature ℃ 237 204 186 243 303 326 186 186
Figure 3 The experimental and standard Pb-Sn phase graph As can be seen from the experimental and standard diagram of Pb-Sn alloys, there are some diversities between them. This experiment studys the binary Pb-Sn system dominated of eutectic alloy system. It is clearly finds the two different elements are absolutely soluble in each other under the liquid condition, while only partially soluble in the solid phase. Alloys in which solid-to-solid convention occurred are easily analyzed for phase graph through the cooling curve method of thermal analysis. This is because the solid condition transformation is often sluggish and the thermal exchange is too small that we can hardly discover by cooling curves.
6. The answer to the questions 1. What is the expected difference in cooling curves for Pb-10 percent Sn and Pb-40 percent Sn alloys? Explian. The cooling curve of 10 percent Sn in Pb has a constant melting piont at 303℃, while the curve for Pb-40 percent Sn ranging from 186℃ to 243℃. This is mainly due to the composition of the alloy. 2. Discuss the arrest point in Pb-62 percent Sn alloy. The point is the Eutectic point and the transformation through this point is called Eutectic reaction: L→α+β. It is clearly see the arrest temperature of Pb-Sn alloys is about 186℃, which is a bit different from the data shown in the standard Pb-Sn phase graph (183℃). The reasons may be the follow three. First, a member of our group touched the heat-sensitive line during the experiment, which leads to inaccuracy of measurement. Second, the specimens of Pb-Sn alloys have been used for many times so that they may be partly oxidation by the air, that is to say, the samples is