烯烃和炔烃的性质
- 格式:ppt
- 大小:1.47 MB
- 文档页数:16


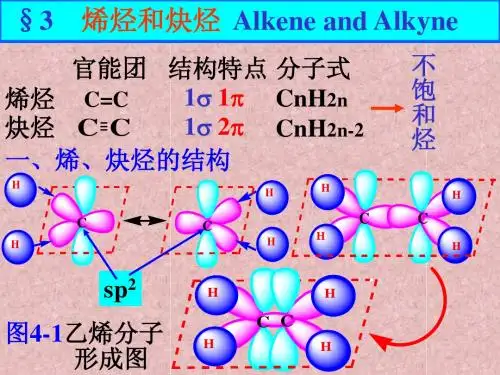






《烯烃炔烃》讲义一、烯烃(一)烯烃的定义和结构烯烃是一类含有碳碳双键(C=C)的不饱和烃。
最简单的烯烃是乙烯(C₂H₄)。
从结构上看,碳碳双键中的两个碳原子采用 sp²杂化方式,形成三个σ 键和一个π 键。
π 键的存在使得烯烃的化学性质较为活泼。
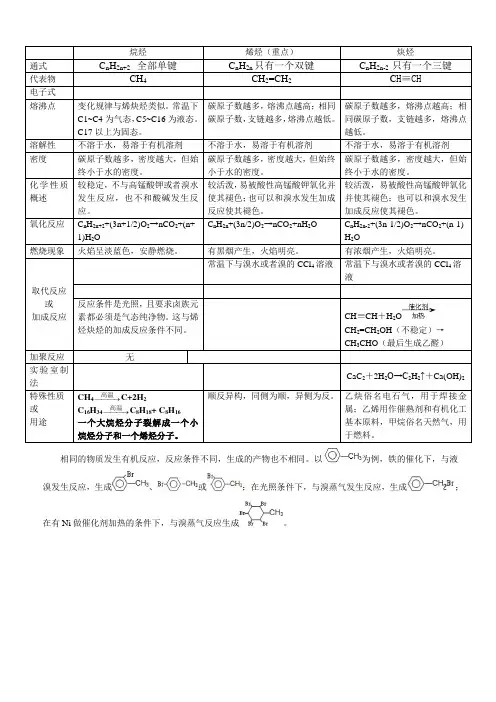
(二)烯烃的通式烯烃的通式为 CₙH₂ₙ(n≥2),其中 n 表示碳原子的个数。
(三)烯烃的命名1、选择含有双键的最长碳链作为主链。
2、从靠近双键的一端开始编号,使双键的位置编号最小。
3、标明双键的位置,将双键的位置数字写在烯烃名称的前面。
例如,CH₃CH=CHCH₃命名为 2-丁烯。
(四)烯烃的物理性质1、状态在常温常压下,含 2 到 4 个碳原子的烯烃为气体,含 5 到 18 个碳原子的烯烃为液体,含 18 个以上碳原子的烯烃为固体。
2、溶解性烯烃难溶于水,易溶于有机溶剂。
3、密度烯烃的密度一般比水小。
(五)烯烃的化学性质1、加成反应(1)与氢气加成例如,乙烯与氢气在催化剂的作用下发生加成反应生成乙烷:CH₂=CH₂+ H₂ → CH₃CH₃(2)与卤素加成乙烯能与溴的四氯化碳溶液发生加成反应,使溴的红棕色褪去:CH₂=CH₂+ Br₂ → CH₂BrCH₂Br(3)与卤化氢加成乙烯与氯化氢加成生成氯乙烷:CH₂=CH₂+HCl → CH₃CH₂Cl (4)与水加成在一定条件下,乙烯与水发生加成反应生成乙醇:CH₂=CH₂+H₂O → CH₃CH₂OH2、氧化反应(1)燃烧烯烃燃烧生成二氧化碳和水,如乙烯燃烧的化学方程式为:C₂H₄+ 3O₂ → 2CO₂+ 2H₂O(2)使酸性高锰酸钾溶液褪色烯烃能被酸性高锰酸钾溶液氧化,从而使酸性高锰酸钾溶液褪色。
3、聚合反应由小分子的烯烃通过加成聚合形成高分子化合物的反应称为聚合反应。
例如,乙烯聚合生成聚乙烯:nCH₂=CH₂ → CH₂CH₂ₙ二、炔烃(一)炔烃的定义和结构炔烃是一类含有碳碳三键(—C≡C—)的不饱和烃。

烷烃烯烃炔烃知识点总结烷烃、烯烃和炔烃都是有机化合物中的一类,它们的分子结构不同,因而具有不同的性质和用途。
以下是对这三类化合物的详细总结。
一、烷烃1.定义烷烃是由碳和氢组成的有机化合物,其分子中只含有单键,没有双键或三键。
2.分类根据碳原子数目不同,可以将烷烃分为甲烷、乙烷、丙烷等。
根据分子结构不同,可以将其分为链式、支链式、环式等。
3.性质(1)无色无味,易挥发。
(2)不溶于水,在非极性溶剂中可溶。
(3)稳定性高,在常温下不易发生反应。
4.应用(1)作为化学反应中的溶剂和催化剂。
(2)作为能源来源,如天然气和液化气。
二、烯烃1.定义烯烃是由碳和氢组成的有机化合物,其分子中含有一个或多个双键。
2.分类根据双键位置不同,可以将其分为顺式异构体和反式异构体。
根据链状结构不同,可以将其分为直链烯烃和支链烯烃。
3.性质(1)易发生加成反应,如与氢气加成生成烷基化合物。
(2)容易被氧化,如与空气中的氧气接触会发生自由基反应。
4.应用(1)作为溶剂、催化剂和原料。
(2)制备聚合物,如聚乙烯、聚丙烯等。
三、炔烃1.定义炔烃是由碳和氢组成的有机化合物,其分子中含有一个或多个三键。
2.分类根据三键位置不同,可以将其分为内炔和外炔。
根据链式结构不同,可以将其分为直链炔和支链炔。
3.性质(1)容易发生加成反应,如与卤素加成生成卤代化合物。
(2)容易被氧化,并在高温下易爆。
4.应用(1)作为溶剂、催化剂和原料。
(2)制备聚合物,如聚乙炔等。
总结:以上是对于有机化合物中的三类化合物——烷烃、烯烃和炔烃的详细总结。
它们在分子结构、性质和应用等方面都有所不同,但都具有广泛的应用价值。
对于有机化学的学习和实践,这些知识点是必须掌握的。