烷烃、烯烃和炔烃的物理性质和化学性质(B4排版)
- 格式:doc
- 大小:343.50 KB
- 文档页数:3

烷烯炔的结构与性质烷烯炔是有机化合物中常见的一类化合物,它们在化学反应和应用中具有重要的地位。
本文将对烷烯炔的结构与性质进行探讨。
一、烷烯炔的结构烷烯炔由碳、氢原子组成,其中碳原子形成链状结构,并与氢原子通过共价键相连。
烷烯炔分为烷烃、烯烃和炔烃三类。
烷烃中的碳原子之间通过单键相连,无不饱和键;烯烃中有一个或多个双键,其中一个碳原子与另一个碳原子之间通过一个双键相连;炔烃中有一个或多个三键,其中一个碳原子与另一个碳原子之间通过一个三键相连。
二、烷烯炔的性质1. 物理性质烷烯炔的物理性质与其分子结构有关。
一般来说,烷烯炔在常温常压下为无色气体或液体,呈无色透明状。
烷烯炔的沸点较低,挥发性强。
2. 化学性质烷烯炔的化学性质较为活泼,容易发生反应。
以下是烷烯炔常见的化学反应及其性质。
(1)加成反应:烷烯炔与其他化合物中较活泼的原子或原团发生加成反应,生成新的有机化合物。
这类反应常见的有氢化、卤化等。
例如,炔烃可以与氯气反应生成取代的炔烃。
(2)氧化反应:烷烯炔在强氧化剂的作用下可以发生氧化反应,生成醛、酮、羧酸等有机化合物。
例如,丙炔经过氧化反应可以生成丙酮。
(3)聚合反应:烯烃和炔烃可以发生聚合反应,生成高分子化合物。
例如,乙烯可以聚合成聚乙烯等。
三、烷烯炔的应用烷烯炔在化学工业中具有广泛的应用。
以下是烷烯炔的几个应用领域。
1. 燃料和能源烷烯炔在燃料领域有重要的作用。
例如,烯烃被用作高效燃料,如乙烯可以用于制造乙烯燃料。
2. 合成材料烷烯炔可以用于合成各种高分子材料,如聚乙烯、聚丙烯、聚丁烯等。
这些材料在塑料、纤维和橡胶等领域中具有广泛的应用。
3. 医药领域烷烯炔在医药领域中也有重要的应用。
一些炔烃化合物被用作医药中间体,如乙炔酸可以用于合成某些药物。
4. 农药和化肥烷烯炔可以用于制造农药和化肥,如丙炔可以用于制造杀菌剂。
5. 光电材料烯烃和炔烃可以用于合成光电材料,如聚苯乙烯可以用于制造光纤。
综上所述,烷烯炔是一类重要的有机化合物,具有丰富的结构和多样的化学性质。

烷烃烯烃和炔烃的结构和性质有哪些基本特征烷烃烯烃和炔烃是有机化合物中的三种基本类别。
它们在化学结构和性质上都具有一些基本特征。
下面将分别介绍烷烃烯烃和炔烃的结构和性质。
烷烃是由碳和氢原子组成的碳氢化合物,其分子式为CnH2n+2。
烷烃分子中的碳原子通过共价键连接在一起,形成直链或支链结构。
烷烃的碳原子通过单键连接,每个碳原子还与四个氢原子形成单键。
这种结构使烷烃分子具有饱和的化学环境,因此烷烃通常比较稳定。
烷烃根据碳原子数目的不同可以分为甲烷、乙烷、丙烷等。
烯烃是具有碳碳双键的烃类化合物,其分子式为CnH2n。
烯烃分子中含有至少一个碳碳双键,这使得烯烃分子具有较为活泼的化学性质。
由于双键的存在,烯烃分子可以进行加成反应、烯烃的碳碳双键可以被氢气直接加成,生成相应的饱和烃。
烯烃根据碳原子数目的不同可以分为乙烯、丙烯、丁烯等。
炔烃是具有碳碳三键的烃类化合物,其分子式为CnH2n-2。
炔烃分子中含有至少一个碳碳三键,这使得炔烃分子具有极高的反应活性。
由于三键的存在,炔烃分子可以进行加成反应、炔烃的碳碳三键可以被氢气加成形成烯烃;炔烃还可以进行消除反应,使一个炔烃分子中的两个氢原子脱去,形成芳烃分子。
炔烃根据碳原子数目的不同可以分为乙炔、丙炔、丁炔等。
烷烃烯烃和炔烃具有某些共同特征。
首先,它们的化学结构都以碳原子链为基础,通过共价键连接。
其次,它们中的碳原子都处于sp3杂化状态(烷烃)或sp2杂化状态(烯烃和炔烃),这种杂化状态影响了它们的结构和化学性质。
此外,烷烃烯烃和炔烃都是无色、无味的气体或液体,在常温下主要以分子形式存在。
然而,烷烃烯烃和炔烃也存在一些区别。
最显著的区别是它们的饱和度和反应性。
烷烃是饱和化合物,其所有碳原子均以单键连接,并且由于没有不饱和键的存在,烷烃的反应性较低。
烯烃和炔烃都是不饱和化合物,它们中至少存在一个碳碳双键或三键,这使得它们具有较高的反应活性。
除此之外,由于不同的碳碳键类型,烯烃和炔烃具有不同的化学性质。

烷烃、烯烃、炔烃及苯知识点总结————————————————————————————————作者:————————————————————————————————日期:甲烷 、烷烃知识点烃:仅含碳和氢两种元素的有机物称为碳氢化合物,又叫烃,在烃中最简单的是甲烷 一、甲烷的物理性质无色、无味,难溶于水的,比空气轻的,能燃烧的气体,天然气、坑气、沼气等的主要成分均为甲烷。
收集甲烷时可以用排水法 二、甲烷的分子结构甲烷的分子式:CH 4 电子式: 结构式: (用短线表示一对共用电子对的图式叫结构式) [模型展示]甲烷分子的球棍模型和比例模型。
得出结论:以碳原子为中心,四个氢原子为顶点的正四面体结构。
甲烷是非极性分子,所以甲烷极难溶于水,这体现了相似相溶原理。
CH 4:正四面体 NH 3:三角锥形三、甲烷的化学性质 1.甲烷的氧化反应CH 4+2O 2−−→−点燃CO 2+2H 2Oa.方程式的中间用的是“ ”(箭头)而不是“====”(等号), 主要是因为有机物参加的反应往往比较复杂,常有副反应发生。
b.火焰呈淡蓝色:CH 4、H 2、CO 、H 2S在通常条件下,甲烷气体不能被酸性KMnO 4溶液氧化而且与强酸、强碱也不反应,所以可以说甲烷的化学性质是比较稳定的。
但稳定是相对的,在一定条件下也可以与一些物质如Cl 2发生某些反应。
2.甲烷的取代反应现象:①量筒内Cl 2的黄绿色逐渐变浅,最后消失。
②量筒内壁出现了油状液滴。
③量筒内水面上升。
④量筒内产生白雾[说明]在反应中CH 4分子里的1个H 原子被Cl 2分子里的1个Cl 原子所代替..,但是反应并没有停止,生成的一氯甲烷仍继续跟氯气作用,依次生成二氯甲烷、三氯甲烷和四氯甲烷,反应如下:a.注意CH4和Cl2的反应不能用日光或其他强光直射,否则会因为发生如下剧烈的强光C+4HCl而爆炸。
反应:CH4+2Cl2−−−→b.在常温下,一氯甲烷为气体,其他三种都是液体,三氯甲烷(氯仿)和四氯甲烷(四氯化碳)是工业重要的溶剂,四氯化碳还是实验室里常用的溶剂、灭火剂,氯仿与四氯化碳常温常压下的密度均大于1 g·cm-3,即比水重。

烷烃烯烃炔烃总结表格类别分子式结构式物理性质化学性质烷烃CnH2n+2 以单键相连的碳链无色、无味、无臭稳定、不与酸、碱反应烯烃CnH2n 以双键相连的碳链无色、无味、有臭味不稳定,在空气中易氧化、可与卤素反应炔烃CnH2n-2 以三键相连的碳链无色、无味、有臭味不稳定,易聚合、容易燃烧、可与卤素反应烷烃(Alkanes)烷烃是由碳和氢构成的碳氢化合物,也被称为脂肪烃。
烷烃分子中只含有单键,结构上形成线性的碳链或支链。
烷烃是饱和烃的一种,因为它们的碳原子与最大可能数量的氢原子相连接。
物理性质•颜色:烷烃是无色的。
•味道:烷烃是无味的。
•气味:烷烃是无臭的。
•状态:烷烃是气体或液体,分子量较大的烷烃可以是固体。
化学性质•稳定性:烷烃是相对稳定的化合物,不容易与酸或碱发生反应。
•反应性:烷烃的化学反应性较低。
在一些特定条件下,如高温、压力和合适的催化剂存在的情况下,烷烃可以和氧气发生完全燃烧反应。
烯烃(Alkenes)烯烃是由碳和氢构成的碳氢化合物,其中含有至少一个双键。
烯烃分子中的双键可以形成直链、支链或环状的结构。
物理性质•颜色:烯烃是无色的。
•味道:烯烃是无味的。
•气味:烯烃具有一种特殊的臭味。
化学性质•稳定性:烯烃相较于烷烃来说不稳定,容易发生自身的反应,如聚合反应。
•氧化性:烯烃在空气中容易氧化,形成环氧化合物。
•卤素反应:烯烃可以与卤素发生加成反应,生成卤代烷化合物。
炔烃(Alkynes)炔烃是由碳和氢构成的碳氢化合物,其中含有至少一个三键。
炔烃分子中的三键可以形成直链、支链或环状的结构。
物理性质•颜色:炔烃是无色的。
•味道:炔烃是无味的。
•气味:炔烃具有一种特殊的臭味。
化学性质•稳定性:炔烃比烯烃更不稳定,容易发生聚合和燃烧反应。
•燃烧性:炔烃是易燃物质,容易在氧气中燃烧。
•卤素反应:炔烃可以与卤素发生加成反应,生成卤代炔化合物。
综上所述,烷烃、烯烃和炔烃是碳氢化合物的三个重要类别。
它们在物理性质和化学性质上有所不同,具有各自的特点和应用价值。

初中化学知识点归纳烃类化合物的分类和性质初中化学知识点归纳—烃类化合物的分类和性质烃是由碳和氢构成的有机化合物,可分为脂肪烃、烯烃、炔烃和环烃四个类别。
本文将分别介绍这四类烃的命名规则、结构特点以及常见的物理和化学性质。
一、脂肪烃脂肪烃由碳原子链组成,分为直链和支链两种。
命名规则为“烷+烯(表示含有双键)+炔(表示含有三键)+环”。
1. 直链烷烃:由碳原子链直接连接而成,通式为CnH2n+2。
例如,甲烷、乙烷等。
直链烷烃的物理性质与碳原子数目有关,随着碳原子数目的增加,沸点和密度也逐渐升高。
2. 支链烷烃:在碳链上含有分支,通式为CnH2n。
例如,异丙烷、异丁烷等。
支链烷烃的物理性质通常与直链烷烃相比较,熔点、沸点和密度较低。
二、烯烃烯烃是含有碳碳双键的烃类化合物,分为直链烯烃、支链烯烃和环烯烃三种。
1. 直链烯烃:由碳原子链构成,其中至少有一个碳碳双键。
命名规则为“烯+烷+二烯(表示有两个双键)”等。
例如,乙烯、丙烯等。
直链烯烃通常为无色气体,密度较小。
2. 支链烯烃:在碳链上含有分支,同时有碳碳双键存在。
支链烯烃的物理性质与直链烯烃类似,但熔点和沸点通常较低。
3. 环烯烃:由碳原子组成的环状结构,其中至少有一个碳碳双键。
例如,环己烯、环戊烯等。
环烯烃的物理性质与直链烯烃相似,但由于环状结构的存在,活性可能增加。
三、炔烃炔烃是含有碳碳三键的烃类化合物,常常具有较高的活性。
根据碳原子链的不同,炔烃可以分为直链炔烃和环炔烃两种。
1. 直链炔烃:由碳原子链构成,其中至少有一个碳碳三键。
命名规则为“炔+烷+炔(表示有两个三键)”等。
例如,乙炔、丙炔等。
直链炔烃为无色气体,密度较小。
2. 环炔烃:由碳原子组成的环状结构,其中至少有一个碳碳三键。
例如,环丙炔、环戊炔等。
环炔烃的物理性质与直链炔烃类似,但由于环状结构的存在,活性可能增加。
四、环烃环烃是由碳原子构成的环状结构,其中没有双键或三键。
根据环的数目,环烃可以分为单环烃、多环烃和螺环烃等。

各类有机物性质一览表有机物是由碳和氢等元素组成的化学物质,其性质多种多样。
本文将为您提供一份各类有机物性质的一览表,帮助您更好地了解和掌握有机化学的知识。
一、烃类烃类是由碳和氢组成的有机化合物,包括烷烃、烯烃和炔烃三类。
1. 烷烃(Alkanes):- 物理性质:a) 烷烃一般为无色气体或液体,随碳链增长而升高沸点和融点。
b) 烷烃的密度较小,常用比重瓶法测定。
- 化学性质:a) 烷烃可以发生取代反应,如卤代烷生成取代产物。
b) 在适当条件下,烷烃还可以发生燃烧反应,生成二氧化碳和水。
2. 烯烃(Alkenes):- 物理性质:a) 烯烃常见的是无色气体或液体,在室温下存在。
b) 烯烃的密度通常较小。
- 化学性质:a) 烯烃可以进行加成反应,如与溴水生成溴代烷。
b) 烯烃还可以进行聚合反应,生成高分子化合物。
3. 炔烃(Alkynes):- 物理性质:a) 炔烃一般为无色气体或液体。
b) 炔烃的密度相对较小。
- 化学性质:a) 炔烃可以进行加成反应,如与溴水生成溴代炔烃。
b) 炔烃可以和水反应生成醛和酮。
二、醇类醇是含有羟基(—OH)的有机化合物。
1. 一元醇(Monohydroxy Alcohols):- 物理性质:a) 一元醇常见的是无色液体。
b) 醇的氢键使其具有比醚、酮和醛有更高的沸点。
- 化学性质:a) 一元醇可以发生酯化反应,生成酯类化合物。
2. 二元醇(Polyhydroxy Alcohols):- 物理性质:a) 二元醇一般为无色液体。
b) 二元醇的水溶液具有较高的粘度。
- 化学性质:a) 二元醇可以发生糖化反应,生成糖类化合物。
三、酮类酮是含有羰基(C=O)的有机化合物。
1. 简单酮(Simple Ketones):- 物理性质:a) 简单酮常为无色液体。
b) 酮的沸点较相应的醇和醚高。
- 化学性质:a) 简单酮可以发生还原反应,生成相应的醇。
2. 糖酮(Sugar Ketones):- 物理性质:a) 糖酮常为无色或白色固体。
高中化学“烷烃、烯烃和炔烃的比较”
关键词:高中化学、“烷烃、烯烃和炔烃的比较”、知识归纳
进入有机化学的世界后,我们就陆续地学习了烷烃、烯烃和炔烃。
有同学就要抱怨啦,老师我们无机还没吃透呢,这又来有机,快噎死了!别着急,先长吁一口气缓缓。
今天这期我们就来PK一下“烷烃、烯烃和炔烃”。
给你屡出有机的头绪。
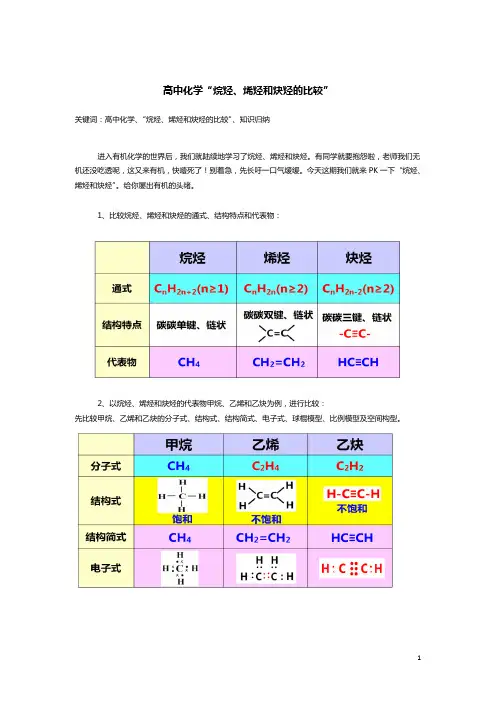
1、比较烷烃、烯烃和炔烃的通式、结构特点和代表物:
2、以烷烃、烯烃和炔烃的代表物甲烷、乙烯和乙炔为例,进行比较:
先比较甲烷、乙烯和乙炔的分子式、结构式、结构简式、电子式、球棍模型、比例模型及空间构型。
再接着比较甲烷、乙烯和乙炔的化学性质。
分别从氧化反应、取代反应、加成反应和加聚反应来比较。
从这里(上图)我们可以得出结论:
从这里(上图)我们可以得出结论:
化学中我们常说“结构决定性质”,放在这里就很有说服力。
因为烷烃是饱和烃,只有碳碳单键,所以只能发生取代反应;而烯烃和炔烃是不饱和的烃,分别有碳碳双键和碳碳三键,所以可以发生加成反应和加聚反应。
以后在有机物的学习中,慢慢融合“结构决定性质”的思想。
分析一个新的有机物,就可以从结构到性质,抽丝剥茧,一条一条屡清楚了。
好了,就说这么多,赶紧消化一下吧!。



炔烃的性质总结炔烃是一类具有炔基(C≡C)的有机化合物。
由于炔基的存在,炔烃表现出一系列独特的性质。
本文将就炔烃的物理性质、化学性质以及一些重要的反应进行总结。
一、物理性质1.密度:炔烃的密度一般较小,且随碳链长度的增加而增大。
2.沸点和熔点:炔烃的沸点和熔点通常较低,随着碳链长度的增加,沸点和熔点逐渐升高。
3.溶解性:炔烃在水中极不溶解,但可溶于一些有机溶剂,比如乙醇、丙酮等。
二、化学性质炔烃具有较强的活性,容易参与各种化学反应。
1. 氧化反应炔烃可参与氧化反应,例如与氧气反应生成二氧化碳和水,反应通常是放热的。
C2H2 + 2.5O2 → 2CO2 + H2O ΔH = -1299.5 kJ/mol2. 加成反应炔烃的碳碳三键可以发生加成反应。
典型的例子是炔烃与氢气的加成反应,生成烯烃。
C2H2 + H2 → C2H4此外,炔烃还可以与卤素(如氯、溴)、氢卤酸(如盐酸、氢溴酸)等发生加成反应。
3. 氢化反应炔烃可以与氢气发生氢化反应,生成饱和烃。
C2H2 + 2H2 → C2H64. 炔烃的重要反应4.1 叠氮化反应炔烃可以与叠氮化物(如次氯酸钠)反应,生成底物中炔基上的氢被叠氮基取代的产物。
C2H2 + NaNO2 + HCl → C2H2N2Cl + NaCl + H2O4.2 重排反应炔烃在一定条件下可以发生重排反应,生成不同构的同分异构体。
4.3 氯化反应炔烃可以与氯气发生氯化反应,生成相应的氯代烃。
C2H2 + Cl2 → C2H2Cl24.4 烷化反应炔烃与醇或醛反应,可以发生烷化反应,生成相应的饱和化合物。
C2H2 + CH3OH → C2H2H4O5. 炔烃聚合反应炔烃可以发生聚合反应,生成具有碳碳双键的高分子化合物。
2C2H2 → (C2H2)n (n表示聚合度)三、结语炔烃的性质主要由其炔基决定,具有一系列特殊的物理性质和化学性质。
通过了解炔烃的性质,有助于我们更好地理解和应用这类重要的有机化合物。
烷烃、烯烃、炔烃的结构与性质1.烷烃、烯烃、炔烃的组成、结构特点和通式2.脂肪烃的物理性质3.脂肪烃的化学性质比较注意 烷烃与卤素单质的取代反应是分子中的氢原子逐步被取代,并且是各步反应同时进行,产物是烃的多种卤代物的混合物和卤化氢。
深度思考按要求书写方程式: (1)乙烷和Cl 2生成一氯乙烷CH 3CH 3+Cl 2――→光CH 3CH 2Cl +HCl 。
(2)烷烃的燃烧通式C n H 2n +2+3n +12O 2――→点燃n CO 2+(n +1)H 2O 。
(3)单烯链烃的燃烧通式C n H 2n +32n O 2――→点燃n CO 2+n H 2O 。
(4)丙烯的主要化学性质 ①使溴的CCl 4溶液褪色;②与H 2O 的加成反应;③加聚反应。
(5)单炔链烃的燃烧通式C n H 2n -2+3n -12O 2――→点燃n CO 2+(n -1)H 2O 。
(6)乙炔的主要性质 ①乙炔和H 2生成乙烷CH ≡CH +2H 2――→催化剂△CH 3CH 3; ②乙炔和HCl 生成氯乙烯 CH ≡CH +HCl ――→催化剂△CH 2CHCl ; ③氯乙烯的加聚反应。
(7)CH2===CH—CH===CH2与Br2 1∶1加成可能的反应:①CH2===CH—CH===CH2+Br2―→;②CH2===CH—CH===CH2+Br2―→。
题组一脂肪烃的结构与性质1.(2016·安徽无为中学月考)在1.013×105Pa下,测得的某些烷烃的沸点见下表。
据表分析,下列说法正确的是( )异戊烷新戊烷A.在标准状况时,新戊烷是气体B.在1.013×105 Pa、20 ℃时,C5H12都是液体C.烷烃随碳原子数的增加,沸点降低D.C5H12随支链的增加,沸点降低2.科学家在-100 ℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键)。
下列说法正确的是 ( )A.X既能使溴的四氯化碳溶液褪色,又能使酸性KMnO4溶液褪色B.X是一种常温下能稳定存在的液态烃C.X和乙烷类似,都容易发生取代反应D.充分燃烧等质量的X和甲烷,X消耗氧气较多3.某有机物的结构简式为HC≡C—C≡C—C≡C—C≡C—C≡C—C≡CH下列描述正确的是( )A.该有机物常温常压下呈气态,且易溶于水B.该有机物能使酸性高锰酸钾溶液褪色C.该有机物分子为直线形的极性分子D.该有机物可由乙炔和含氮化合物加聚制得题组二烯烃、炔烃的加成和氧化反应规律4.(2016·沈铁实验中学月考)玫瑰的香味物质中包含苧烯,苧烯的键线式为。
烃的分类和性质烃是一类由碳和氢组成的有机化合物,它们是化学界中最基本的化合物之一。
烃可以根据分子结构和性质的不同而进行分类。
本文将介绍烃的分类和性质,并探讨它们在化工和生活中的应用。
一、烃的分类根据分子结构和碳原子之间的连接方式,烃可以分为以下几类:烷烃、烯烃和炔烃。
1. 烷烃:烷烃是由碳原子通过单键连接形成的链状结构化合物。
烷烃的通用分子式为CnH2n+2,其中n代表碳原子数。
常见的烷烃有甲烷、乙烷、丙烷等。
烷烃是最简单的烃类,由于其分子中只含有碳碳单键和碳氢键,分子间的相互作用较弱,常见于天然气和石油中。
2. 烯烃:烯烃是由碳原子通过一个或多个双键连接形成的化合物。
烯烃的通用分子式为CnH2n,其中n代表碳原子数。
常见的烯烃有乙烯、丙烯、苯乙烯等。
烯烃比烷烃分子中含有的双键使得它们更加活泼,具有较强的反应性。
3. 炔烃:炔烃是由碳原子通过一个或多个三键连接形成的化合物。
炔烃的通用分子式为CnH2n-2,其中n代表碳原子数。
常见的炔烃有乙炔、丙炔等。
炔烃由于含有三键,在化学反应中起到重要的作用,例如乙炔和氯气反应可以生成氯乙烯。
二、烃的性质1. 物理性质:烃通常是无色无味的液体或气体,随着碳原子数的增加,它们的沸点和熔点增加。
此外,由于烃分子中只含有碳氢键,分子间的相互作用较弱,使得烃具有较低的溶解度。
2. 化学性质:烃可以发生多种化学反应,例如燃烧、加氢、卤代反应等。
其中,烃的燃烧是最常见的反应,它们与氧气反应可以生成二氧化碳和水。
另外,在适当的催化剂存在下,烯烃和炔烃可以发生加氢反应,使得双键或三键转化为饱和的单键。
三、烃的应用烃在化工和生活中有广泛的应用。
1. 燃料:由于烃具有较高的燃烧热值和可燃性,常常被用作燃料。
烷烃类燃料如天然气、液化石油气等直接用于供暖、烹饪等生活用途,而汽油、柴油等则作为交通工具的燃料。
2. 化工原料:烃是化工行业中重要的原料之一,广泛应用于合成农药、塑料、橡胶、涂料、染料等产品。
《烯烃炔烃》炔烃的结构与性质在有机化学的世界里,烯烃和炔烃是两类非常重要的不饱和烃。
今天,咱们就专门来聊聊炔烃的结构与性质,一起揭开它神秘的面纱。
先来说说炔烃的结构。
炔烃的分子中含有碳碳三键(C≡C),这是它最显著的结构特征。
以最简单的炔烃——乙炔(C₂H₂)为例,两个碳原子之间通过一个三键相连,每个碳原子还分别与一个氢原子结合。
碳碳三键是由一个σ 键和两个π 键组成的。
这σ 键比较“坚强”,键能较大,而两个π 键则相对“脆弱”一些。
由于三键的存在,炔烃分子中的碳原子采取 sp 杂化。
这种杂化方式使得碳原子的两个 sp 杂化轨道在同一直线上,分别与氢原子或其他原子形成σ 键,而未参与杂化的两个p 轨道则相互垂直,与另一个碳原子的两个p 轨道“肩并肩”重叠,形成两个π 键。
接下来看看炔烃的物理性质。
通常情况下,随着碳原子数的增加,炔烃的沸点和熔点逐渐升高。
不过,总体来说,炔烃的沸点和熔点比相同碳原子数的烷烃和烯烃要低一些。
在常温常压下,含四个碳原子以下的炔烃大多是气态,从五个碳原子开始逐渐变为液态和固态。
再来说说炔烃的化学性质。
由于碳碳三键的存在,炔烃具有一些独特的化学反应。
首先是加成反应。
这就像是炔烃的“好客”特性,它很愿意与其他物质结合。
比如,与氢气发生加成反应,可以生成相应的烯烃或烷烃。
如果是和卤素(如氯气、溴气)加成,会分步进行,先加成一个卤素原子,形成二卤代烯烃,然后再继续加成,得到四卤代烷烃。
和卤化氢的加成也类似,遵循马氏规则。
其次是氧化反应。
炔烃在一定条件下可以被氧化,比如在高锰酸钾等强氧化剂的作用下。
不过,炔烃的氧化反应比烯烃要复杂一些,产物会因反应条件的不同而有所差异。
然后是聚合反应。
就像小伙伴们手拉手组成一个团队一样,炔烃分子也可以相互连接起来,形成高分子化合物。
比如,乙炔在特定条件下可以聚合成聚乙炔。
还有金属炔化物的生成。
这是炔烃的一个有趣的性质。
比如,乙炔与银氨溶液或亚铜氨溶液反应,可以生成白色的乙炔银沉淀或红棕色的乙炔亚铜沉淀。
烷烃、烯烃和炔烃知识梳理:一、脂肪烃(即链状烃)1、脂肪烃代表物----甲烷、乙烯、乙炔的组成和结构名称 分子式 结构式 结构简式 电子式 空间构型 甲烷 CH 4 CH 4 正四面体 乙烯 C 2H 4 CH 2=CH 2 平面形 乙炔 C 2H 2 直线形2、脂肪烃的物理性质(1)状态:常温下含有1-4个碳原子的烃及新戊烷为气态,随碳原子数的增多,逐渐过渡到液态、固态。
(2)随着碳原子数的增多,沸点逐渐升高。
(3)同分异构体之间,支链越多,沸点越低。
(4)在水中的溶解性:难溶于水。
3、脂肪烃的化学性质 (1)烷烃的取代反应①取代反应:有机物分子中某些原子或原子团被其他原子或原子团所取代的反应。
②烷烃的卤代反应(2)烯烃、炔烃的加成反应①加成反应:有机物分子中的不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应。
②烯烃、炔烃的加成反应乙烯的反应:特 点:反应条件: (不能为强光,易爆炸) 无机试剂:卤素单质(纯净物,不是水溶液)产物特点:多种卤代烃混合物+HX (X 为卤素原子),生成物不只有一种量的关系:取代1mol 氢原子,消耗1mol 卤素单质Br 2HCl乙炔的反应:(3)烯烃的加聚反应 ①乙烯的加聚反应:②氯乙烯的加聚反应:规律:只有单体的不饱和碳形成高聚物的主链,其他形成支链。
4、氧化反应 (1)燃烧 名称 含碳量 现象 化学方程式甲烷 75% 逐渐增大淡蓝色火焰 乙烯 85.7% 火焰明亮并伴有黑烟 乙炔 92.3%火焰明亮并伴有浓厚的黑烟(2)乙烯、乙炔褪色(生成CO2)(3)烃的燃烧通式5、现象总结水Br 2高锰酸钾酸性溶液试剂烃液溴溴水溴的四氯化碳溶液高锰酸钾酸性溶液烷烃与溴蒸气在光照条件下发生取代反应不反应,液态烷烃和溴水可以发生萃取而使溴水层褪色不反应,溶解,不褪色不反应,不褪色烯烃常温加成,褪色常温加成,褪色常温加成,褪色氧化,褪色炔烃常温加成,褪色常温加成,褪色常温加成,褪色氧化,褪色烷烃、烯烃、炔烃练习题专题一:烷烃、烯烃、炔烃的命名1.某烷烃的结构为:下列命名正确的是:()A. 2,4—二甲基—3—乙基己烷 B. 3—异丙基—4—甲基已烷C. 2—甲基—3,4—二乙基戊烷D. 3—甲基—4—异丙基已烷2、命名下列物质:3、下列命名中正确的是()A.3—甲基丁烷 B.2,2,4,4—四甲基辛烷C.1,1,3—三甲基戊烷 D.4—丁烯专题二:烷烃、烯烃、炔烃的化学性质1、下列反应中属于加成反应的是A.乙烯使酸性高锰酸钾溶液褪色B.将四氯化碳滴入溴水中,振荡后水层接近无色C.乙烯使溴水褪色D.甲烷与氯气混合,黄绿色消失2、甲烷中混有乙烯,欲除去乙烯,得到纯净的甲烷,最好依次通过盛有的试剂瓶。
脂肪烃的物理性质和化学性质相同的物质发生有机反应,反应条件不同,生成的产物也不相同。
以为例,铁的催化下,与液溴发生反应,生成、或;在光照条件下,与溴蒸气发生反应,生成;在有Ni 做催化剂加热的条件下,与溴蒸气反应生成。
强化练习烷烃测试题1、若甲烷与氯气以物质的量之比1∶3混合,在光照下得到的产物:①CH3Cl,②CH2Cl2,③CHCl3,④CCl4,其中正确的是( )A.只有① B.只有③ C.①②③的混合物 D.①②③④的混合物2、下列反应属于取代反应的是( )A.C2H4+3O2――→点燃2CO2+2H2O B.Zn+CuSO4===ZnSO4+CuC.NaCl+AgNO3===AgCl↓+NaNO3 D.CH2Cl2+Cl2――→光照CHCl3+HCl3、所有同系物都具有( )A.相同的相对分子质量B.相同的物理性质C.相似的化学性质D.相同的最简式4、进行一氯取代反应后,只能生成三种沸点不同的有机物的烷烃是( )A.(CH3)2CHCH2CH2CH3 B.(CH3CH2)2CHCHC.(CH3)2CHCH(CH3)2 D.(CH3)3CCH2CH35、下列说法错误的是( )①化学性质相似的有机物是同系物②在分子组成上相差一个或若干个CH2原子团的有机物是同系物③若烃中碳、氢元素的质量分数相同,它们必定是同系物④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似A.①②③④ B.只有②③ C.只有③④ D.只有①②③6、2008年北京奥运会的“祥云”火炬所用燃料的主要成分是丙烷。
下列有关丙烷的叙述不正确的是()A.分子中碳原子不在一条直线上B.光照下能够发生氯代反应C.比丁烷更易液化D.是石油分馏的一种产品7、有两种气态烷烃的混合物,在标准状况下其密度为 1.16 g·L-1 ,则关于该混合物组成的说法正确的是A.一定有甲烷 B.一定有乙烷 C.不可能是甲烷和乙烷的混合物 D.可能是乙烷和丙烷的混合物8、两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。
下列各组混合烃中不符合此条件的是( )A.CH4与C2H4 B.CH4与C3H4 C.C2H4与C3H4 D.C2H2与C3H69、有一种无色的混合气体可能由CH4、NH3、H2、CO、CO2和HCl组成。
为确定其组成,进行了以下实验:①将此混合气体通过浓硫酸,气体总体积基本不变。
②再通过过量的澄清石灰水,未见浑浊,但气体体积减少。
③把剩余气体在供氧的情况下燃烧,燃烧产物不能使无水硫酸铜变色。
原混合气体含有()A.CO和HCl B.CH4和NH3 C.CH4和HCl D.H2和CO210、在标准状况下,11.2 L甲烷和22.4 L氧气混合后点燃,恢复到原状况时,气体的体积共( ) A.11.2 L B.22.4 L C.33.6 L D.44.8 LO(不稳定)→烯烃练习题1.用 N A 表示阿伏加德罗常数的数值,下列说法正确的是( ) A .23gNO 2和N 2O 4的混合气体中含有的氮原子数为0.5N A B .4.2 g 丙烯中所含的共价键数目为0.6N AC .1 L 0.1 mol/L 的Fe 2(SO 4)3溶液中,Fe 3+的数目为0.2 N AD .过氧化氢分解制得标准状况下1.12 L O 2,转移电子数目为 0.2 N A2.设N A 代表阿伏加德罗常数,下列叙述正确的是A .标准状况下,11.2L 的O 2和NO 的混合物含有的分子数约为0.5×6.02×1023B .1mol 的羟基与1 mol 的氢氧根离子所含电子数均为9 N AC .常温常压下42g 乙烯和丁烯混合气体中,极性键数为6N AD .6.4g SO 2与足量氧气反应生成SO 3,转移电子数为0.2N A3.设A N 为阿伏伽德罗常数的值,下列叙述正确的是 ( ) A .标准状态下,33.6L 氟化氢中含有氟原子的数目为A NB .常温常压下,7.0g 乙烯与丙稀的混合物共含有氢原子的数目为A NC .50mL 18.4Lm ol 浓硫酸与足量铜微热反应,生成2SO 分子的数目为0.46A N 。
D .某密闭容器盛有0.1mol 2N 和0.3mol 2H ,在一定条件下充分反应,转移电子的数目为0.6A N4.有关烯烃的下列说法中正确的是( ) A .烯烃分子中所有的原子一定在同一平面上B .烯烃在适宜的条件下只能发生加成反应不能发生取代反应C .分子式是C 4H 8的烃分子一定含有碳碳双键D .烯烃既能使溴水褪色也能使酸性KMnO 4溶液褪色5.β—月桂烯的结构如下图所示,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有( ) 种A .2种 B .3种 C .4种 D .6种6.某烯烃与氢气加成后得到2,2-二甲基丁烷,该烃的名称是( ) A .3,3,3-三甲基-1-丁炔 B .2,2-二甲基-2-丁烯 C .2,2-二甲基-1-丁烯 D .3,3-二甲基-1-丁烯7.始祖鸟烯(Pterodactyladiene),形状宛如一只展翅飞翔的鸟,其键线式如下图,其中R 1、R 2为烷烃基。
则下列有关始祖鸟烯的说法中正确的是A .始祖鸟烯与乙烯互为同系物B .若R l =R 2=—CH 3,则其化学式为C 12H 16C .若R 1=R 2,一定条件下烯烃双键碳原子上的氢也能取代,则始祖鸟烯环上的二氯代物有10种D .始祖鸟烯既能使酸性高锰酸钾褪色也能使溴水褪色,其褪色原理是一样8.某有机化合物A 的相对分子质量(分子量)大于130,小于160。
经分析得知,其中碳和氢的质量分数之和为56.16%,其余为氧。
该化合物分子中最多含碳氧双键的个数为 A .1 B.2 C .3 D.49.1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和6体积氯气发 生取代反应。
由此可以断定原气态烃是(气体体积均在相同条件下测定) A .乙炔 B .丙炔 C .丁炔 D .丁二烯10.某烃结构式用键线式表示为 , 该烃与Br 2加成时(物 质的量之比为1:1),所得产物有A .3种B .4种C .5种D .6种11.下列说法正确的是A .能使溴水褪色,但不能是酸性高锰酸钾溶液褪色B .乙烯能和溴水、酸性高锰酸钾溶液发生加成反应使之褪色C .气态烃CxHy 与适量O 2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则 y=4D .相同质量的烃,完全燃烧,消耗O 2越多,烃中含碳的质量分数越高12.乙烯和丙烯按1∶1(物质的量)聚合时,生成聚合乙丙树脂,该聚合物的结构是A .①B .②C .①④D .①②13.某有机物的结构简式为HO-CH 2CH= CHCH 2-COOH ,该有机物不可能发生的化学反应为( ) A .水解 B.酯化 C .加成 D .氧化14.下列化学用语或模型表示正确的是( ) A .Cl -离子的结构示意图:B .CCl 4分子的球棍模型:C .乙烯的结构简式 CH 2CH 2D .H 2O 2的结构式:H —O —O —H15.主链上有四个碳原子的某种烷烃有两种同分异构体,与它含有相同碳原子数且主链也有四个碳原子的单烯烃的同分异构体有A .2种 B .3种 C .4种 D .5种16.下列实验操作、现象和结论均正确的是 选项 实验操作 现象 结论A 将干燥纯净的氯气通入装有湿润的红色纸条的试剂瓶中红色褪去 氯气有漂白性B往乙醇中加入适量浓硫酸制备乙烯,并将产生的气体直接通入酸性KMnO 4溶液中 酸性KMnO 4溶液紫红色褪去 证明乙烯能被酸性高锰酸钾氧化 C 取少量BaSO 4固体于试管中,加入足量的盐酸 沉淀不溶解 BaSO 4不溶于盐酸,且可以用盐酸和BaCl 2溶液检验SO 42-D 在分液漏斗中加入碘水后再加入CCl 4,充分振荡 分层,且上层溶液呈紫色CCl 4可作为碘的萃取剂17.已知乙烯分子是平面结构,因此1,2二氯乙烯可以形成两种不同的空间异构体。
下列各物质中,能形成类似上述两种空间异构体的是A.1丁烯 B.丙烯 C.2甲基2丁烯 D.2氯2丁烯18.对的描述正确的是A.分子中的所有C原子一定在同一平面上B.分子中的所有原子可能在同一平面上C.除苯环外的其他C原子有可能在一条直线上D.除苯环外的其他C原子不可能在一条直线上1920.下列有关乙烯和乙烷的说法中错误的是A.乙烯的化学性质比乙烷的化学性质活泼B.乙烯是平面分子,乙烷分子中所有原子不可能在同一平面内C.溴的四氯化碳溶液和酸性KMnO4溶液都可以鉴别乙烯和乙烷D.溴的四氯化碳溶液和酸性KMnO4溶液都可以除去乙烷中混有的乙烯炔烃练习题1.不能使酸性KMnO4溶液褪色的是() A.乙烯 B.聚乙烯 C.丙烯 D.乙炔2.既可以鉴别乙烷和乙炔,又可以除去乙烷中含有的乙炔的方法是()A.足量的溴的四氯化碳溶液B.与足量的液溴反应C.点燃 D.在一定条件下与氢气加成3.关于炔烃的下列描述正确的是()A.分子里含有碳碳三键的不饱和链烃叫炔烃B.炔烃分子里的所有碳原子都在同一直线上C.炔烃易发生加成反应,也易发生取代反应D.炔烃不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色4.实验室制取下列气体的方法正确的是A.氨:将消石灰和氯化铵加热,并用向下排空气法收集B.乙炔:将电石和水在启普发生器中反应,并用向上排空气法收集C.乙烯:将乙醇加热至170℃,并用排水集气法收集D.硫化氢:用硫化亚铁与稀盐酸反应,并用向下排空气法收集5.据报道,近来发现了一种新的星际分子氰基辛炔,其结构式为:HC≡C—C≡C-C≡C-C≡C-C≡N。
对该物质判断正确的是()A.不能使溴的四氯化碳溶液褪色 B.能使酸性高锰酸钾溶液褪色C.不能发生加成反应 D.可由乙炔和含氮化合物加聚制得6.CCTV《科技博览》报道,2004年3月中科院首创用CO2合成可降解塑料聚二氧化碳。
下列相关说法合理的是()A.聚二氧化碳塑料是通过加聚反应制得的B.聚二氧化碳塑料与干冰互为同素异形体C.聚二氧化碳塑料与干冰都属于纯净物D.聚二氧化碳塑料的使用会产生白色污染7.氰气[(CN)2]和氰化物都是剧毒性物质,氰分子的结构式为N C-C N,性质与卤素相似,下列叙述错误的是()A.氰分子中四原子共直线,是非极性分子 B.氰分子不能溶于有机溶剂C.氰气能与强碱溶液反应得到氰化物和次氰酸盐D.氰化氢在一定条件下能与烯烃发生加成反应8.用乙炔为原料制取CH2Br—CHBrCl,可行的反应途径是()A.先加Cl2,再加Br2 B.先加Cl2,再加HBrC.HCl,再加HBr D.先加HCl,再加Br29.某烃W与溴的加成产物是2,2,3,3—四溴丁烷,与W互为同系物的是()A.乙炔B.2—丁烯C.1,3—丁二烯D.异戊二烯10.下列各选项能说明分子式为C4H6的某烃是,而不是的事实是()A.燃烧有浓烟B.能使酸性高锰酸钾溶液褪色C.所在原子不在同一平面上D.与足量溴水反应,生成物中只有2个碳原子上有溴原子11.CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属于离子型碳化物。