物理化学第一章-热力学
- 格式:ppt
- 大小:7.99 MB
- 文档页数:126





第一章热力学第一定律★★★热力学的定义和热力学的基本特点:1.定义:热力学是研究物质能量转化规律的科学。
2.特点:(1)热力学定律都是经验定律(2)热力学研究往往只需要知道体系的始末状态,而不需要知道其反应过程。
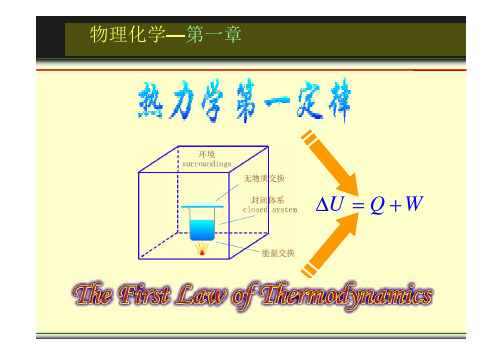
第一节:几个基本概念一:体系与环境这个概念相信大家都没问题,我们把研究对象成为体系,与体系紧密相关的那一部分称为环境。
需要注意的是:体系分为敞开体系,封闭体系和隔离体系。
一般我们在进行热力学研究的时候,针对的都是封闭体系(只有能量交换,没有物质交换)。
二:状态与状态函数状态指的是体系的物理性质和化学性质的一种综合表现,能够表现这些性质的函数(例如温度,压强等)称之为状态函数。
需要注意的是状态函数分为容量性质(广度性质)和强度性质两种。
1.广度性质往往具有加和性,与物质的量成正比。
例如体积,质量等2.强度性质恰巧相反,它与物质的量无关,只取决于体系自身的性质。
例如温度,密度等3.广度性质的比值往往是强度性质,例如 ρ = m / V4.状态函数只与始末状态有关,与变化途径无关。
▲▲▲压力和压强是强度性质!三:热和功1.热和功不是状态函数,他们与体系的变化过程有关。
2.对体系做的功和对体系放的热都为正值,对环境的都为负值。
3.有关膨胀功的计算:(1)向真空中膨胀 W=0(2)等外压膨胀 W =- p 外( V 2-V 1 )(3)可逆膨胀 W (也可写成P2/P1,视条件而定)第二节:热力学第一定律一. 热力学第一定律的数学表达式(4)需要注意的几点是:1. 虽然Q 和W 都不是状态函数,可U 是状态函数。
2. 这个W 中既包含了体积功又包含了非体积功。
例:已知在101.3 kPa 下,18℃时1 mol Zn 溶于稀盐酸时放出151.5 kJ 的热,反应析出1 mol H 2气。
求反应过程的W ,∆U 。
解:W =- p 外( V 2-V 1 ) =- p ( V 2-V 1 )= -∆n (气)RT = -∆n (H 2)RT12lnV nRT V =21U U U Q W =-∆=+=- 1×8.314×291.15J= -2.42 kJQ= -151.5 kJ∆U = Q+W = -151.5 kJ-2.421 kJ= -153.9 kJ二:可逆膨胀和可逆压缩1.功和热与反应途径有关。