2020-2021食管胃结合部肿瘤近端胃切除防反流手术研究现状(完整版)
- 格式:doc
- 大小:32.00 KB
- 文档页数:14

2021年局部进展期胃癌围手术期治疗的现状与展望(全文)摘要在我国,每年新增的胃癌患者中,局部进展期胃癌(LAGC)占大宗。
D2根治性手术及其术后辅助化疗已取得了普遍的共识,该治疗策略明显改善了LAGC患者的预后,但是术后复发率仍然较高(50%~80%),致使远期疗效难以进一步提高。
围手术期治疗,特别是术前新辅助治疗(NAT)能否提高LAGC疗效,已受到越来越多的关注。
NAT主要定义为术前新辅助化疗或放化疗,旨在使肿瘤临床降期,提高根治手术切除率;减灭微小转移灶,并检测自体对化疗药物的敏感性等。
然而,对于LAGC患者能否从NAT中生存获益,仍存有争议并缺乏高度共识。
本文回顾与分析了LAGC患者围手术期治疗的现状,特别列举了诸多高水平临床研究的结果;同时也初步探讨了围手术期化疗联合分子靶向与免疫治疗的成效。
当我们继续实施NAT并期待更多高质量循证医学证据的同时,必须再次强调R0根治性手术才是治愈LAGC 患者最重要的手段。
本世纪初始,胃癌的治疗已从单一手术模式逐渐向以手术为主的综合治疗模式转变。
其中,局部进展期胃癌(locally advanced gastric cancer,LAGC)围手术期治疗的临床意义受到了极大的关注。
既往,在施行D2胃癌根治性手术后予以辅助性化疗已获得普遍共识。
多项大型随机对照临床研究业已证实,术后辅助化疗有助于改善患者无复发生存率(recurrence-free survival,RFS)与总体生存率(overall survival,OS)[1,2,3,4]。
近20年来,对于LAGC患者开展术前新辅助治疗(neoadjuvant therapy,NAT)已愈来愈受到临床关注,但尚缺乏普遍的共识。
NAT临床获益之处可能包括:(1)使原发癌灶或转移淋巴结缩减,达到临床降期;(2)减灭隐匿转移灶,降低术后肿瘤复发率;(3)术前患者体力及其对治疗不良反应的耐受性较好,有利于完成治疗计划;(4)能客观地反映治疗方案对肿瘤的敏感性,为后续治疗提供自体药敏参考。

食管癌治疗临床研究食管癌是一种常见的恶性肿瘤,其发病率和死亡率在世界范围内居高不下。
由于食管癌并无明显的早期症状,一旦发现时常已经进入晚期,导致治疗难度和风险增加。
因此,针对食管癌的治疗临床研究显得尤为重要。
一、食管癌的治疗现状目前,食管癌的主要治疗手段包括手术切除、化疗和放疗等。
手术切除是一种常规的治疗方法,但由于食管癌常发生在较深的位置,手术切除常常要求切除大部分食管,严重影响患者的生活质量。
化疗和放疗则常常用于术前或术后的辅助治疗,但其副作用较大,耐受性较差,患者往往不能耐受全疗程的化疗或放疗。
因此,寻找更加有效、安全的食管癌治疗方法是当前临床研究的重点。
二、分子靶向治疗的研究进展分子靶向治疗是近年来食管癌治疗领域的研究热点。
研究人员发现,食管癌的发生和发展常伴随着一系列信号通路的异常活化,通过干扰这些异常活化的信号通路,可以达到治疗食管癌的目的。
目前,已有多个分子靶向药物进入临床试验阶段,如EGFR抑制剂、VEGF抑制剂等。
这些药物的研究和应用为食管癌的治疗提供了新的思路和希望。
三、免疫治疗的前景展望近年来,免疫治疗作为一种新兴的抗癌手段,受到了广泛关注。
免疫治疗通过激活患者自身的免疫系统来攻击癌细胞,具有独特的优势。
目前,免疫检查点抑制剂已经成功应用于多种恶性肿瘤的治疗,并取得了显著的疗效。
对于食管癌的治疗而言,免疫治疗也被认为是一种有前景的治疗手段。
研究人员正在积极探索免疫治疗在食管癌中的应用,并取得了一些初步的突破。
四、个体化治疗的重要性食管癌在不同患者之间存在着明显的异质性,传统的统一治疗方法已经无法满足不同患者的需求。
因此,个体化治疗成为了当前食管癌治疗的发展方向之一。
通过对患者的基因组和转录组等进行测序分析,可以为每个患者量身定制合适的治疗方案,提高治疗的效果和患者的生存率。
个体化治疗的开展需要临床和基础科研的深度合作,以及高通量测序技术等关键技术的支持。
五、多学科综合治疗的意义食管癌的治疗需要多学科的综合参与,以确保治疗的顺利进行和疗效的最大化。

食管胃结合部癌手术治疗的临床效果观察目的观察手术治疗食管胃结合部癌的临床疗效及预后。
方法回顾性分析本院收治的42例食管胃结合部癌患者资料,施行全胃+贲门切除17例,近端胃大部切除+远端食管切除21例,全胃切除+远端食管切除4例。
结果本组40例患者行手术全切除肿瘤,切除率为95.2%,无围手术期死亡病例;术后肿瘤复发者5例,食管下端癌患者与贲门癌患者术后复发率与一年生存率比较,差异无统计学意义(P>0.05),三年生存率与五年生存率比较,贲门癌患者明显高于食管下端癌患者,结果差异有统计学意义(P<0.05)。
结论食管胃结合部癌应尽可能扩大淋巴结清扫范围,可有效保证手术根治度,提高预后效果。
标签:食管胃结合部癌;贲门癌;远端食管癌临床中食管胃结合部癌主要以手术治疗为主,包括远端食管加全胃切除术、近端胃大部切除术。
我院自2012年6月~2013年12月,手术治疗食管胃结合部癌病例42例,取得较好疗效,现报告如下。
1 资料与方法1.1 一般资料选择本院2012年6月~2013年12月收治的食管胃结合部癌病例42例,其中男29例,女13例,年龄55~76岁,病程5~14个月。
临床症状:反酸、恶心21例,剑突下疼痛21例,伴进行性吞咽困难17例。
所有患者均行经胃镜检查+病理检查,结果显示:腺癌11例,鳞癌27 例,癌肉瘤 4 例,且符合Siewert分型,食管下端癌病例22例,贲门癌病例20例,所有患者均未发生远处转移,无明显手术禁忌证。
1.2 手术方法均给予气管插管全身麻醉,全胃+贲门切除17例,近端胃大部切除+远端食管切除21例,全胃切除+远端食管切除4例;常规切除病变+淋巴结清扫。
所有患者进行5年随访,观察其中位生存率及5年生存率。
2 结果2.1 手术效果本组2 例患者探查发现广泛粟粒状转移无法全部切除,只能部分切除肿瘤;其余40例患者手术切除肿瘤,切除率为95.2%,术后2例发生返流性食管炎,对症保守治疗后好转,1 例吻合口轻度狭窄,未发生吻合口瘘及其他并发症,无围手术期死亡病例。

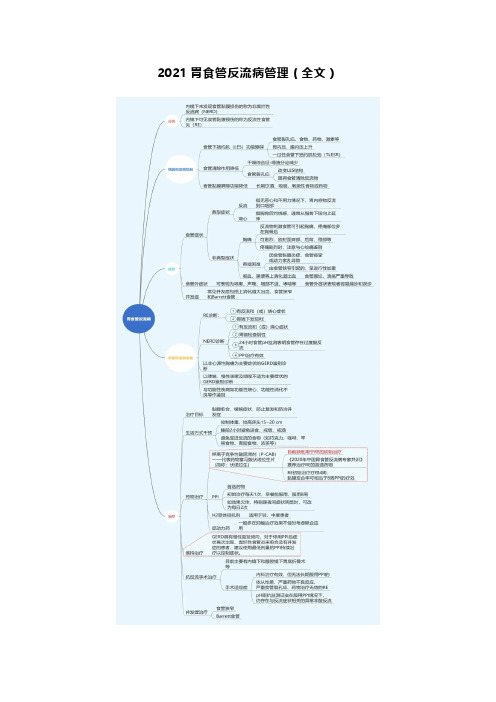
2021胃食管反流病管理(全文)胃食管反流病(GERD)是一种由多种因素导致的消化道动力障碍性疾病,是胃内容物反流入食管,引起的一系列食管症状和食管外并发症,在各个年龄阶段均有可能发生。
2014年欧洲内镜外科协会(EAES)发布了GERD指南[1],将GERD定义为一种慢性疾病,需要和高血压、糖尿病一样进行长期管理。
2020年发表于JAMA杂志(IF 45.54)的一篇综述文章指出[2],GERD可影响患者与健康相关的生活质量,持续/未治疗的GERD可与食管炎、食管狭窄、Barrett食管和食管腺癌的风险增加相关。
GERD应被视为一个严重的问题,而不应与其他较轻的疾病相混淆,如胃炎、常见消化不良或反流症状等。
鉴于GERD 日益引起临床重视,同时在认识、治疗GERD中我们亦存在太多疑惑。
因此,为全面而直观的学习GERD的临床知识,本文整理制作思维导图,把握最新疾病诊疗知识点的结构和分布情况,使临床学习事半功倍。
BMJ综述划重点!反流性食管炎需要长期维持治疗约10%的GERD患者将由非糜烂性反流病(NERD)进展为反流性食管炎(RE),因此RE被认为是一种更严重的反流病的表现,约占GERD 的30%[5]。
2020年BMJ(IF 30.223)针对GERD发表了一篇综述,文章指出抑酸剂是治疗GERD的主要药物,包括H2受体拮抗剂(H2RA)、质子泵抑制剂(PPI)和钾离子竞争性酸阻断剂(P-CAB,其代表药物为富马酸伏诺拉生片,简称伏诺拉生)。
虽然曾经H2RAs的出现,彻底改变了消化性溃疡的治疗,但实际上它们对于RE的疗效十分有限。
与H2RAs相比,PPIs和P-CAB的抑酸作用更强,为我国共识推荐治疗RE的首选药物。
24h胃内pH>4持续时间的比例(HTR)是RE 黏膜愈合率良好的预测因素。
Katz PO等[6]发表的一项研究显示,艾司奥美拉唑(开始用药第5天)24h胃内pH>4 HTR仅为50%~70%。

食管癌围手术期免疫治疗研究进展完整版食管癌是常见的恶性肿瘤之一,2022年全世界食管癌新发病例数约51万,死亡病例数达44万,占所有恶性肿瘤死亡病例的4.6%[1]。
我国是食管癌高发国家,2022年食管癌新发病例数约22万,死亡病例数占全部恶性肿瘤死亡病例的7.3%[2]。
食管癌按病理学类型主要分为食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)和食管腺癌,我国以ESCC为主[3]。
食管癌的传统治疗方法包括化疗、放疗和手术切除,但多数患者诊断时已处于进展期,失去手术机会,预后不佳[4]。
此外,食管癌早期容易发生淋巴结转移,仅手术治疗食管癌的预后仍较差[5]。
因此,食管癌的治疗模式逐渐向为以手术为主的综合治疗转变。
目前,可切除食管癌的标准全身治疗方案包括新辅助放化疗、围手术期化疗和新辅助化疗等。
其中,手术联合新辅助放化疗是局部晚期ESCC患者的首选治疗方法,但许多患者仍会出现复发和转移,甚至有增加围手术期并发症发生死亡的风险[6]。
近年来,免疫疗法已成为继手术、放疗和化疗后的一种有前景的抗肿瘤治疗策略。
免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)等免疫治疗药物的出现,开创了肿瘤治疗新时代,为肿瘤患者提供了新选择[7‑8]。
PD‑1及PD‑L1是介导肿瘤诱导免疫抑制的主要药物,在多种恶性肿瘤(包括食管癌)治疗中取得巨大突破[9‑13]。
笔者综述食管癌围手术期免疫治疗研究现状,为其进一步研究及临床应用提供重要参考。
一、食管癌免疫治疗机制正常情况下,机体具有完善的免疫监视和免疫调节功能,可识别肿瘤表面特异性抗原,激活特异性免疫应答而清除肿瘤细胞。
然而,肿瘤细胞通过多种途径对机体免疫应答进行负向调节,最终逃避免疫系统的攻击。
肿瘤免疫治疗是指通过干预机体免疫系统,重新恢复并提高机体抗肿瘤的免疫反应,达到清除肿瘤细胞的目的,特异性较强且不良反应小[14]。
2020-2021胃食管反流病诊断与治疗胃食管反流病(GERD)是胃内容物反流入食管、口腔(包括喉部)或肺引起的症状或并发症,其典型症状是烧心和反流,不典型症状有胸痛、上腹痛、腹胀、上腹部烧灼感、嗳气等,还伴随食管外症状如咳嗽、咽喉症状、鼻窦炎、复发性中耳炎、哮喘和牙蚀症等,合并食管裂孔疝者部分合并贫血。
GERD可分为糜烂性食管炎(EE)或反流性食管炎(RE)、非糜烂性食管炎(NERD)和Barrett食管(BE)。
治疗GERD常用药物有抑酸剂、抗酸剂、黏膜保护剂、促动力药物、胆汁结合剂、神经调节剂等。
缓解烧心、反流、上腹部灼热感、上腹痛、促进糜烂性食管炎愈合的药物研究显示,GERD治疗中最优胃酸抑制需在24h中使胃内pH>4的时间达到16h,治疗药物可选用质子泵抑制剂(PPI)、钾离子竞争性酸阻滞剂(P-CAB)、H2受体拮抗剂(H2RA)、抗酸剂、黏膜保护剂。
PPI缓解GERD症状、愈合糜烂性食管炎的疗效优于H2受体拮抗剂(H2RA),是治疗GERD诱导缓解和维持治疗的首选药物。
新型抑酸剂钾离子竞争性酸阻滞剂(P-CAB)如伏诺拉生,通过竞争性阻断H+-K+-ATP酶中钾离子的活性而抑制胃酸分泌,其可促进食管炎黏膜愈合及缓解反流症状,且不劣于PPI。
《2020年中国GERD专家共识》中指出,PPI或P-CAB是治疗GERD的首选药物,单剂量治疗无效可改用双倍剂量,一种抑酸剂无效可尝试换用另一种药物。
疗程为4-8周。
PPI双倍剂量治疗可使24h内胃内pH值>4的时间持续15.6-20.4h;P-CAB双倍剂量时控制胃内pH值>4的时间明显优于单倍剂量。
此外,维持治疗包括按需治疗和长期治疗。
抑酸剂初始治疗有效的非糜烂性反流病(NERD)和轻度食管炎(洛杉矶分级为A和B级)者可采用按需治疗,PPI、P-CAB为首选药物,可很好地控制症状,尤其是NERD者;PPI或P-CAB停药后症状复发、重度食管炎(洛杉矶分级为C和D级)者通常需长期维持治疗。
2020NCCN食管和胃食管结合部腺癌更新要点(全文)01、2020 V4更新自V302、2020 V3更新自V2ESOPH-F——系统治疗原则:不可切除局部晚期、复发或转移性疾病二线及后续治疗新增:若既往未接受过免疫检查点抑制剂,纳武利尤单抗可作为食管鳞癌二线治疗或后续治疗的优选方案(1类)。
使用剂量为:纳武利尤单抗240mg,静脉注射(第一天),每14天为一周期;纳武利尤单480mg,静脉注射(第一天),每28天为一周期,该推荐是基于III期ATTRACTION-3研究。
应根据既往治疗和PS评分选择二线及后续治疗方案。
其他优选方案包括雷莫芦单抗+紫杉醇用于腺癌(食管胃结合部腺癌[EGJ],1类;食管腺癌,2A类)、多西他赛(1类)、紫杉醇(1类)、伊立替康(1类)、三氟胸苷+ tipiracil(TAS-102)用于EGJ(1类)(三线或以上治疗)、氟尿嘧啶+伊立替康(2A类)、帕博利珠单抗。
其他推荐方案包括:雷莫芦单抗用于腺癌(EGJ,1类;食管腺癌,2A类)、伊立替康+顺铂(2A类)、恩曲替尼或拉罗替尼用于NTRK融合突变阳性患者(2A类)、多西他赛+伊立替康(2B类)。
在特定情况下可选择:氟尿嘧啶+伊立替康+雷莫芦单抗用于腺癌(2B类)。
不可切除局部晚期、复发或转移性疾病的一线治疗HER2过表达转移性腺癌应加入曲妥珠单抗:曲妥珠单抗+氟尿嘧啶+铂类(联合顺铂,1类;曲妥珠单抗+其他铂类,2A类);曲妥珠单抗不推荐与蒽环类药物联用。
一线治疗方案:因毒性较低,优先推荐两药细胞毒化疗;三药细胞毒化疗方案用于PS评分较好且易于经常评估毒性的患者;由于毒性较低,奥沙利铂通常比顺铂优先推荐。
优选推荐方案:氟嘧啶(氟尿嘧啶或卡培他滨)+奥沙利铂(2A类)、氟嘧啶(氟尿嘧啶或卡培他滨)+顺铂(2A类)。
其他推荐方案:氟尿嘧啶+伊立替康(2A类);紫杉醇+顺铂或卡铂(2A 类); 多西他赛+顺铂(2A类); 氟尿嘧啶或卡培他滨(2A类); 多西他赛; 紫杉醇; 改良DCF方案:多西他赛+顺铂+氟尿嘧啶(2A类)、多西他赛+奥沙利铂+氟尿嘧啶(2A类)、多西他赛+卡铂+氟尿嘧啶(2B 类); ECF方案(表柔比星+顺铂+氟尿嘧啶)(2B类);改良ECF方案(2B类):表柔比星+奥沙利铂+氟尿嘧啶、表柔比星+顺铂+卡培他滨、表柔比星+奥沙利铂+卡培他滨。
食管切除术围手术期麻醉管理现状研究进展(全文)食管癌的发病率居全球恶性肿瘤的第八位,其死亡率居第六位。
据统计,近25年来,食管腺癌的发病率升高了4倍,是美国增长最快的癌症。
食管腺癌发病的危险因素众多,包括胃食管反流病、Barrett食管、肥胖、吸烟和低水果饮食等,而酒精和吸烟是鳞癌的危险因素。
食管切除术是常用的食管癌治疗方法,也是手术风险最高的胸外科手术之一,食管切除术患者的手术死亡风险达到3.0%。
对近10年食管切除术患者的评估表明,低容量中心(年食管切除术<10例)食管切除术患者的术后死亡率为9.2%~20.3%,而高容量中心(年食管切除术>10例)食管切除术患者的术后死亡率为2.5%~8.4%。
许多指标可预测食管切除术近期和远期预后,其中年龄>65岁、体质指数>35kg/m2、既往吸烟史、鳞状细胞癌和三孔法手术入路等均是患者不良预后的明确性影响因素,而戒烟、充血性心力衰竭和受损功能状态评分>1等为可变因素,其指标可通过临床手段调节,对患者不良预后的影响可改变。
食管切除术患者不良预后与其围手术期并发症相关,食管切除术的术后并发症发生率高达60%,其中呼吸系统并发症占25%,心血管并发症约占12%,吻合口瘘约占16%,约50%食管切除术患者的术后死亡由肺部并发症引起。
多项研究表明,食管切除术患者的预后与围手术期麻醉管理质量密切相关。
遵循以患者为中心,以循证医学为基础的外科临床麻醉路径,可降低食管切除术预后不良高风险人群的术后并发症的发生率和死亡率。
既往围手术期的关注点主要集中于食管切除术患者术后的死亡率、术后并发症发生率及住院时长,而忽视了失血量、补液量、拔除气管导管时间、疼痛管理、术后早期活动、营养支持等对患者预后的影响。
现就食管切除术患者围手术期管理的支持性证据(通气管理、液体管理、镇痛方法、快速康复理念和微创手术技术)对食管切除术患者围手术期麻醉管理现状的研究进展予以综述。
1.机械通气机械通气是胸外科手术患者术中必要的辅助治疗。
2020-2021食管胃结合部肿瘤近端胃切除防反流手术研究现状(完整版)摘要近年来,全球范围内胃癌的整体发病率呈下降趋势,而食管胃结合部肿瘤的发病率却在逐年上升。
随着上消化道肿瘤诊断技术的进步和早癌普查的逐步推广,早期食管胃结合部肿瘤的检出率逐年增加。
因此,近年来保留胃功能手术的临床应用逐渐增多。
近端胃切除术作为食管胃结合部肿瘤外科治疗策略的重要组成部分,随着肿瘤学安全性的证实,其在食管胃结合部肿瘤中的临床应用价值正在日益得到重视。
相较于全胃切除,近端胃切除术后患者有更好的营养状态和生活质量。
然而,传统的近端胃切除术后反流性食管炎较高的发生率严重影响了患者术后生活质量,同时也阻碍了近端胃切除术在食管胃结合部肿瘤中的应用。
如何通过优化消化道重建方式来降低近端胃切除术后反流性食管炎的发生,一直是临床工作中的难题。
本文就目前食管胃结合部肿瘤近端胃切除防反流术式进行了综述。
近年来,世界范围内胃癌整体发病率呈下降趋势,食管胃结合部(esophagastric junction,EGJ)肿瘤的发病率却在逐年增加[1,2,3]。
全球的胃癌发病率中,食管胃结合部腺癌(adenocarcinoma of esophagogastric junction,AEG)的发病比例超过50%,远高于中远端胃癌[4]。
同时,AEG相较于其他部位胃癌,更容易向胃壁深层浸润,预后较其他位置胃癌差[5]。
因此在AEG的外科治疗中,如何在保证安全切缘及淋巴结清扫范围的前提下,根据残胃大小和食管离断高度选择合适的防反流术式显得尤为重要。
近端胃切除术作为EGJ癌的缩小术式,其根治性问题一直是临床关注的热点,也是阻碍其应用的重要原因。
既往全胃切除术被认为是EGJ癌外科治疗的标准术式,近年来一系列临床研究证实了近端胃切除术的肿瘤学安全性[6,7,8,9,10]。
传统的近端胃切除术后高发生率的反流性食管炎,是临床工作中需要解决的一个难题。
文献报道,近端胃切除术后反流性食管炎的发生率为21.8%~71.6%[11,12]。
近年来,由于各种防反流术式的应用,近端胃切除术后反流性食管炎的发生率已显著降低。
目前临床上应用于近端胃切除的防反流消化道重建方式主要有食管胃吻合、间置空肠吻合(单通道、双通道、空肠储袋)等。
近端胃切除术作为胃肠间质瘤(gastrointestinal stromal tumor, GIST)的重要治疗方式,《2018版胃肠间质瘤规范外科治疗中国专家共识》推荐,对于肿瘤较大、无法行局部或胃楔形切除且预计残胃容量≥50%的EGJ-GIST,可考虑行近端胃切除;同时,共识推荐技术成熟的单位运用防反流术式(食管胃吻合肌瓣成形术即Kamikawa吻合术、食管胃Side-overlap吻合术即SOFY吻合术)等,降低反流性食管炎的发生[13]。
近端胃切除由于保留了胃的部分功能,患者术后营养状况和生活质量要优于全胃切除。
同时,残胃的存在能减少由于维生素B12吸收障碍导致的无胃性贫血的发生,幽门的存在能减少术后胆汁反流和倾倒综合征的发生。
有研究显示,近端胃切除术后患者在维持体质量稳定、控制骨骼肌含量减少及术后生活质量方面,均要优于全胃切除[14,15,16]。
本文就目前EGJ 肿瘤近端胃切除防反流术式综述,旨在为临床工作中选择合理的防反流术式提供参考。
一、近端胃切除术后反流性食管炎发生的原因传统的食管胃后壁吻合作为近端胃切除术经典的消化道重建方式,具有操作简便、耗时短、术后吻合口漏发生率低、符合生理状态等特点。
但是,食管胃后壁吻合术后反流性食管炎及吻合口狭窄的发生率较高[17]。
近端胃切除术后患者发生反流性食管炎的原因较多,主要有以下几点[18]:(1)贲门、食管下括约肌、His角和胃底等生理性防反流结构的丧失,使得胃肠内容物更易反流入食管;(2)胃蠕动起搏点位于胃中上1/3,近端胃切除造成胃起搏点丧失,从而造成患者术后胃蠕动功能紊乱;(3)迷走神经的切断、患者术后应激引发的自主神经功能紊乱及交感神经兴奋等原因造成胃的正常蠕动功能受到抑制;(4)迷走神经干的离断导致幽门环呈痉挛状态,影响术后残胃的排空功能,胃内容物易反流入食管。
二、近端胃切除术后消化道重建方式近端胃切除术后消化道重建方式有近百余种,第5版《日本胃癌治疗指南》推荐,近端胃切除术后使用食管胃吻合、间置空肠吻合及双通道吻合作为消化道重建方式[19]。
(一)食管胃吻合术1.食管胃前壁吻合加胃折叠术:食管胃前壁吻合术通过再造"胃底"及重建His角等措施,实现防反流的目的。
患者术后胃内容物会储存在"胃底",同时由于食管位于胃前壁,患者平卧位时,消化液因重力作用不易流入食管。
Zhang等[20]研究对比了近端胃切除术后的3种吻合方式即食管胃前壁吻合、食管胃后壁吻合、食管胃端端吻合患者术后的生活质量,结果表明,食管胃前壁吻合组患者术后生活质量优于其他两组。
有研究指出,相较于食管胃后壁吻合,食管胃前壁吻合患者术后恢复进食时间早、进食量大、烧心感轻、体质量恢复快[21]。
但是食管胃前壁吻合术的防反流效果是有限的,患者主要以夜间反流为主[22]。
食管胃前壁吻合加胃折叠在食管胃前壁吻合的基础上,通过再造"贲门"以增强抗反流效果。
Nakamura等[23]研究显示,当残胃包绕食管周径<180°时,近端胃切除行食管残胃前壁吻合术后反流性食管炎发生率为40.7%(11>180°时,反流性食管炎的发生率为3.6%(1/28),吻合口狭窄发生率为21.4%(6/28),建议当残胃足够大时,使残胃包绕食管周径>180°。
Ojima等[24]报道了15例机器人辅助下的近端胃切除加180°胃折叠术,所有患者术后3个月胃镜检查均未发现反流性食管炎,也无吻合口狭窄。
Sakuramoto等[25]研究表明,腹腔镜下近端胃切除行食管胃前壁吻合加胃折叠术后反流性食管炎的发生率为23.1%(6/26)。
Kondoh等[26]报道显示,近端胃切除附加胃折叠术后反流症状的发生率为40%,但反流症状均在2年内消失,吻合口狭窄发生率为40%。
2012年,Okabe等[27]报道了一种改良的食管胃前壁吻合加胃折叠术,在近端残胃前壁横行切开长度约3 cm的切口,应用直线吻合器将下段食管左侧后壁与残胃前壁钉合,将食管前后壁与残胃前壁完成连续缝合,最后将食管左右侧固定于残胃前壁完成180°的胃折叠。
这种改良的吻合方式可以降低由于使用圆形吻合器吻合导致的吻合口狭窄的发生率,同时,直线吻合器相较于圆形吻合器更易于在腔镜下操作。
该研究显示,所有患者均未出现反流症状,有1例患者术后发生了吻合口狭窄,通过内镜下扩张吻合口得以治愈;1例患者被诊断为洛杉矶分型B级反流性食管炎,但患者无任何反流症状。
近端胃切除食管残胃前壁吻合加胃折叠术有确切的防反流效果,但是需要有足够大的残胃包绕食管且术后吻合口狭窄发生率较高。
建议根据残胃大小选择性应用该术式,在包绕食管时要松紧适宜,常规行术中胃镜检查吻合口情况。
2.双肌瓣吻合术(Kamikawa吻合术):浆肌层包埋手术自20世纪50年代就有报道,与传统的食管胃前壁吻合有所不同。
2001年,日本学者Kamikawa等[28]报道的双肌瓣吻合术将残胃前壁浆肌层H形切开制作两片大小为2.5 cm×3.5 cm的浆肌瓣,随后打开肌瓣下方的黏膜下层和黏膜层,将约5 cm的食管下段间断缝合于残胃前壁。
食管后壁全层与胃黏膜层和黏膜下层缝合,食管前壁全层与胃全层缝合,最后,利用浆肌瓣包埋吻合口后行Y形间断缝合。
双肌瓣吻合术利用胃前壁浆肌层包埋下段食管,浆肌瓣起到了类似"括约肌"的作用,当胃内压力升高时肌瓣紧张,从而关闭食管。
同时,胃内压力可以通过胃前壁传导至与之贴合紧密的食管后壁,从而关闭食管以达到防反流目的。
2016年,Muraoka等[29]首次报道了腹腔镜下的Kamikawa吻合术,研究显示,在1年的随访期间,所有患者均未出现吻合口漏、吻合口出血及反流性食管炎等并发症,但有9%的患者出现了吻合口狭窄。
Hayami等[30]研究表明,腹腔镜下近端胃切除加Kamikawa吻合(laparoscopic proximal gastrectomy with double-flap technique,LPG-DFT)组术后洛杉矶分型B级及以上反流性食管炎发生率低于腹腔镜下全胃切除(laparoscopic total gastrectomy,LTG)组(2.3%比14.9%,P=0.06);术后中位住院时间LPG-DFT组显著短于LTG组(10 d比13 d,P=0.002);LPG-DFT组术后体质量和血液学营养相关指标要优于LTG组,但是LPG-DFT组手术时间要显著长于LTG组(386.5 min比316.3 min,P<0.001)。
Hosoda等[31]采用回顾性队列研究比较了腹腔镜下两种消化道重建方式(Kamikawa吻合与OrVil吻合加胃折叠)对于预防近端胃切除术后反流性食管炎的疗效;结果显示,Kamikawa组典型的反流和烧心症状的发生率显著低于OrVil组(18%比51%,P=0.001);多因素分析结果显示,Kamikawa吻合为胃食管反流相关症状改善的独立影响因素(OR=0.20,95% CI:0.07~0.55,P<0.001);Kamikawa组术后发生吻合口狭窄需要内镜球囊扩张的比例要低于OrVil组(18%比27%,P=0.32),但是前者的中位手术时间要显著长于后者(353 min比280 min,P<0.001)。
Kuroda等[32]回顾性分析了来自多个中心的464例患者术后1年的资料,结果显示,双肌瓣吻合术后洛杉矶分级A~D级反流性食管炎的发生率分别为4.5%、4.3%、1.3%和0.4%;吻合口相关并发症发生率为7.2%,其中吻合口漏发生率为1.5%,吻合口狭窄发生率为5.5%,吻合口出血发生率为0.6%。
《2018版胃肠间质瘤规范外科治疗中国专家共识》推荐,较大的EGJ-GIST行近端胃切除术可采取Kamikawa 吻合术预防反流[13]。
腹腔镜下Kamikawa吻合术操作难度大,对于手术团队技术要求高且手术时间长,建议在技术成熟的单位开展。
本中心现已完成数例该手术,近期随访结果显示,该术式近期防反流效果明确(尚未发表)。
目前国内外常规开展该术式的单位较少,缺乏高级别循证医学证据来证实其安全性,该术式的远期疗效也有待后续临床研究证实。
3.Side-overlap吻合术:Side-overlap吻合术于2016年由日本学者Yamashita等[33]率先报道,又名SOFY吻合术。