第六节_α_β-_不饱和醛、酮
- 格式:ppt
- 大小:1.67 MB
- 文档页数:60



α,β-不饱和醛、酮中羰基的选择性还原
王彩兰;王玉炉;王晓阳;李建平;王红
【期刊名称】《合成化学》
【年(卷),期】1998(006)004
【摘要】无
【总页数】7页(P358-364)
【作者】王彩兰;王玉炉;王晓阳;李建平;王红
【作者单位】无
【正文语种】中文
【相关文献】
1.2-(1,3-亚丙二硫)亚甲基-3-羰基丁酸作为硫醇替代试剂在缩硫醛/酮化反应中的应用 [J], 欧阳艳;于海丰;董德文;刘军;王芒;刘群
2.在羰基亲核加成反应活性中醛、酮的结构所起的作用 [J], 陈泽宇
3.NaBH4—BiCl3体系对甾体化合物中α,β—不饱和酮结构的选择性还原 [J], 史建栋;马成禹
4.关于有机化学中醛酮选择性还原教学的建议 [J], 王春艳;王建世;孙忠栋
5.α-羰基烯酮环二硫代缩醛化学(ⅩⅢ)──β,β-1,3-亚丙二硫基-α,β-不饱和酮在镁-甲醇中的还原反应 [J], 刘群;朱再明;胡玉兰;张殊佳
因版权原因,仅展示原文概要,查看原文内容请购买。


第二章紫外-可见光谱法一、填空1.紫外-可见光谱统称________。
这类光谱是由分子的________而产生的。
当以一定波长范围的连续光照射样品时,一定波长的光子被吸收,使透射光的强度发生变化,于是产生了以________组成的吸收光谱,以波长为横坐标,________或________为纵坐标即可得到被测化合物的吸收光谱。
2.紫外吸收光谱最大吸收值所对应的波长为________;曲线的谷所对应的波长称为________;峰旁边一个小的曲折称为________;在吸收波长最短一端,吸收相当大但不成峰形的部分为________。
整个吸收光的________、________和________是鉴定化合物的标志。
3.紫外-可见光谱研究的波长范围是________。
紫外-可见光分为三个区域:________的波长范围是10—190nm,________的波长范围是190—400nm,________的波长范围是400—800nm。
一般紫外光谱仪包括紫外光和可见光两部分。
在紫外光谱中,峰最高处的波长记为________。
4.在紫外光谱中,峰的强度遵守________,即A=lg I0/I=εcl。
理论上,该定律只适用于________,而实际上应用的入射光往往有一定的波长宽度,因此要求入射光的波长范围________。
该定律表明,在一定测试条件下,________与溶液________成正比。
5.A=εcl,符号c代表________,单位________,l代表________,单位是________,ε为________。
当c等于________,l等于________,在一定波长下测得的吸光度从数值上就等于________。
6.分子在电子基态和激发态都存在不同的振动能级,通常基态分子多处于________振动能级。
电子跃迁一定伴随能量较小的振动能级和转动能级的跃迁。
一般情况下,激发态键的强度比基态________,所以激发态的平衡核间距比基态的平衡核间距________。

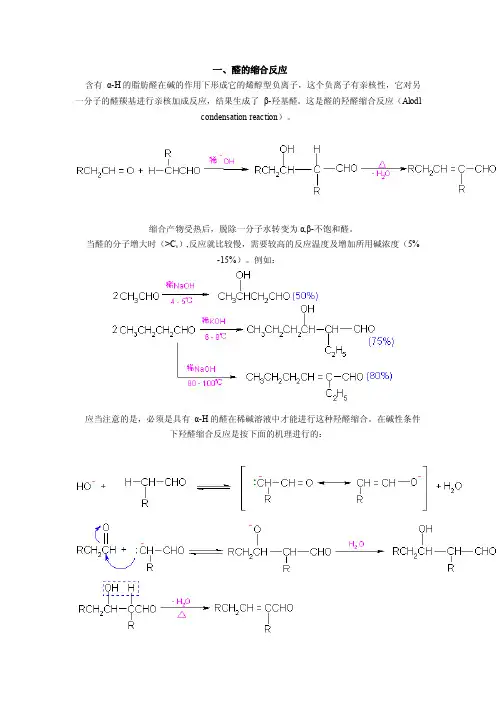
一、醛的缩合反应含有α-H的脂肪醛在碱的作用下形成它的烯醇型负离子,这个负离子有亲核性,它对另一分子的醛羰基进行亲核加成反应,结果生成了β-羟基醛。
这是醛的羟醛缩合反应(Alodlcondensation reaction)。
缩合产物受热后,脱除一分子水转变为α,β-不饱和醛。
当醛的分子增大时(>C6),反应就比较慢,需要较高的反应温度及增加所用碱浓度(5%-15%)。
例如:应当注意的是,必须是具有α-H的醛在稀碱溶液中才能进行这种羟醛缩合。
在碱性条件下羟醛缩合反应是按下面的机理进行的:如果反应的中间产物β-羟基醛中不存在α-H,则不发生进一步的脱水,就得不到α,β-不饱和醛。
如:对Perkin反应的机理,一般认为先是碱性催化剂(CH3CO2-或叔胺)夺去酸酐的α-H,生成一个酸酐负离子,后者和芳醛发生亲核加成,生成中间物β-羟基酸酐,然后再经脱水和水解生成α、β -不饱和酸:丙酸酐也可用于Perkin反应,个别的脂肪醛也会进行这种缩合反应。
五、曼尼希反应甲醛、氨(或伯、仲胺)的盐酸盐与甲基酮发生缩合生成β-酮胺(满尼赫碱Mannich Baes)盐酸盐;这是一种α-H的氨甲基化反应,称为Mannich反应。
Mannich反应一般是在水、乙醇等溶剂中于室温条件下进行的。
反应完成后,用碱中和可得到游离的-酮胺,它是有机合成的重要中间体。
例如它与KCN或NaCN水溶液加热可生成氰基化合物,后者经水解可制得-酮酸;而-酮胺的盐酸盐在受热时则发生分解生成α、β-不饱和酮。
例如:Mannich反应一般在酸性溶液中进行。
除醛、酮之外,其它的含有活泼α-H的化合物也可发生此类反应。
如酯、腈等。
六、关键词羟醛缩合、交叉缩合、α,β-不饱和醛、α,β-不饱和酮、柏琴反应、曼尼希反应、克莱森-施应特反应。


合成α,β-不饱和缩酮(醛)的研究
沈巍巍;阳年发;杨利文;王攀登;李继超
【期刊名称】《化学试剂》
【年(卷),期】2007(29)5
【摘要】以对甲苯磺酸为催化剂,通过苄叉丙酮与-1,2-丙二醇反应合成了苄叉丙酮-1,2-丙二醇缩酮。
较系统的研究了反应溶剂、酮醇物质的量比、催化剂用量等诸因素对产品收率的影响,在n(酮)∶n(醇)=1∶3,催化剂用量为6.5 g/mol(酮),甲苯为带水剂的条件下反应一段时间,再额外加入催化量对甲苯磺酸与少量醇,继续反应,产品收率达到98%。
此条件对于其他的α,β-不饱和酮(醛)缩合反应亦适宜。
【总页数】3页(P305-306)
【关键词】α,β-不饱和酮(醛);缩醛;缩酮;对甲苯磺酸
【作者】沈巍巍;阳年发;杨利文;王攀登;李继超
【作者单位】湘潭大学化学学院
【正文语种】中文
【中图分类】O623.54
【相关文献】
1.FeCl3-漆酚树脂催化合成酯、缩醛和缩酮的研究 [J], 但悠梦;李佳凤;米远祝;段正超
2.生物质基甘油缩醛和缩酮的合成研究进展 [J], 肖泽; 常春; 白净; 陈俊英; 李攀; 韩秀丽
3.以四氢呋喃为醛基砌块合成(E)-α-羟乙基-α,β-不饱和醛 [J], 濮伟雯;史永森;刘建峰;柯德宏;吴孝兰;许胜
4.用于合成不饱和醛和/或不饱和羧酸的催化剂 [J],
5.不饱和醛和不饱和羧酸合成用催化剂、其制备方法和使用该催化剂的不饱和醛和不饱和羧酸的合成方法 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
第十一章醛和酮课时:8课时教学目的要求:掌握醛酮与亲核试剂的加成反应及其历程,醛酮的氧化-还原反应,各类醛酮的鉴别,醛酮制法,α,β-不饱和醛酮的性质。
含羰基。
第一节醛、酮的分类,同分异构和命名一、分类烃基的类别:脂肪族醛、酮;芳香族醛、酮。
羰基的数目:一元醛、酮;二元醛、酮。
二、同分异构现象醛:碳链异构。
酮:碳链异构和羰基位置异构。
三、命名1 系统命名法选择含羰基的最长链。
编号从靠近羰基的一端开始。
CH3CHCHOCH3C6H5CHCHOCH3HC CCH2CH2CHCH2CHOCH32-甲丙醛2-苯丙醛3-甲基-6-庚炔醛CH3CO(CH2)3CH3COCH3COCH2CH32-己酮1-苯-1-乙酮1-环己基-1-丙酮碳原子的位置有时也用希腊字母表示:2酮的取代基命名法CH3CCH2CH3OCOCH3甲基乙基酮甲基苯基酮CHOOH CHOCHO3-羟基苯甲醛1,2-萘二甲醛111CHO2COOH CHOO4-甲酰苯基乙酸2,3-环氧苯甲醛COCH2CH2CH3CH2COCH31-( -萘基)-1-丁酮1-苯基-2-丙酮萘基丙基酮苄基甲基酮第二节醛、酮的结构、物理性质和光谱性质一、醛和酮的结构羰基碳原子sp2杂化。
氧原子上带部分负电荷,碳原子上带部分正电荷。
羰基是极化的,分子有偶极矩。
二、物理性质沸点比相应的烷烃和醚高(极化度大),低于相应的醇(不能形成分子间氢键)。
低级的醛、酮可溶于水(与水形成氢键),中级醛(九到十个碳)具果香味液体,用于香料工业,低级酮是液体,具有令人愉快的气味。
三、光谱性质红外光谱:碳氧双键的伸缩振动,醛在1730cm-1, 酮在1715cm-1, 形成共轭体系时,吸收的波数减小。
醛在2750cm-1处有醛氢与羰基碳之间的碳氢伸缩振动峰。
核磁共振谱:醛氢的化学位移为9-10, 与羰基相连的甲基或亚甲基的化学位移在2-2.5,紫外光谱:非共轭醛、酮在200 nm以上无强烈吸收,共轭的醛、酮则有强烈吸收。
第十一章醛和酮第一节醛、酮的分类和命名一、分类二、命名1.醛、酮的系统命名以包含羰基的最长碳链为主链,看作母体。
从靠近羰基的一端开始,依次标明碳原子的位次。
在醛分子中,醛基总是处于第一位,命名时可不加以标明。
酮分子中羰基的位次(除丙酮、丁酮外)必须标明,因为它有位置异构体。
醛、酮碳原子的位次,除用1,2,3,4,…表示外,有时也用α,β,γ…希腊字母表示。
α是指官能团羰基旁第一个位置,β是指第二个位置…。
酮中一边用α,β,γ…,另一边用α’ β’ γ’…。
ⅰ含醛基、酮基的碳链上的氢被芳环或环烷基取代,就把芳环或环烷基当作主链上的取代基看待:ⅱ醛基与芳环、脂环或杂环上的碳原子直接相连时,它们的命名可在相应的环系名称之后加-“醛”字。
ⅲ当芳环上不但连有醛基,而且连有其它优先主官能团时,则醛基可视作取代基,用甲酰基做词头来命名。
2. 酮还有另一种命名法根据羰基所连的两个烃基名来命名,把较简单的烃基名称放在前面,较复杂的烃基名称放在后面,最后加“酮”字。
后面是母体如含有两个以上羰基的化合物,可用二醛、二酮等,醛作取代基时,可用词头“甲酰基”或“氧代”表示;酮作取代时,用词头“氧代”表示。
英文羰基做取代基时用“oxo”(氧代)表示不饱和醛、酮的命名是从靠近羰基一端给主链编号。
第二节醛、酮的物理性质和光谱性质一、物理性质除甲醛是气体外,十二个碳原子以下的醛、酮都是液体,高级的醛、酮是固体。
低级醛常带有刺鼻的气味,中级醛则有花果香,所以C8~C13的醛常用于香料工业。
低级酮有清爽味,中级酮也有香味。
羰基中,碳和氧以双键相结合,碳原子用三个sp2杂化轨道形成三个σ键,其中一个是和氧形成一个σ键,这三个键在同一个平面上。
碳原子剩下来的一个p轨道和氧的一个p轨道与这三个σ键所形成的平面垂直,彼此重叠形成一个π键由于氧的电负性吸引电子的能力很强,所以羰基是一个极性基团,具有一个偶极矩,负极向氧一面,正极朝向碳的一面。
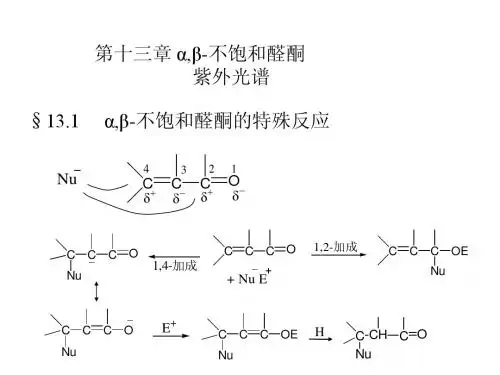
α,β-不饱和羰基α,β不饱和羰基在有机化学的广袤领域中,α,β不饱和羰基化合物宛如一颗璀璨的明珠,因其独特的结构和丰富的反应性而备受关注。
要理解α,β不饱和羰基,首先得从它的结构说起。
这类化合物的特征在于一个羰基(C=O)与一个碳碳双键(C=C)直接相连,形成了α,β不饱和的体系。
其中,与羰基相邻的碳原子被称为α碳,而与α碳相连的双键碳原子则被称为β碳。
这种特殊的结构赋予了α,β不饱和羰基化合物一些独特的性质。
在电子分布方面,由于羰基的强吸电子作用,使得π电子云发生极化,β碳上的电子密度相对较低,从而使其具有较高的反应活性。
α,β不饱和羰基化合物的反应类型丰富多样。
其中,亲核加成反应是其重要的一类反应。
亲核试剂可以进攻羰基碳或者β碳,这取决于反应条件和试剂的性质。
当亲核试剂的亲核性较强且反应条件较为温和时,通常优先发生 1,2-加成,即亲核试剂进攻羰基碳;而当亲核试剂的亲核性较弱或者反应条件较为剧烈时,往往发生 1,4-加成,亲核试剂进攻β碳。
例如,氢氰酸(HCN)与α,β不饱和羰基化合物反应。
在弱碱条件下,主要发生 1,2-加成,生成α氰醇;而在强碱性条件下,则以 1,4-加成为主,得到β氰醇。
除了亲核加成反应,α,β不饱和羰基化合物还能参与共轭加成反应。
共轭加成反应是指亲核试剂与共轭体系中的β碳发生加成。
这种反应在有机合成中具有重要的应用价值,可以构建各种复杂的有机分子。
在合成应用方面,α,β不饱和羰基化合物是构建许多天然产物和药物分子的关键中间体。
通过对其进行各种化学反应,可以引入不同的官能团,从而实现目标分子的合成。
比如,在药物研发中,许多具有生物活性的分子都含有α,β不饱和羰基结构。
通过对其进行化学修饰和改造,可以优化药物的活性、选择性和药代动力学性质。
此外,α,β不饱和羰基化合物在材料科学领域也有一定的应用。
由于其独特的电子结构和反应性,可以用于制备具有特定性能的高分子材料和功能性材料。