颜色化学第六章离域Π键与有机物的颜色共38页
- 格式:ppt
- 大小:336.00 KB
- 文档页数:38

颜色的物理和化学结构一、颜色与化学结构一般地看,染料和合成有机颜料是基本相同的。
其差别就在于染料是溶解性的,颜料是不溶性的。
但这个概念也不绝对,因为有许多染料也是不溶性的,而一些颜料却可溶于非水溶剂中。
故所渭基本相同是从它们的化学和结构观点去看的。
所有的有机染料几乎毫无例外地是从炭环或杂环芳香族化合物衍生而来的,即是由苯及其同系物--萘、蒽、氮萘、氮蒽等衍生而来的。
这些原料都是不饱和化合物,它们能选择性的吸收在光谱中的紫外线部分。
双键数目的增多以及它们的只轭联系,化合价不饱和的特种原子团进入芳族化合物的分子内等等,都会明显地把吸收区域移向可见部分。
这些原子团被称为发色团。
当发色团进入已经足够不饱和的有机化合物中去时,吸收区域就移向光谱的可见部分,这一化合物就成为有色体。
含有发色团的这些有色物质叫做发色体。
发色体的颜色是不太鲜艳和纯粹的。
色相的影响主要取决于静止分子的一般排列,也取决于取代基团或取决于第二型基团,即所谓助色团。
当助色团引入发色体的组织中去后,发色体的颜色才变得纯粹,且大大地提高了它的强度。
主要的发色团有:乙烯基、-N=0亚硝基、-N=N-偶氨基等。
助色团有羟基、胺基以及由它们衍生的基团等,如-OH,-NH2,-NHR,-NR,-SO3H,-COOH,-CH3,-C1。
大多数染料中均含有磺酸基,因此它们带有酸性并具有水溶性。
羧基对颜色的影响不大,但能增加它的坚牢度。
卤素则既能提高坚牢度又能使颜色加深。
对颜色影响不大的基团也叫改性(改变有色体其它性能的)基团。
有些物质的结构中,不一定有什么发色团和助色团,但也有颜色,这充分说明了发色团--助色团理论是有一定的局限性的。
有人认为醌构理论在指导颜色的概念上是比较有用的,如苯是无色的,伹对醌就有黄色了,而稳定的邻醌却是红色的。
一般认为大多数染料的发色体的芳核都是按醌型结构构成的,并把许多染料看成是苯醌的衍生物,若醌构破坏,则颜色消失。
然而,醌构理论也不能解释所有的现象,也有例外,这样,就降低了它的说服力。


有机物的颜色-概述说明以及解释1.引言1.1 概述有机物的颜色一直是化学领域中一个引人注目的研究课题。
通过研究有机物的颜色,我们可以深入了解其分子结构和化学性质,甚至可以应用于生物医学、染料化学、光电子学等多个领域。
本文旨在探讨有机物的颜色与其电子结构之间的关系,并分析影响有机物颜色的因素。
有机物是指含有碳元素的化合物,其分子结构复杂多样,因此也导致了它们的颜色多样性。
有机物的颜色与其分子中存在的共轭体系密切相关。
共轭体系是指由相互连接的单键和双键构成的连续π电子体系。
共轭体系中的π电子能够吸收可见光区域的光线,并反射或透射出特定的波长,呈现出各种各样的颜色。
有机物的颜色也受到分子结构的影响。
不同的官能团和取代基可以改变有机物的电子结构,从而影响其吸收和反射特定波长的能力。
例如,苯环是一种具有稳定共轭体系的分子,它呈现出透明无色的特性。
然而,通过在苯环上引入取代基,如氨基或硝基基团,可以改变苯环的电子结构,使其吸收不同波长的光,从而呈现出不同的颜色。
此外,外界环境条件也可以对有机物的颜色产生影响。
光照、溶剂以及温度等因素都可以改变有机物的电子结构和分子排列方式,从而改变其吸收和反射特定波长光线的能力。
这也解释了为什么有机染料在不同溶剂中呈现出不同的颜色,或者在不同温度下会发生颜色的变化。
因此,通过研究有机物的颜色,我们可以深入理解它们的电子结构和分子性质。
同时,了解影响有机物颜色的因素,不仅能够为有机化学领域的研究提供指导,还可以为材料科学和光电子学等领域的应用提供新思路。
未来的研究方向可以继续探索有机物的电子结构与颜色之间的关系,并设计合成新型有机颜料和染料,为各个领域的应用提供更多的选择。
1.2 文章结构文章结构部分:本文将分为引言、正文和结论三个部分来介绍有机物的颜色。
在引言部分,我们将对有机物颜色的概述进行介绍,包括有机物颜色的基本概念和意义。
接着会对整篇文章的结构进行说明,给读者一个清晰的导读。

高二化学必修三有机物颜色知识点归纳点复习能够使学生巩固和掌握所学的知识技能,为进一步学习作好准备。
下面是由店铺为您带来的高二化学必修三有机物颜色知识点归纳,欢迎翻阅。
高二化学必修三有机物颜色知识点归纳(一)☆绝大多数有机物为无色气体或无色液体或无色晶体,少数有特殊颜色,常见的如下所示:☆三硝基甲苯(俗称梯恩梯TNT)为淡黄色晶体;☆部分被空气中氧气所氧化变质的苯酚为粉红色;☆2,4,6—三溴苯酚为白色、难溶于水的固体(但易溶于苯等有机溶剂);☆苯酚溶液与Fe3+(aq)作用形成紫色[H3Fe(OC6H5)6]溶液;☆多羟基有机物如甘油、葡萄糖等能使新制的氢氧化铜悬浊液溶解生成绛蓝色溶液;☆淀粉溶液(胶)遇碘(I2)变蓝色溶液;☆含有苯环的蛋白质溶胶遇浓硝酸会有白色沉淀产生,加热或较长时间后,沉淀变黄色。
高二化学必修二有机物颜色知识点归纳(二)1 、有机化合物的结构特点决定了有机化合物的性质有如下特点大多数有机物难溶于水,易溶于汽油、酒精、苯等有机溶剂。
绝大多数有机物受热容易分解,而且容易燃烧。
绝大多数有机物不易导电,熔点低。
有机物所起的化学反应比较复杂,一般比较慢,有的需要几小时甚至几天或更长时间才能完成,并且还常伴有副反应发生。
所以许多有机化学反应常常需要加热或使用催化剂以促进它们的进行。
2 、有机反应的常见类型(1)取代反应有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应叫做取代反应。
(2)加成反应有机物分子里不饱和的碳原子跟其它原子或原子团直接结合生成新物质的反应叫做加成反应。
(3)聚合反应小分子通过加成聚合反应的方式生成高聚物的反应为加聚反应。
若聚合的同时又生成小分子的反应为缩聚反应,加聚反应和缩聚反应都属于聚合反应。
(4)消去反应有机化合物在适当的条件下,从一个分子脱去一个小分子(如水、卤化氢等分子),而生成不饱和(双键或叁键)化合物的反应,叫做消去反应。
(5)酯化反应酸与醇作用生成酯和水的反应叫做酯化反应,酯化反应属于取代反应中的一种。

中考化学知识点颜色总结一、颜色的物理性质颜色是我们观察物质时最直观的特征之一,但是颜色并不完全是物质本身的性质,它是由物质对光的吸收、散射和反射的结果。
在中学化学知识中,对于颜色的物理性质一般可以从下面几个方面来进行分析:1. 光谱特性:白光经过三棱镜的折射和反射会分解成不同波长的光,形成可见光的光谱,而不同波长的光就对应了不同的颜色。
这就是常见的光谱分析实验,在化学实验室中,通过光谱仪的对不同化学物质的光谱进行分析,可以通过颜色对化学物质的成分有较为准确的了解。
2. 色谱特性:色谱是一种通过分离化学物质来得到有关物质成分的实验方法,色谱实验常常可以得到不同物质在不同条件下的颜色,通过这些颜色可以推断物质的成分。
3. 吸收和发射特性:不同的物质对光的吸收和发射是不同的,这就导致了在不同的波长的光照射下物质呈现出不同的颜色。
这一点在化学分析过程中非常重要,可以通过物质对不同波长的光吸收和发射的特性来进行化学物质的鉴别。
4. 颜色虚实特性:在日常生活中,我们会碰到一些物质看起来是某种颜色,但是实际上它并不是这种颜色。
例如很多金属的氧化物,外观看起来是有颜色的,但是实际上是没有颜色的,这些颜色是来自于金属的电子转移激发所造成的光学效应。
通过对颜色的物理性质的了解,可以更加深入地理解颜色在化学中的重要性,进而更好地运用化学知识。
二、颜色在化学反应中的作用颜色在化学反应中一般具有两种作用,一种是作为反应物和产物的指示剂,一种是作为反应过程的观察指标。
在中学化学的学习中,颜色在化学反应中的作用表现得尤为明显。
1. 指示剂作用:在一些化学反应中,产生的产物常常表现出不同的颜色,这一特性可以用来判断反应的进行程度或者反应产物的生成情况。
例如过氧化氢和漂白粉的反应,会产生氧气和水,其中氧气会使焦磷酸钠变绿,而水使无水硫酸铜失去蓝色,就可以通过这两种反应来判断产物。
2. 反应过程的观察指标:有些化学反应在进行过程中是可以观察到颜色的变化的,这种变化可以用来判断反应的进行程度以及反应物的消耗情况。


高考必考化学知识点颜色在学习化学的过程中,我们会遇到很多与颜色相关的知识点。
颜色在化学中不仅仅是一种视觉感受,更是物质的性质和组成的表征。
下面,我将为大家总结一些高考必考的化学知识点,涉及颜色方面的内容。
一、颜色与光的关系1.1 光的三原色:红、绿、蓝是光的三原色。
它们相互叠加可以合成其他色彩。
1.2 叠色原理:当我们将两种颜色的光重叠在一起时,会产生新的颜色。
例如红光和绿光重叠可见黄光。
1.3 颜色的伪装性:物体所呈现的颜色是由于它们所吸收的光的颜色,而反射或透过的光的颜色则是我们所看到的。
二、颜色与物质性质的关系2.1 过渡金属离子的颜色:过渡金属离子在溶液中呈现出不同的颜色,这是由于其d轨道电子跃迁引起的。
例如Cu2+溶液呈蓝色,而Mn2+溶液呈粉红色。
2.2 pH指示剂的颜色变化:pH指示剂与溶液的酸碱性发生变化时,会呈现不同的颜色。
例如酸性溶液下酚酞呈红色,中性溶液呈无色,碱性溶液呈蓝色。
2.3 颜料的选择:颜料的颜色是由于其选择性吸收光的不同波长而产生的。
例如蓝色的墨水吸收红光和绿光,只反射蓝光。
三、颜色与化学反应的关系3.1 光合作用:光合作用是植物利用阳光能合成有机物质的过程。
叶绿素是光合作用中的关键色素,它吸收蓝光和红光,反射绿光,使植物呈现绿色。
3.2 化学反应的颜色变化:一些化学反应伴随着颜色的变化,这常常被用于判断反应是否发生。
例如硫酸铜和铁片反应生成铁离子时,溶液的颜色由蓝色变为绿色。
3.3 放光现象:某些化学反应会伴随着光的发射,我们可以观察到不同颜色的光。
例如磷光材料在受到光的激发后会发出蓝、绿、红等不同颜色的光。
以上是关于高考必考的化学知识点中与颜色相关的内容。
颜色不仅仅是化学的一个分支,也是我们生活中不可或缺的一部分。
通过了解颜色背后的化学原理,我们可以更深入地理解物质的本质以及其与光的相互作用。
希望这些知识对你的学习有所帮助,祝你在高考中取得优异的成绩!。

高二化学知识点总结化学颜色高二化学知识点总结:化学颜色颜色的规律(1)常见物质颜色① 以红色为基色的物质红色:难溶于水的Cu,Cu2O,Fe2O3,HgO等。
碱液中的酚酞、酸液中甲基橙、石蕊及pH试纸遇到较强酸时及品红溶液。
橙红色:浓溴水、甲基橙溶液、氧化汞等。
棕红色:Fe(OH)3固体、Fe(OH)3水溶胶体等。
② 以黄色为基色的物质黄色:难溶于水的金、碘化银、磷酸银、硫磺、黄铁矿、黄铜矿(CuFeS2)等。
溶于水的FeCl3、甲基橙在碱液中、钠离子焰色及TNT等。
浅黄色:溴化银、碳酦银、硫沉淀、硫在CS2中的溶液,还有黄磷、Na2O2、氟气。
棕黄色:铜在氯气中燃烧生成CuCl2的烟。
③ 以棕或褐色为基色的物质碘水浅棕色、碘酒棕褐色、铁在氯气中燃烧生成FeCl3的烟等④ 以蓝色为基色的物质蓝色:新制Cu(OH)2固体、胆矾、硝酸铜、溶液中淀粉与碘变蓝、石蕊试液碱变蓝、pH试纸与弱碱变蓝等。
浅蓝色:臭氧、液氧等蓝色火焰:硫、硫化氢、一氧化碳的火焰。
甲烷、氢气火焰(蓝色易受干扰)。
⑤ 以绿色为色的物质浅绿色:Cu2(OH)2CO3,FeCl2,FeSO47H2O。
绿色:浓CuCl2溶液、pH试纸在约pH=8时的颜色。
深黑绿色:K2MnO4。
黄绿色:Cl2及其CCl4的萃取液。
⑥ 以紫色为基色的物质KMnO4为深紫色、其溶液为红紫色、碘在CCl4萃取液、碘蒸气、中性pH试纸的颜色、K+离子的焰色等。
⑦ 以黑色为基色的物质黑色:碳粉、活性碳、木碳、烟耽氧化铜、四氧化三铁、硫化亚铜(Cu2S)、硫化铅、硫化汞、硫化银、硫化亚铁、氧化银(Ag2O)。
浅黑色:铁粉。
棕黑色:二氧化锰。
⑧ 白色物质无色晶体的粉末或烟尘;与水强烈反应的P2O5;难溶于水和稀酸的:AgCl,BaSO3,PbSO4;难溶于水的但易溶于稀酸:BaSO3,Ba3(PO4)2,BaCO3,CaCO3,Ca3(PO4)2,CaHPO4,Al(OH)3,Al2O3,ZnO,Zn(OH)2,ZnS,Fe(OH)2,Ag2SO3,CaSO3等;微溶于水的:CaSO4,Ca(OH)2,PbCl2,MgCO3,Ag2SO4;与水反应的氧化物:完全反应的:BaO,CaO,Na2O;不完全反应的:MgO。
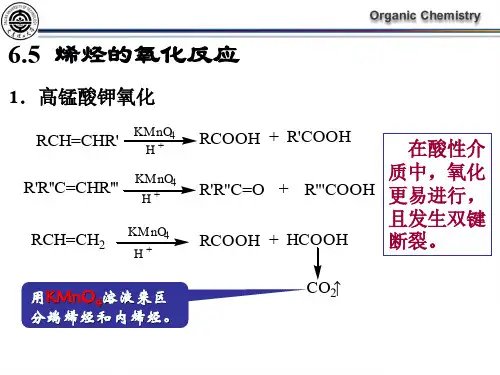

高中化学物质颜色总结1、红色世界(1)基态:Fe2O3 (红褐色)、Fe (OH)3 (红棕色)、[Fe (SCN)]2+ (血红色)、Cu (紫红色)、Cu2O (砖红色)、NO2 (红棕色)、P(红磷、暗红色)、Br2 (深红棕色)、红色石蕊试纸、品红溶液。
(2)激发态:充氦气的灯光呈粉红色,充氖气的灯光呈红色,钙元素的焰色呈砖红色。
(3)化学变化:①紫色石蕊在酸性溶液(pH<5.0)中变红,②润湿的蓝色石蕊试纸遇酸性(CO2、SO2 、H2S 、HCl)变红,③酚酞在碱性溶液中呈浅红色(8.2<pH<10.0)或红色(pH>10),④甲基橙在酸性溶液(pH<3.1)中呈红色,⑤甲基红在酸性溶液(pH<4.4)中呈红色,⑥pH试纸(黄色)遇酸性溶液(pH<2)变红,⑦已经被二氧化硫褪色的品红溶液在加热时会出现红色,⑧C(NaHSO4)>0.001mol/L时遇甲基橙变红。
2、橙色世界(1)基态:浓溴水、甲基橙试剂、Br2 (CCl4)呈橙红色。
(2)化学变化:甲基橙在酸性溶液(3.1<pH< 4.4)中呈橙色,甲基红在酸性溶液(4.4<pH< 6.0)中呈橙色。
3、黄色世界(1)基态:工业盐酸(含有Fe3+)、Au 、S8 、N(2)激发态:钠元素焰色呈黄色(3)化学变化:①甲基橙在(pH>4.4)溶液中呈黄色,②久置的浓硝酸因溶有自身分解产生的二氧化氮而变黄4、绿色世界A(1)基态:F2 (浅黄绿色)、Cl2 (黄绿色)、Cu 2(OH)2CO3 (绿色)CuCl2(浓溶液呈绿色)、FeSO4(浅绿色)(2)激发态:铜元素的焰色呈绿色(3)化学变化:Fe (OH)2 (白色)——灰绿色——Fe (OH)3(红棕色)5、青色世界(1)基态:铁粉、银粉及大多数金属粉末、石墨、CuO 、CuS 、Cu2S FeO 、Fe3O4 、MnO2(2)化学变化:①蔗糖遇浓硫酸被炭化变黑,②润湿的白色醋酸铅试纸遇H2S变黑,③硫磺粉与白色的水银反应生成黑红色的HgS,④H2S通入Pb(NO3)2 、AgNO3 、CuSO4溶液产生不溶于水也不溶于稀盐酸和稀硫酸的黑色沉淀。
【高中化学】高二化学知识点总结:颜色高二
化学知识点总结:颜色
铁:铁粉就是黑色的;一整块的液态铁就是银白色的。
fe2+dd浅绿色fe3o4dd黑色晶体
fe(oh)2dd白色沉淀fe3+dd黄色fe(oh)3dd红褐色沉淀fe(scn)3dd血红色溶液
feodd黑色的粉末fe(nh4)2(so4)2dd淡蓝绿色fe2o3dd红棕色粉末fesdd黑色液态
铜:单质是紫红色cu2+dd蓝色cuodd黑色cu2odd红色cuso4(无水)d白色
cuso4?5h2odd蓝色cu2(oh)2co3d绿色cu(oh)2dd蓝色[cu(nh3)4]so4dd深蓝色溶液
baso4、baco3、ag2co3、caco3、agcl、mg(oh)2、三溴苯酚均就是白色结晶
al(oh)3白色絮状沉淀h4sio4(原硅酸)白色胶状沉淀
cl2、氯水dd黄绿色f2dd淡黄绿色气体br2dd深红棕色液体i2dd紫黑色液态
hf、hcl、hbr、hi均为无色气体,在空气中均形成白雾
ccl4dd无色的液体,密度大于水,与水不互溶kmno4--dd紫色mno4-dd紫色
na2o2d淡黄色固体ag3po4d黄色沉淀sd黄色固体agbrd浅黄色沉淀
agid黄色结晶o3d淡蓝色气体so2d无色,存有秃激性气味、有害的气体
so3d无色固体(沸点44
中考
.80c)品红溶液dd红色氢氟酸:hfdd腐蚀玻璃
n2o4、nodd无色气体no2dd红棕色气体nh3dd无色、存有秃激性气味气体。