第二章共价键理论和分子结构2-1 H2+中的分子轨道及其共价键本质
- 格式:ppt
- 大小:3.65 MB
- 文档页数:134




第二章共价键理论和分子结构两个或多个原子之所以能结合在一起形成稳定的分子(或晶体),是因为原子之间存在着某种强烈的相互作用,即化学键。
因此,化学所关心的就是化学键。
典型的化学键可归纳为共价键、离子键和金属键等三种,广义的化学键还包括范德华力(Van der Waals)和氢键。
其中,较主要的是共价键,因绝大多数分子,尤其是种类繁多的有机分子都含有共价键。
研究共价键的理论主要有价键(Valence bond,即VB)理论和分子轨道(Molecular orbital,即MO)理论,两者都是在20世纪30年代通过量子力学对H2分子的近似处理方法发展起来,其中,价键理论很重视化学图像,而MO理论中的分子轨道更具普遍的数学形式,因此,两者各有所长,有些概念和理念已相互采用。
又因MO理论能解释价键理论不能解释的一些实验现象,且较易程序化,故随着计算机的发展,已成为当今研究化学键理论的主流方法。
本章着重讨论MO理论及其在分子结构中的应用。
§2.1 价键理论要点价键理论强调电子配对,其要点如下:(1)原子A和原子B各有一未成对电子,且自旋相反,则可配对形成共价键。
若A和B原子各有两个或三个未成对电子,则可两两配对形成共价双键和共价三键。
若A原子有两个未成对电子而B原子只有一个,则A原子和两个B原子形成AB2型分子。
(2)两个原子的未成对电子配对后,就不能和第三个原子的单电子配对,即共价键具有饱和性。
(3)两个原子间的电子云重叠越多,所形成的共价键越稳定,这就是电子云的最大重叠原理,表明共价键具有方向性。
尽管价键理论可解释共价键的饱和性和方向性,但还是有些实验现象不能自然地解释。
如O原子的基组态为1s22s22p4,有两个未成对电子,当O原子结合形成O2后,O2分子中应不再有未成对电子,但磁化率测定结果表明O2是顺磁性的,即其分子中有单电子存在。
又如,C 原子的基组态为1s 22s 22p 2,也有两个未成对电子,与O 原子应形成双键,但按照CO 分子的键长及键能数据与有机物中的C -O 单键和C=O 双键比较结果(见表1),CO 中C 与O 应该是以叁键相结合。

杂化轨道理论(图解)一、原子轨道角度分布图S Px Py Pz dz2dx2-y2dxy dxz dyz二、共价键理论和分子结构㈠、共价键理论简介1、经典的化学键电子理论:1916年德国化学家柯塞尔(Kossel)和1919年美国化学家路易斯(Lewis)等提出了化学键的电子理论。
他们根据稀有气体原子的电子层结构特别稳定这一事实,提出各元素原子总是力图(通过得失电子或共用电子对)使其最外层具有8电子的稳定结构。
柯塞尔用电子的得失解释正负离子的结合。
路易斯提出,原子通过共用电子对而形成的化学键称为共价键(covalent [kǝu`veilent]bond[bכnd])。
用黑点代表价电子(即最外层s,p轨道上的电子),可以表示原子形成分子时共用一对或若干对电子以满足稀有气体原子的电子结构。
为了方便,常用短线代替黑点,用“-”表示共用1对电子形成的共价单键,用“=”表示2对电子形成的共价双键,“≡”表示3对电子形成的共价叁键。
原子单独拥有的未成键的电子对叫做孤对电子(lone[lǝun]pair[pεǝ]electron[i`lektrכn])。
Lewis结构式的书写规则又称八隅规则(即8电子结构)。
评价贡献:Lewis共价概念初步解释了一些简单非金属原子间形成共价分子的过程及其与离子键的区别。
局限性:①、未能阐明共价键的本质和特性;②、八隅规则的例外很多。
PCl5SF6BeCl2BF3NO,NO2…中心原子周围价电子数10 12 4 6 含奇数价电子的分子…③、不能解释某些分子的性质。
含有未成对电子的分子通常是顺磁性的(即它们在磁场中表现出磁性)例如O2。
2、1927年德国的海特勒Heitler和美籍德国人的伦敦London两位化学家建立了现代价键理论,简称VB理论(电子配对法)。
1931年,鲍林在电子配对的基础上提出了杂化轨道理论的概念,获1954年诺贝尔化学奖。
3、1928年-1932年,德国的洪特(F.Hund)和美国的马利肯(R.S.Mulliken)两位化学家提出分子轨道理论,简称MO 理论。



第⼆章分⼦结构第⼆章分⼦结构教学要求1、认识化学键的本质;2、掌握价键理论的内容;会⽤价键理论解释共价键的特征,会⽤价电⼦对互斥理论和杂化轨道理论解释简单的分⼦结构;3、初步认识分⼦轨道理论;4、认识分⼦间作⽤⼒和氢键的本质,会⽤其解释对物质性质的影响。
教学重点共价键的形成和本质;现代价键理论,价层电⼦对互斥模型和杂化轨道理论,同核双原⼦分⼦的分⼦轨道构成与意义;分⼦间的作⽤⼒和氢键。
教学难点价层电⼦对互斥理论,分⼦轨道理论。
教学时数9学时教学内容2.1 经典的Lewis学说2.2 价键理论2.3杂化轨道理论2.4分⼦轨道理论2.5价层电⼦对互斥理论2.6共价分⼦的性质2.7分⼦间⼒和氢键教学⽅法与媒体讲解,ppt展⽰。
引⾔通过上⼀章的学习,我们知道只有研究物质的微观结构,才能从本质上更深⼊的理解物质的性质及其变化规律。
本章内容是在原⼦结构的基础上,围绕以共价键结合的分⼦讨论有关共价键的各种理论模型以及分⼦的各种性质。
化学键:通常把分⼦或晶体中相邻原⼦之间(或离⼦)强烈的相互作⽤。
化学键有共价键、离⼦键、⾦属键。
分⼦结构通常包括:分⼦中原⼦的化学键,分⼦的空间构型,分⼦的结构与物质的物理性质、化学性质。
2.1 Lewis理论(路易斯1916年)1、电⼦配对理论---共⽤电⼦对成键。
1916年,美国的Lewis提出共价键理论,认为分⼦中的原⼦都有形成稀有⽓体电⼦结构的趋势,求得本⾝的稳定。
⽽达到这种结构,并⾮通过电⼦转移形成离⼦键来完成,分⼦中原⼦之间通过共享电⼦对⽽使每⼀个原⼦都具有稀有⽓体的稳定的电⼦结构,也称为⼋隅律规则。
路易斯结构式:把⽤短棍表⽰共价键,同时⽤⼩⿊点表⽰⾮键合的“孤对电⼦”的结构式叫做路易斯结构式。
2、Lewis学说成绩:⑴解释了⼀些简单的⾮⾦属单质和化合物分⼦的形成过程;⑵指出了共价键与离⼦键的差异。
3、Lewis学说的局限性:⑴未能阐明共价键的本质及特征,为什么都带负电荷的2个电⼦不是互相排斥,⽽配对成键?为什么共价键有⽅向性?⑵⼋偶体规则,例外很多。

第二章共价键理论和分子结构本章是全书重点内容之一。
主要讨论共价键理论及分子结构。
一、重点及难点重点:1.线性变分法:线性变分法是本章的关键内容,无论是分子轨道理论还是价键理论都要用到它。
教学中,除了要使同学掌握线性变分法处理问题的具体步骤外,更要使他们明白为什么要这样作,根据是什么。
这就要求:在讲授中首先要讲清变分原理的基本思想;其次,在写线性变分函数时,应特别注重物理模型的分析。
2.分子轨道理论、Huckel分子轨道法难点:电荷密级与键级。
在教学中应紧紧抓往“定域键是离域键在局部区域的总效果”这一基本思想,导出公式,并使学生明确各公式的物理意义。
键级问题解决得好,“自由价、分子图”就不成问题了。
二、基本要求1.懂得变分原理的基本思想,掌握线性变分法。
通过对氢分子离子的处理,了解共价键的本质,并掌握α、β、s积分的物理意义。
2.掌握分子轨道理论的要点及成键三原则,并着重理解对称性原则的深刻含意。
3.掌握简单双原子分子的结构,并能对N2的结构作出解释。
4.掌握价键理论的基本要点。
5.了解杂化轨道理论,重点掌握s-p杂化及有关分子的结构,并能熟练地应用键角公式,成键能力公式进行有关计算。
6.掌握定域轨道和离域轨道的概念。
7.掌握HMO法,并能对丁二烯等简单分子进行处理。
8.掌握键级,电荷密级及自由价的物理含义和有关计算,并能利用分子图说明有关问题。
9.能找出分子中存在的对称元素及其生成的有关对称操作;能准确判定一般分子所属的点群。
三、基本内容分子结构:1、 几何结构:原子空间排布及相对位置、键长、键角。
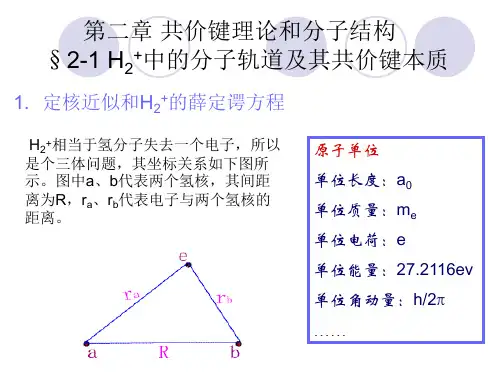
2、 化学结构:原子间力——化学键(离子、共价、金属)第一节 H2+的分子轨道和共价键的本质1、氢分子离子的薛定谔方程1.定核近似(Born-Oppenheimer近似)EMBED Equation.3EMBED Equation.3假定两核不动,核动能为零。
2.原子单位制(Atomic Unit)(1) 单位长度 1a.u.= a0 = 0.529177A=52.9177pm(2) 单位质量 1a.u.= m e =9.1095 EMBED Equation.3 10-28g(3) 单位电荷 1a.u.= e = 1.60219 EMBED Equation.3 10-19C(4) 单位能量 1a.u.= EMBED Equation.3 =27.2166 eV(5) 单位角动量1a.u.= EMBED Equation.3 = 1.0545887EMBED Equation.3 10-34 J·s引入原子单位后的薛定谔方程EMBED Equation.3其中r a、r b、R均以a0为单位H2+的薛定谔方程可以使用球极坐标精确求解,但无推广意义,仅适用于H2+,绝大多数分子不能精确求解,因此采用近似处理方法:变分法。

第二章共价键理论和分子结构讲解第二章:共价键理论和分子结构共价键理论是描述化学键形成的理论,它解释了原子是如何通过共享电子来形成化学键的。
共价键是一种通过共享电子对来使两个原子相互吸引的化学键。
共价键的形成基于原子的电子云的重叠,当两个原子靠近时,它们的电子云开始重叠,形成一个共享电子对。
共享的电子对对两个原子的原子核产生吸引力,将两个原子结合在一起形成稳定的分子。
共享电子对的数目通常取决于原子需要准确达到八个电子(称为八原则)。
共价键可以是单个、双重或三重键,这取决于原子之间共享的电子对数。
单共价键是仅共享一个电子对的化学键,双重键是共享两个电子对的化学键,三重键则共享三对电子。
共价键的形成可以通过独立原子的轨道重叠和自由基重叠来解释。
在共价键的理论中,有两个重要的概念需要了解:价电子和杂化。
价电子是处于最外层能级的原子的电子,它们决定了原子的化学性质和元素的周期表位置。
杂化是指在形成共价键时,原子轨道的重组,以便使电子重叠形成共享电子对。
分子结构是描述分子中原子排列和化学键连接方式的方式。
分子结构可以通过不同的方法确定,如实验技术(如X射线晶体学和光谱学)和理论计算方法(如量子化学计算)。
分子结构决定了分子的性质和反应行为。
分子结构的分析方法之一是通过原子间的距离和角度来确定。
在共价键中,原子之间的距离和角度是由共价键的强度和方向性决定的。
共价键的强度通常通过键长来表示,而键的方向性则由杂化决定。
另一个重要的分子结构参数是分子几何构型,它描述了原子在空间中的排列方式。
最常见的分子几何构型包括线性、角度、平面和立体构型。
分子几何构型是由化学键数和孤对电子数决定的。
分子结构的研究对于理解化学反应和预测化学性质非常重要。
例如,分子的空间结构可以影响其对光的吸收和发射行为,这是荧光和发射光谱等实验技术的基础。
另一方面,分子结构也可以用于预测分子的稳定性和反应性,有助于设计和改进化合物的性质和用途。
总之,共价键理论和分子结构是为了解释和描述化学键的形成和原子在空间中的排列而发展的理论。
第2章分子结构[教学要求]1.掌握离子键和共价键的基本特征和它们的区别。
2.掌握价键理论,杂化轨道理论。
3.掌握分子轨道理论的基本内容。
4.了解分子间作用力及氢键的性质和特点。
[教学重点] 1.VSEPR 2.VB法3.MO法[教学难点] MO法[教学时数] 6学时[主要内容]1.共价键:价键理论-电子配对法(本质,要点,饱和性,方向性,类型σ键、π键)。
2.VSEPR:价电子互斥理论的提出,价电子互斥理论的基本要点以及用价电子互斥理论分析各类分子和原子团的空间构型。
3.杂化轨道理论:杂化轨道理论的提出,杂化轨道理论的基本要点,杂化轨道的类型-sp、spd 等各种类型及举例。
4.分子轨道理论:分子轨道理论的基本要点,分子轨道的能级图,实例-同核:H2、He、O2、F2、N2;异核:NO、HF。
5.共价键的属性:键长,键角,键能,键级。
6.分子间的作用力和氢键。
[教学内容]上一章主要研究的是原子的结构与性质,本章进一步讨论原子同原子之间和分子之间靠什么力结合在一起?分子有什么性质?具体的讲2-1 路易斯结构式一、弗兰克兰结构式到19世纪时,化学家们已经知道了许多分子的成分,如氯化氢HCl、水H2O、二氧化碳CO2、氨NH3等,并用短棍线“—”的形式来描述分子中原子之间的相互结合“1价”,还总结出一些规律。
其中英国化学家弗兰克兰和瑞典化学家贝采尼乌斯贡献较大。
这些表达方式,在我们中学化学课本中还在沿用。
二、路易斯结构式1916年美国的著名化学家(加里福尼亚大学教授)路易斯利用原子结构知识对弗兰克兰结构式的短棍线“—”进行了解释,即“—”代表一对共用电子对,= 代表两对共用电子对,≡代表三对共用电子对,并进一步提出了键合电子和孤对电子的概念以及分子结构稳定性的“八隅律”—原子倾向于通过共用电子对使它们的最外层达到稀有气体的8电子稳定构型。
1923年路易斯进一步将化合物分子中两个原子在一起的共享电子对称为共价键,从而建立了路易斯共价键理论。
《结构化学》课程教学大纲学时:50学时学分:3.0学分适用专业:化学教育、应用化学、材料化学一、说明1、《结构化学》课程的性质和任务《结构化学》是研究原子、分子及晶体的结构,以及结构与性能之间关系的一门基础理论课。
设置本课程的目的在于培养学生在建立量子力学基本概念的基础上,掌握微粒运动的基本规律。
获得原子、分子及晶体结构的基本理论和实验研究方法,让学生在深入到原子、分子的电子层结构上来掌握物质的微观结构与宏观性质之间的关系。
明确“结构决定性能、性能反映结构”这一重要原则,为今后从事教学和科研或继续升造,打下坚实的理论基础。
2、《结构化学》课程的基本要求(1).在熟悉电子等实物微粒基本特性的基础上,掌握波函数、薜定谔方程及算符等量子力学重要原理、应用量子力学原理来研究原子结构。
(2).掌握分子轨道理论和配位场理论,应用分子轨道理论深入研究分子结构和配合物结构,了解分子光谱的基本原理和方法。
(3).掌握晶体的点阵理论,明确各类晶体结构特征及结构与性能之间的关系,理解x-射线晶体结构分析的基本原理以及联系衍射二要素和晶胞二要素的重要方程。
二、正文绪论《结构化学》主要内容及研究途径、学习方法第一章量子力学基础和原子结构1.量子论诞生和量子力学基本原理经典物理学困难和量子论诞生实物微粒的波粒二象性及“不确定关系”(重点)波函数、薜定谔方程、势箱中运动的粒子定态薜定谔方程的算符表达式2.氢原子与类氢离子的定态薜定谔方程及其解方程的直角坐标和球坐标表达式、基态解、变数分离法(难点)方程解的物理意义讨论、量子数、实复波函数(重点)波函数和电子云的图形表示3.多电子原子结构理论的轨道近似模型中心力场模型和原子轨道(重点)屏蔽模型、自洽场模型电子自旋及保里不相容原理自旋相关效应思考题见教材144页,思考题与习题3,5,6,9,11题第二章共价键理论和分子结构1.H+2中的分子轨道及共价键本质定核近似和H+2的薜定谔方程变分原理及线性变分法线性变分法对H+2的第一步近似处理第一步近似处理的讨论、离域效应2.分子轨道理论及其应用分子轨道理论的要点、概念、LCAO-MO法(重点)成键三原则、电子填充三原则(重点)双原子键和双原子分子结构饱和分子的离域轨道和定域轨道3.HMO法和共轭分子结构HMO法要点(重点)丁二烯和苯的HMO法处理电荷密度、键级自由价、分子图离域 键形成条件及类型4.分子对称性和分子点群对称元素和对称操作群概念和群的阶数分子点群、分子点群的确定对称性和分子的物理性质5.测定分子结构的实验方法分子光谱的分类及其所在波段分子的转动光谱分子的振动光谱思考题见教材299页,思考题与习题1,2,5,6,7题第三章配位场理论和络合物结构1.晶体场理论d轨道能级分裂(重点)d轨道中电子的排布——高自旋态和低自旋态晶体场稳定化能络合物畸变和姜——泰勒效应2.络合物的分子轨道理论理论要点正八面体络合物中的σ—配键正八面体络合物中的л—配键σ—л配键和羰基络合物、氮分子络合物结构不饱和烃络合物—л络合物结构思考题见教材374页,思考题与习题1,2,3题第四章晶体结构1.晶体的点阵理论点阵定义、分类晶胞定义及晶胞的二个基本要素(重点)晶面和晶面指标2.晶体的对称性晶体的宏观对称性:32点群,7个晶系14种空间点阵晶体的微观对称性:空间对称操作3.结晶化学金属晶体和金属键离子晶体和离子键共价键型晶体和混合键型晶体分子型晶体和分子间作用力4.X—射线晶体结构分析原理X—射线在晶体中的衍射机理衍射方向与晶胞参数Laue方程Bragg方程衍射强度与晶胞中原子的分布晶体结构分析方法思考题与习题1,2,4,5题考试方式及方法:举行一次期末闭卷考,时间2小时,教考分离。