第二章 离域化学键
- 格式:ppt
- 大小:1.48 MB
- 文档页数:38


谈离域键,首先得知道它是什么。
离域键是:在多个原子之间形成的共价键。
离域键有缺电子多中心键,富电子多中心键,π配键,夹心键和共轭π键等几种类型。
当分子中总的价电子对数目少于键的数目时,就会形成缺电子多中心键。
在多原子分子中如有相互平行的p 轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键,或大π键。
下面来浅谈几个我知道的例子吧。
例如,在乙硼烷中有两个B─H─B桥式两电子三中心键。
缺电子多中心键常导致形成环状或笼形分子结构。
当电子对的数目超过可能形成的定域键数时,会出现富电子多中心键。
还有就是XeF2中存在四电子三中心键。
π配键是配体的π电子向受体配位形成的。
同样,在[(C2H4)PtCl3]中,乙烯的π电子向铂原子配位,形成C─Pt─C三中心键。
夹心键是指夹心络合物中存在的共轭π键向中心离子的配位键。
最早发现的夹心络合物是二茂铁Fe(C5H5)2,其中铁和两个茂环之间存在夹心键。
共轭π键是在三个以上原子中心之间形成的大π键。
苯是典型的包含共轭π键的分子,其中有遍及六个碳原子的大π键。
具有离域键的分子不可能用唯一的只含定域键的结构式表示。
从定域键形成离域键,能使体系的能量降低,降低的这部分能量称为共轭能或离域能。
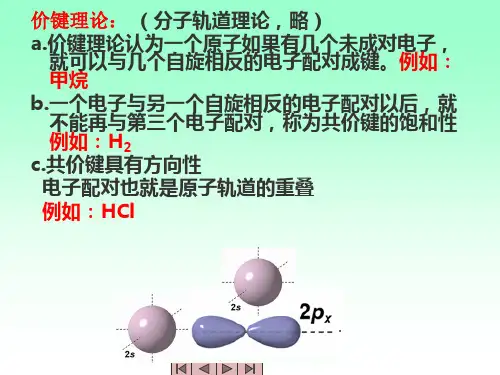
那么我们应该怎么样来判断大π键呢?首先,要确定中心原子的杂化类型(一般配位原子都是以一对电子参与大π键的形成)。
ClO2中Cl以sp2杂化,形成平面三角型的三个杂化轨道。
接下来,确定中心原子与配位原子形成的σ键。
ClO2中,Cl与两个O形成两个σ键,分子呈V形。
形成离域键(也就是所谓的大π键)也是要条件的:①这些原子都在同一平面上;②这些原子有相互平行的p轨道;③p轨道上的电子总数小于p轨道数的2倍。
举几个例子。
例如,苯的分子结构是六个碳原子都以sp2 杂化轨道结合成一个处于同一平面的正六边形,每个碳原子上余下的未参加杂化的p轨道,由于都处于垂直于苯分子形成的平面而平行,因此所有p轨道之间,都可以相互重叠而形成以下图式:苯的大π键是平均分布在六个碳原子上,所以苯分子中每个碳碳键的键长和键能是相等的。

谈离域键,首先得知道它是什么。
离域键是:在多个原子之间形成的共价键。
离域键有缺电子多中心键,富电子多中心键,π配键,夹心键和共轭π键等几种类型。
当分子中总的价电子对数目少于键的数目时,就会形成缺电子多中心键。
在多原子分子中如有相互平行的p 轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键,或大π键。
下面来浅谈几个我知道的例子吧。
例如,在乙硼烷中有两个B─H─B桥式两电子三中心键。
缺电子多中心键常导致形成环状或笼形分子结构。
当电子对的数目超过可能形成的定域键数时,会出现富电子多中心键。
还有就是XeF2中存在四电子三中心键。
π配键是配体的π电子向受体配位形成的。
同样,在[(C2H4)PtCl3]中,乙烯的π电子向铂原子配位,形成C─Pt─C三中心键。
夹心键是指夹心络合物中存在的共轭π键向中心离子的配位键。
最早发现的夹心络合物是二茂铁Fe(C5H5)2,其中铁和两个茂环之间存在夹心键。
共轭π键是在三个以上原子中心之间形成的大π键。
苯是典型的包含共轭π键的分子,其中有遍及六个碳原子的大π键。
具有离域键的分子不可能用唯一的只含定域键的结构式表示。
从定域键形成离域键,能使体系的能量降低,降低的这部分能量称为共轭能或离域能。
那么我们应该怎么样来判断大π键呢?首先,要确定中心原子的杂化类型(一般配位原子都是以一对电子参与大π键的形成)。
ClO2中Cl以sp2杂化,形成平面三角型的三个杂化轨道。
接下来,确定中心原子与配位原子形成的σ键。
ClO2中,Cl与两个O形成两个σ键,分子呈V形。
形成离域键(也就是所谓的大π键)也是要条件的:①这些原子都在同一平面上;②这些原子有相互平行的p轨道;③p轨道上的电子总数小于p轨道数的2倍。
举几个例子。
例如,苯的分子结构是六个碳原子都以sp2 杂化轨道结合成一个处于同一平面的正六边形,每个碳原子上余下的未参加杂化的p轨道,由于都处于垂直于苯分子形成的平面而平行,因此所有p轨道之间,都可以相互重叠而形成以下图式:苯的大π键是平均分布在六个碳原子上,所以苯分子中每个碳碳键的键长和键能是相等的。






2025年高考化学一轮复习基础知识讲义—大π键(离域π键)(新高考通用)【必备知识】定义:3个及以上原子构成离子团或分子中,原子有彼此平行的未参与杂化的p轨道电子连贯重叠在一起,构成π型化学键,又称离域或共轭大π键。
条件:①原子在同一平面或直线;②中心原子sp或sp2杂化(若提供d轨道则中心原子应为sp3d杂化)。
表示:πn m(m:参与形成大π键的原子数;n:参与形成大π键的电子数,n<2m)分析方法——图示法分析步骤:①判断出中心原子杂化方式,并画出σ键。
②未成对电子优先形成大π键。
例:用图示法表示下列物质的大π键物质图示解析所有C原子均采取sp2杂化,1、4号C原子的两个sp2杂化轨道分别与H原子的1s轨道成键,一个sp2杂化轨道与2、3号C原子的sp2杂化轨道成键,这样4个C原子具有一个含一个孤电子的未参与杂化的2p轨道,它们是相互平行的,形成Π44。
中心原子C采取sp2杂化,6个C原子具有一个含一个孤电子的未参与杂化的2p轨道,它们是相互平行的,形成Π66。
CO32-中心C原子采取sp2杂化,周围三个O原子的未成对电子的2pz轨道优先参与形成Π键,各提供一个2p电子,再加上得到两个电子,即Π64。
C O例、用图示法表示下列物质的大π键物质图示表示物质图示表示Π65Π66Π65Π65 SO2Π43NO2-Π43 BF3Π64NO3-Π64SO3Π64有配位键ClO2Π53有配位键其他分析方法:①Π电子总数计算:n=价电子数-σ键电子总数-孤对电子总数=价电子总数- 杂化轨道数目×2- 孤电子对数×2②等电子体:如3原子16电子微粒CO2、CS2、N2O、COS、N-、SCN-,有两套Π43;3原子18电子微粒SO2、O3、NO2-,有Π43;4原子24电子微粒SO3、BF3、NO3-、CO32-,有Π64。
【题型突破】1、(2020 山东卷)B3N3H(无机苯)的结构与苯类似,也有大π键。
