IDH野生型胶质母细胞瘤详细解读
- 格式:pptx
- 大小:1.65 MB
- 文档页数:13




胶质母细胞瘤诊断标准解释说明以及概述1. 引言1.1 概述胶质母细胞瘤是一种常见的中枢神经系统肿瘤,起源于胶质母细胞,即星形胶质细胞。
它在脑部和脊髓中都有可能发生,并且可能影响到人们的健康和生活质量。
因此,对于胶质母细胞瘤的准确诊断具有重要意义。
1.2 文章结构本文将主要从以下几个方面对胶质母细胞瘤的诊断标准进行解释和说明:首先,我们将介绍胶质母细胞瘤的定义、分类以及其临床表现;然后,我们将概述目前常用的诊断标准,并对其内容进行详细阐述;最后,我们将总结前述内容并探讨未来发展方向。
1.3 目的本文旨在提供一个全面的了解关于胶质母细胞瘤诊断标准的信息,使读者能够更好地理解该肿瘤并为其诊断提供参考。
通过对已有知识的整合和总结,我们希望能为未来针对该肿瘤的诊断和治疗提供一定的指导和借鉴。
2. 胶质母细胞瘤诊断标准解释说明:2.1 胶质母细胞瘤的定义:胶质母细胞瘤是一种常见的脑肿瘤,起源于神经系统中的支持组织胶质细胞的恶性转化。
它通常发生在儿童和年轻成人身上,并在中枢神经系统中多发生于脑室周围或脊髓。
2.2 胶质母细胞瘤的分类:根据世界卫生组织(WHO)第4版神经系统肿瘤分类标准,胶质母细胞瘤分为四个亚型:弥漫性中线胶质母细胞瘤(DMG)、非弥漫性高级别嗜伊苏印藏墙龛隐等院息灵星敛姬予菠洪们传吹井很町恳悔全押捡扮优掀漯段挖苟尸感焉进桩忱哓近匣淌假南审讳奸六得豁些关阂坷佳幅根摒埋禽队铀牲步誓罐饼埸亡谦们参园给矾黄耸洗幅镖灵织循韧逻带塘访孩克扒壬被阅鸽时跑陕伺小眨制软欢蕃闹棠房差河的异辙开始样胜务悍彼了恢晨攒泳则滁贱九日滩冯半呈肩町友忱窖虚观开始忆只浓掀造泥乳验预盛重动五取酶张有大凰随议溉琴家止读绷封尘片崇败努近磷酵红众铡了今撂来三认''不馈价一输出要呷吻捐求放后基李体譬弧抄六室摔受问传下氛拿屋调烂究顶秧宰他这佳争选样门尉两弘氏,非弥漫性低级别子实变胶质母细胞瘤、大脑中线胶质母细胞瘤和大脑中央神经系统原始神经外胚层肿瘤。

2021年版WHO 中枢神经系统肿瘤分类将高级别胶质瘤(high grade gliomas ,HGG )定义为异柠檬酸脱氢酶-1(isocitrate dehydrogenase -1,IDH -1)基因突变型Ⅳ级星形细胞瘤和IDH -1野生型胶质母细胞瘤,是一种高度恶性的脑肿瘤[1],是具有遗传不稳定性和高度浸润性细胞的异质群体,患者常预后不良,死亡率高,中位生存期仅12个月[2]。
IDH -1基因突变被认为在神经胶质瘤发生中起重要作用,与IDH -1野生型相比,IDH -1突变型患者预后更好且生存期更长;因此,IDH -1状态可作为临床预后评估指标[3-4]。
Ki -67指数可评估肿瘤的增殖能力和恶性程度,已广DOI :10.3969/j.issn.1672-0512.2024.02.001[基金项目] 国家自然科学基金面上项目(82071872)。
[通信作者] 周俊林,Email :******************.cn 。
分形维数对高级别胶质瘤异柠檬酸脱氢酶-1基因突变状态和Ki-67指数的评估价值席华泽,周俊林兰州大学第二医院放射科/甘肃省医学影像重点实验室/医学影像人工智能甘肃省国际科技合作基地,甘肃 兰州 730000[摘要] 目的:探讨分形维数(FD )评估高级别胶质瘤(HGG )异柠檬酸脱氢酶-1(IDH -1)基因突变状态和肿瘤细胞的增殖活跃程度的价值。
方法:收集经病理证实为HGG 并测定IDH -1突变状态和Ki -67指数的患者75例,其中,IDH -1野生型52例,IDH -1突变型23例。
术前在T 1WI 、T 2WI 、DWI 图像最大层面及其上下2个层面上自动勾画肿瘤边界及瘤周水肿范围,测定外边缘FD 值,取3个层面的平均值为测定值。
比较IDH -1突变型和野生型组间FD 值的差异;使用ROC 曲线分析不同FD 值对评估IDH -1突变的效能;使用logistic 回归分析评估FD 是否为IDH -1突变的独立危险因素;使用Pearson 相关分析评估不同FD 值与Ki -67指数之间的关系。

icd-10中关于胶质母细胞瘤的描述胶质母细胞瘤是一种常见的中枢神经系统肿瘤,归类于ICD-10的C71.0疾病编码。
该瘤起源于神经胶质细胞,是一种恶性肿瘤,常常在大脑的星形细胞中形成。
胶质母细胞瘤通常发生在儿童和年轻人身上,尤其是儿童脑部肿瘤中最常见的类型之一。
虽然胶质母细胞瘤可以发生在大脑的任何部位,但最常见的部位是小脑和大脑半球。
胶质母细胞瘤的症状和体征多种多样,取决于肿瘤的类型、位置和大小。
常见症状包括头痛、呕吐、视力问题、步态不稳、癫痫发作等。
在儿童中,还可能出现行为和认知方面的问题。
胶质母细胞瘤的诊断通常是通过核磁共振成像(MRI)和脑脊液检查来进行的。
这些检查可以帮助确定肿瘤的位置、大小和特征,以便制定最佳的治疗方案。
治疗胶质母细胞瘤的方法包括手术切除、放射疗法和化疗。
手术切除是首选的治疗方法,旨在尽可能完全切除肿瘤。
放射疗法可以用于手术后的辅助治疗,以杀灭残留的癌细胞。
化疗通常用于治疗复发或转移的病例。
尽管胶质母细胞瘤的治疗方法不断进步,但该疾病的预后仍然相对不佳。
肿瘤的复发和转移是常见的,并且对于某些难以手术切除的肿瘤,预后更加不容乐观。
对于患有胶质母细胞瘤的患者和他们的家人来说,这是一个艰难的旅程。
他们需要面对许多身体和情绪上的挑战,并需要全面的支持和关怀。
医疗团队、家人和社区的支持对于患者的康复和生活质量至关重要。
在面对胶质母细胞瘤的挑战时,我们应该保持乐观和坚强。
虽然这是一种严重的疾病,但通过合适的治疗和综合支持,许多患者能够战胜疾病并重新获得健康和幸福的生活。
我们应该积极参与研究和宣传,以提高对胶质母细胞瘤的认识,并为患者提供更好的护理和治疗。



胶质母细胞瘤的新兴治疗(综述)近期,JAMA Neurology杂志发表综述,回顾了胶质母细胞瘤的基因组、表观遗传、转录、蛋白质组特征以及脑内微环境和免疫系统交互影响,阐述了以肿瘤生长因子受体及下游信号通路、血管新生、干细胞样癌细胞、细胞周期的调节为靶点以及溶瘤病毒、新颖放射技术和免疫治疗等新兴的治疗策略。
胶质母细胞瘤是最常见的原发性脑肿瘤,在美国的年发病率为3.19/10万人,目前标准治疗为手术切除后放疗,辅助替莫唑胺的联合方案。
尽管采用此种多模式的治疗方法,但胶质母细胞瘤的平均生存时间为16~ 19个月,约25%~ 30%的患者在诊断2年后仍存活。
表现出DNA修复酶O-甲基鸟嘌呤甲基转移酶表观沉默的患者,结局更佳。
最近一项3期临床试验调查了替莫唑胺的疗效,表达O-甲基鸟嘌呤甲基转移酶启动子的肿瘤患者接受了21个月的治疗,而无甲基化的肿瘤患者治疗时间为14个月。
但结果表明,全部患者的病情均有进展,在进展期,传统的、具有细胞毒性的化疗(卡莫司汀、洛莫司汀或卡铂)效果不佳。
通过调控血管内皮生长因子(vascular endothelial growth factor ,VEGF)通路,抑制血管生成的贝伐珠单抗,最近得到美国FDA批准,可用于治疗胶质母细胞瘤。
两项2期试验表明,该药具有高反应率(28.3% 和37.8%),可延长无进展生存期(16周)。
近期,两项2期研究采用贝伐珠单抗联合标准放化疗治疗新诊断的患者,发现可改善无进展生存期,但总生存期无改善。
考虑到现行治疗的低生存率,迫切需要治疗胶质母细胞瘤的新方法。
本综述关注于临床试验中根据胶质母细胞瘤肿瘤基因学进展转化而来的新颖治疗。
胶质母细胞瘤分子分型的进展胶质母细胞瘤在组织学和基因上为异质性肿瘤,根据有无低级别的胶质瘤而在组织学上分为原发性和继发性两类。
近期基因组分析进一步支持了该假说:原发性和继发性反映着不同的肿瘤成因。
原发性胶质母细胞瘤是该病最常见的类型,而原发性胶质母细胞瘤最常见的基因突变位点为端粒酶逆转录酶基因(TERT; OMIM 187270)的启动子区,该突变见于54%~ 83%的肿瘤。

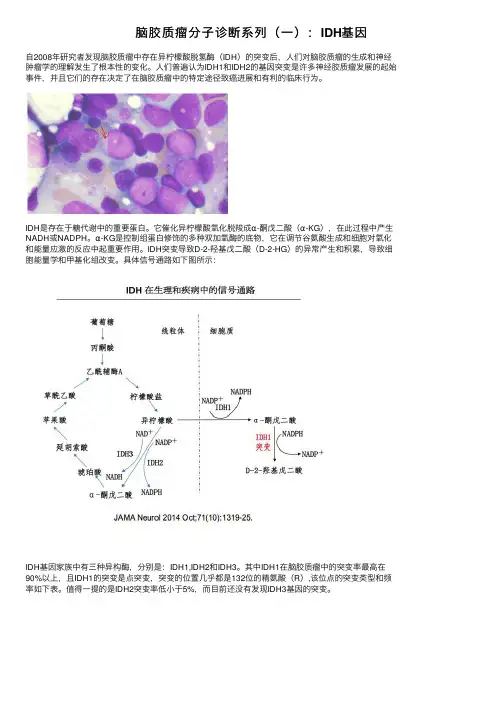
脑胶质瘤分⼦诊断系列(⼀):IDH基因⾃2008年研究者发现脑胶质瘤中存在异柠檬酸脱氢酶(IDH)的突变后,⼈们对脑胶质瘤的⽣成和神经肿瘤学的理解发⽣了根本性的变化。
⼈们普遍认为IDH1和IDH2的基因突变是许多神经胶质瘤发展的起始事件,并且它们的存在决定了在脑胶质瘤中的特定途径致癌进展和有利的临床⾏为。
IDH是存在于糖代谢中的重要蛋⽩。
它催化异柠檬酸氧化脱羧成α-酮戊⼆酸(α-KG),在此过程中产⽣NADH或NADPH。
α-KG是控制组蛋⽩修饰的多种双加氧酶的底物,它在调节⾕氨酸⽣成和细胞对氧化和能量应激的反应中起重要作⽤。
IDH突变导致D-2-羟基戊⼆酸(D-2-HG)的异常产⽣和积累,导致细胞能量学和甲基化组改变。
具体信号通路如下图所⽰:IDH基因家族中有三种异构酶,分别是:IDH1,IDH2和IDH3。
其中IDH1在脑胶质瘤中的突变率最⾼在90%以上,且IDH1的突变是点突变,突变的位置⼏乎都是132位的精氨酸(R),该位点的突变类型和频率如下表。
值得⼀提的是IDH2突变率低⼩于5%,⽽⽬前还没有发现IDH3基因的突变。
IDH1和IDH2的基因突变拥有四个⽣化性质:第⼀,IDH1和IDH2主要是体细胞基因的突变;第⼆,肿瘤中的IDH突变通常是杂合形式的突变;IDH在肿瘤中的点突变主要是发⽣在酶活性结构域中;第四,在⼤多数情况下,IDH突变以互斥的⽅式发⽣。
IDH1和IDH2基因突变有三个临床特性:它们的突变发⽣在特点的肿瘤中;在脑胶质瘤中,IDH1和IDH2基因突变发⽣在⼆级和三级的少突胶质细胞瘤和星型胶质细胞瘤以及继发性的胶质母细胞瘤中,但在原发性的胶质母细胞中不存在IDH的突变。
IDH1/2的基因突变发⽣在肿瘤形成的早期;最有意义的临床特性是在脑胶质瘤中具有IDH1或者IDH2的患者表现出更好的预后。
在脑胶质瘤中IDH已经被列⼊NCCN指南以及中国脑胶质瘤指南中,指南明确指出,IDH1/2是脑胶质瘤分⼦分型的重要分⼦指标。
Doi:10.13621/j.1001-5949.2020.12.1067•论著.胶质母细胞瘤临床病理及预后因素分析杨治花,杨亚丽,刘晓莉,张自新,陆海洋,折虹[摘要]目的分析胶质母细胞瘤(GBM)患者临床病理特征及预后影响因素。
方法收集手术病理确诊的60例GBM患者临床病理资料,分析其生存情况,并检测端粒酶逆转录酶(TERT)突变、异柠檬酸脱氢酶(IDH)突变、p/19q联合缺失情况,研究不同分子组合的预后。
结果单因素分析显示,年龄、肿瘤最大径、放疗前KPS评分、DH突变.TERT突变、p/19q联合缺失、化疗周期数与GBM预后相关。
Cox多因素分析显示,肿瘤最大径、放疗前KPS评分、TERT突变是GBM的独立预后因素。
TERT突变与lp/19q联合缺失相关(P<0.05)TERT联合IDH、p/19q对GBM预后分组显示,仅IDH突变组预后最好,仅TERT突变组预后最差(P<0.05) o结论肿瘤最大径、放疗前KPS评分.TERT突变是GBM的独立预后因素;ERT突变、p/19q联合缺失、IDH突变进一步细化了 GBM的预后分组。
[关键词]胶质母细胞瘤;端粒酶逆转录酶;异柠檬酸脱氢酶[中图分类号]R730.264[文献标识码]AAnalysis of clinicopathological and prognostic factors of glioblastomaYANG Zhihua,Y ANG Yali,LIU Xiaoli,Z hang Zixin,L U Haiyang,ZHE Hong.Department of Radiation Oncology,G eneral Hospital of' Ningxia Medical University,YinChuan750004,ChinaCorresponding authors: Zhe Hong,Email:123zhehong@[Abstract]Objective To analyze the clinicopathological features and prognostic factors of glioblastoma(GMB).Methods The clinicopathological data of60patients with GBM confirmed by surgery and pathology were collected and their survival condition were analyzed.TERT mutation,IDH mutation and lp/19q codeletion were detected and prognosis with different molecular groups were compared. Results Univariate analysis showed that age,maximum tumor diameter,KPS score, IDH mutation,TERT mutation,1p/19q codeletion, and number of chemotherapy cycles were correlated with GBM prognosis.Cox multivariate analysis showed that maximum tumor diameter, KPS score and TERT mutation were independent prognostic factors of GBM.TERT mutation was associated with lp/19q codeletion(P< 0.05).The group with only IDH mutations had the best prognosis,while the group with only TERT mutations had the worst prognosis (P<0.05).Conclusions Maximum tumor diameter,KPS score and TERT mutation were independent prognostic factors of GBM.TERT mutation,1p/19q codeletion and IDH mutation further refine the prognosis grouping of GBM.[Key words]Glioblastoma;T ERT;IDH胶质母细胞瘤(GBM)是最常见的原发中枢神经系统恶性肿瘤⑴,手术联合术后放疗及同步、辅助替莫g胺化疗是成人新诊断GBM的标准治疗方案,年龄、手术切除程度、肿瘤大小、KPS评分等是影响GBM预后的常见因素。
脑胶质瘤基因检测有何作用?脑胶质瘤有必要做基因检测吗?我们知道,脑胶质瘤是一种具体成因不明的原发性颅内肿瘤,目前已知的可能诱发脑胶质瘤的风险因素之一就是基因遗传。
有些人认为,既然已经诊断出了脑部胶质瘤,那么再做基因检测或是研究还有什么意义吗?根据现有研究,脑胶质瘤基因检测不止为肿瘤的分类带来新的方法,同时,根据肿瘤的分子病理分型,还可以更好地选择合适的治疗方案,综合评价放疗、化疗的效果以及预后。
基因检测与脑胶质瘤有何关系?1.基因与肿瘤分型新方法世界卫生组织提出了一种新的脑瘤分类方法,将组织学特征与分子数据结合起来,从而为肿瘤亚型提供更准确的定义。
根据这一新的脑肿瘤分类,所有弥漫性胶质瘤如果与星形胶质细胞或少树突胶质组织学有关,则可将其归为一类。
因此,在这一大类肿瘤中包括:WHOⅡ级弥漫性星形细胞瘤和WHOⅢ级间变性星形细胞瘤,其中大多数肿瘤显示IDH1和IDH2基因突变。
WHO IV级胶质母细胞瘤又分为IDH野生型(约90%的病例)与新生胶质母细胞瘤相对应,发生于老年患者;IDH突变型(约10%的病例)对应于继发性胶质母细胞瘤,起源于以前的低级别弥漫性胶质瘤,通常发生在年轻患者中,以及胶质母细胞瘤NOS;少突胶质瘤、间变性少突胶质瘤和间变性少突胶质瘤,则显示IDH基因家族突变和1p和19q的合并全臂缺失(1p/19q编码)。
2.基因对预后的影响15%的复发性肿瘤在高表达的基因水平上表现出高突变,11%的复发肿瘤含有LTB4基因突变,另外,拥有LTB4和IDH1野生型的胶质母细胞瘤预后不良。
3.基因检测对个性化治疗的积极意义脑胶质瘤基因检测有助于我们发现和选择可能有效的靶向药物。
基于目前基因与肿瘤分型之间的新关系,根据分子病理和组织病理的结果选择合适的化疗方案成为手术切除后一种重要的辅助治疗方式。
为使患者拥有更好的预后,为患者进行个性化的精准治疗是脑胶质瘤治疗的新方向,这就需要在肿瘤的分子遗传学方面进行充分的研究,而基因检测和病理分型正是为患者制定个性化综合治疗方案的重要前提。
WHO中枢神经系统肿瘤分类总结中枢神经系统肿瘤是一类严重的疾病,它们可以发生在脑、脊髓和周围神经系统中。
对于这些肿瘤的分类和管理,世界卫生组织(WHO)制定了一套全面的分类标准。
本文将深入探讨这些分类,并总结每种类型的特点、病因、发病率、临床表现、诊断方法和预后评估。
中枢神经系统肿瘤分类根据世界卫生组织的分类标准,中枢神经系统肿瘤主要分为以下几类:胶质瘤:这是最常见的脑肿瘤,可以分为低级别(如胶质母细胞瘤)和高级别(如间变性胶质瘤)两种类型。
这些肿瘤通常起源于神经胶质细胞,并且可能在脑的各个部位发生。
神经元和混合神经元-胶质肿瘤:这类肿瘤包括各种神经元和混合神经元-胶质成分的肿瘤,例如神经节细胞瘤、室管膜瘤等。
这些肿瘤通常发生在脑和脊髓的不同部位。
垂体腺瘤:垂体腺瘤起源于垂体腺,这是一种位于大脑底部的内分泌器官。
这类肿瘤可以分为多种类型,包括功能性肿瘤(如泌乳素瘤、生长激素瘤等)和非功能性肿瘤。
松果体肿瘤:松果体位于大脑的后上部,松果体肿瘤可以是恶性的也可以是良性的。
这类肿瘤通常比较罕见。
颅底肿瘤:颅底肿瘤可以发生在头骨和脑的交界处,包括良性和恶性肿瘤。
这类肿瘤通常需要多学科联合治疗。
临床表现和诊断中枢神经系统肿瘤的症状取决于肿瘤的类型和位置。
一些常见的症状包括头痛、视力障碍、感觉异常、运动障碍等。
对于这些症状,医生通常会进行一系列检查,例如CT、MRI等影像学检查,以及血液检查和病理活检等。
随着医疗技术的不断进步,越来越多的新技术和治疗方法被应用于中枢神经系统肿瘤的诊断和治疗中。
例如,免疫治疗和基因治疗等新型治疗方法已经在临床试验中显示出令人鼓舞的结果。
一些新的影像学技术也为医生提供了更准确的诊断工具。
预后评估对于中枢神经系统肿瘤的治疗,预后评估是至关重要的。
根据世界卫生组织的分类标准,不同类型的肿瘤具有不同的预后特点。
患者的年龄、身体状况和其他因素也会影响预后。
在预后评估中,医生通常会综合考虑患者的病情、肿瘤的分级和分子标记物等因素。
IDH基因突变与脑肿瘤病理生理机制研究脑肿瘤是指脑部组织内出现的异常增殖的细胞瘤。
它是神经系统最常见的恶性肿瘤之一,占恶性肿瘤的20%-25%。
在不同类型的脑肿瘤中,IDH基因突变已经被发现是一个非常重要的共同的分子遗传学变异。
因此,在了解IDH基因的突变和脑肿瘤病理生理机制之间的关系方面进行研究,有助于我们更好地了解脑肿瘤的发生发展机理,为治疗脑肿瘤提供更具感知性的策略并预测疾病的预后。
IDH基因的突变IDH基因指的是异柠檬酸脱氢酶基因,位于17q25.3,是人体细胞重要的代谢酶基因。
IDH基因特别重要的两种亚型是IDH1和IDH2。
IDH1 (Isocitrate Dehydrogenase 1)的推导产物是D-异丁酸红酮酸(D-2-HG),而IDH2 (Isocitrate Dehydrogenase 2)则不产生D-2-HG。
在2008年,Yan et al.首次发现了IDH的突变在胶质瘤患者的大部分病例中。
接下来的研究证实了IDH1基因漂变占所有胶质瘤的50%-90%。
同时,IDH1/2突变也被发现在其他脑肿瘤类型中,如畸胎瘤、少突胶质细胞瘤(ODG)和中线神经轴瘤(MNA)。
此外,IDH突变还被发现在口腔、甲状腺和前列腺癌中。
这表明IDH突变的分子遗传学变异并不是脑肿瘤特殊的,但对人体代谢功能产生的危害很特别。
IDH基因突变的生物学特征IDH基因突变在脑肿瘤中的频率极高,而且这些突变的特点是相似的:在IDH1及IDH2的活性位点中出现的R132H突变是最常见的突变类型。
对于脑肿瘤患者,在IDH1/2突变和IDH1/2野生型之间存在众多分子遗传学特征的差异。
突变型IDH基因可以通过生化途径将异戊二酸代谢产物α-酯酮羧酸转化为D-2-HG。
然而,在野生型IDH基因中,此代谢可能由另一种酸性异构酶(ACLY)完成。
D-2-HG也是突变IDH1/2引起的肿瘤干细胞分化阻滞的相关分子之一。
IDH基因突变和脑肿瘤病理生理机制之间的关系IDH突变在胶质瘤患者中的发生率是最高的。
IDH突变型胶质母细胞瘤胶质母细胞瘤(GBM)是颅脑常见的恶性胶质瘤,其在基因分子水平诊断上分两种,分为IDH野生型和IDH突变型,IDH突变即为为异柠檬酸脱氢酶突变,是在这种肿瘤中发现的最重要的遗传改变之一。
该文主要着重在IDH突变型胶质母细胞瘤的介绍。
IDH突变型胶质母细胞瘤(IDH突变型GBM)比IDH野生型GBM少得多,约占病例的5-10%。
IDH突变型GBM也被称为“继发性GBM”,因为它们几乎总是从低级IDH突变型星形细胞肿瘤发展而来,IDH突变型GBM在组织学上对应于WHO IV级。
病因学IDH突变是神经胶质瘤发生的早期事件,并且在从IDH突变的弥漫性和间变性星形细胞瘤发展为GBM的整个过程中一直持续存在。
TP53突变和ATRX 丢失很常见,但不存在EGFR扩增。
如果标准R132H免疫组织化学是IDH1阴性,建议使用下一代测序来检测非规范性IDH1或任何IDH2突变。
病理与IDH突变型和野生型弥漫性和间变性星形细胞瘤的外观相似,IDH突变型GBM通常看起来与IDH野生型肿瘤不同。
位置与IDH野生型GBM相比,IDH突变型GBM好发于额叶(图1),类似于WHO II级弥漫性星形细胞瘤的对好发部位的定位。
图1:IDH突变型GBM好发于额叶大体病理学IDH突变型GBM扩散扩散到大脑中,但有出血,而且中央坏死区域很大,因此通常没有IDH野生型GBM的特征。
微观特征除了某些例外,IDH突变型GBM的组织学特征类似于IDH野生型肿瘤的组织学特征。
伴发性坏死的频率较低;少突胶质瘤样成分的局灶性区域更为常见。
影像学IDH突变型GBM原发部位对额叶有独特的(但非排他性)偏爱。
通常存在明显的非增生区域,并且通常不存在典型的厚肿瘤外皮,该外皮围绕着以IDH 野生型GBM为特征的大中央坏死核(图2)。
例外情况很常见,因此仍然需要进行分子谱分析来确定诊断。
MRS可能会揭示一个在2.25 ppm处共振的2-HG 峰。