苯酚的化学性质
- 格式:ppt
- 大小:946.50 KB
- 文档页数:23

苯酚维基百科,自由的百科全书苯酚(化学式:C6H5OH,PhOH),又名石炭酸、羟基苯,是最简单的酚类有机物,一种弱酸。
常温下为一种无色晶体。
有毒。
苯酚是一种常见的化学品,是生产某些树脂、杀菌剂、防腐剂以及药物(如阿司匹林)的重要原料。
发现苯酚是德国化学家龙格(Runge F)于1834年在煤焦油中发现的,故又称石炭酸(Carbolic acid)。
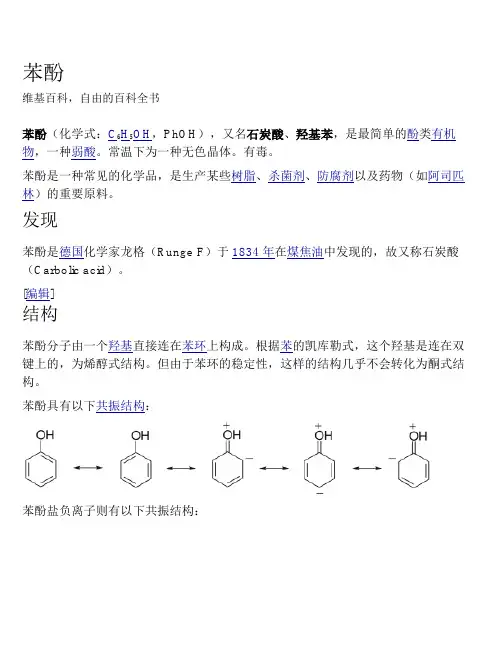
[编辑]结构苯酚分子由一个羟基直接连在苯环上构成。
根据苯的凯库勒式,这个羟基是连在双键上的,为烯醇式结构。
但由于苯环的稳定性,这样的结构几乎不会转化为酮式结构。
苯酚具有以下共振结构:苯酚盐负离子则有以下共振结构:酚羟基的氧原子采用sp2杂化,提供1对孤电子与苯环的6个碳原子共同形成离域键。
大Π键加强了烯醇的酸性,羟基的推电子效应又加强了O-H键的极性,因此苯酚中羟基的氢可以电离出来。
[编辑]物理性质苯酚熔点为40.5℃,沸点为181.7℃,常温下为一种无色或白色的晶体,有特殊气味。
苯酚密度比水大,微溶于冷水,可在水中形成白色混浊;但易溶于65℃以上的热水。
易溶于醇、醚等有机溶剂。
[编辑]化学性质酸碱反应苯酚是一种弱酸,能与碱反应:苯酚pKa=10,酸性介于碳酸两级电离之间,因此苯酚不能与NaHCO3等弱碱反应:此反应现象:二氧化碳通入后,溶液中出现白色混浊。
显色反应苯酚遇三氯化铁溶液显紫色,原因是苯酚根离子与Fe3+形成了有颜色的络合物。
(紫色)取代反应■苯环上的亲电取代:苯酚由于结构中有苯环,可以在环上发生类似苯的亲电取代反应,如硝化、卤代等:对比苯的相应反应可以发现,苯酚环上的取代比苯容易得多。
这是因为羟基有给电子效应,使苯环电子云密度增加。
值得注意的是,苯酚的亲电取代总是发生在羟基的邻位和对位。
这是羟基等给电子基团的共性。
■酚羟基上的取代:酚羟基上的氢原子可以被含碳基团取代,生成醚或酯。
氧化还原反应苯酚在空气中久置会变为粉红色,是因为生成了苯醌:苯酚的氧化产物一般是对苯醌。



苯酚【知识要点】一、苯酚的结构苯酚:分子式:C6H6O 结构简式:或C6H5OH二、物理性质无色晶体,有特殊气味,在空气中易被氧化而呈粉红色,熔点低,常温下在水中溶解度不大,加热时易溶(>65℃时任意比溶于水),易溶于乙醇等有机溶剂,有腐蚀性三、化学性质(一)、弱酸性(石炭酸)石炭酸酸性比碳酸弱,不能使酸碱指示剂变色酸性:H2CO3 > C6H5OH > HCO3-(二)、苯环上的取代反应(三)、显色反应(四)、加成反应四、用途:化工原料,制酚醛树脂、医药、染料等,稀溶液用作防腐剂和消毒剂。
【典型例题】例题1苯酚沾在皮肤上,正确的处理方法是().酒精洗涤 B.水洗 C.氢氧化钠溶液洗涤 D.溴水处理例题2下列有机物属于酚的是(). C6H5—CH2OH C HO—C6H4—CH3. C10H7—OH D C6H5—CH2CH2OH例题3除去苯中所含的苯酚,可采用的适宜方法是()A 加70℃以上的热水,分液 B. 加适量浓溴水,过滤C 加足量NaOH溶液,分液 D. 加适量FeCl3溶液,过滤例题4下列有机物不能与HCl直接反应的是()A苯 B.乙烯 C.丙醇 D.苯酚钠例题5为了把制得的苯酚从溴苯中分离出来,正确的操作是()A. 把混合物加热到70℃以上,用分液漏斗分液B. 加烧碱溶液振荡后分液,再向上层液体中加盐酸后分液C. 加烧碱溶液振荡后分液,再向上层液体中加食盐后分液D. 向混合物中加乙醇,充分振荡后分液例题6用一种试剂就能区分开苯酚、乙醇、NaOH溶液、AgNO3溶液、KSCN溶液这六种无色液体。
它是()A.水B.FeCl3溶液C.金属钠D.CuO例题7由C6H5—、C6H4—、—CH2—、—OH四种原子团共同组成属于酚类的物质,可得到的结构有()A.2种B.3种C.4种D.5种例题8能证明苯酚具有弱酸性的方法是()①苯酚溶液加热变澄清②苯酚浊液中加NaOH后,溶液变澄清,生成苯酚钠和水。

乙醇和苯酚的性质一、乙醇物理性质:无色,有特殊香味的液体,与任意比互溶,是很好的有机溶剂。
乙醇的结构分子式C2H6O,结构式CH3—CH2—OH,官能团为羟基—OH,其中的—OH活性大,反应能力强,能与很多物质发生反应。
二、化学性质1、与活泼金属发生反应(如钠)2C2H5OH+2Na→2C2H5ONa+H2↑C2H5ONa+H2O→C2H5OH+NaOH乙醇钠遇水分解生成乙醇和氢氧化钠PH试纸可检验溶液呈碱性。
2、乙醇的氧化反应(1)氧化反应:在空气或氧气中燃烧生成CO2和H2O;C2H5OH+3O2点燃2CO+3HO22(2)被氧化剂氧化,如:O2、KMnO4、K2Cr2O7等强氧化剂。
被三氧化铬或重铬酸钾氧化检查司机是否酒后开车。
K2Cr2O7Cr3+2CH3-CH2-OH+O2→2CH3CHO+2H2O加热Cu3、乙醇的脱水反应加入15mL浓硫酸与乙醇(体积比3:1)的混合溶液,加入沸石,迅速加热到170℃浓硫酸CH3CH2OHCH2=CH2+H2O1700C1、苯酚的物理性质:纯净的苯酚是无色晶体,有特殊气味常温时苯酚在水中的溶解度不大,当温度高于65℃时能跟水以任意比互溶苯酚易溶于酒精等有机溶剂中。
苯酚有毒,不慎沾到皮肤上,应立即用酒精洗涤。
2、苯酚的化学性质问题:分离苯酚经常采用分液而不用过滤,为什么?答:因为苯酚的熔点低,刚生成的苯酚一般以液态的形式存在,其密度比水大,常温下不溶于水,能和水分层,且分液比过滤更快捷方便。
课题方案设计:比较两者物理性质:请用规范的操作从气味上识别无水乙醇和苯酚水溶液。
比较结构:相同点:都具有—OH不同点:—OH所连的烃基不同实验一:乙醇、苯酚与金属钠的反应:内容:1mLC2H5OH(2mL乙醚)+小块钠现象:钠沉在液体底部,并产生细小的气泡结论:钠可与乙醇反应生成气体2C2H5OH+2Na→2C2H5ONa+H2↑C2H5ONa+H2O→C2H5OH+NaOH 内容:1.5gC6H5OH(2mL乙醚)+小块钠现象:钠浮在液面上四处游动,产生较多的气泡结论:钠可与苯酚反应生成气体2C6H5OH+2Na→2C6H5ONa+H2↑2、乙醇的氧化反应实验内容:3-5滴K2Cr2O7(1mL2mol/LH2SO4)滴入乙醇并振荡,微热现象:溶液从橙黄色变成绿色结论:乙醇还原了K2Cr2O4生成了Cr2(SO4)2注意事项:也可用KMnO4(H+)溶液,效果更加明显3、乙醇的脱水反应加入15mL浓硫酸与乙醇(体积比3:1)的混合溶液,加入沸石,迅速加热到170℃浓硫酸CH3CH2OHCH2=CH2+H2O1700C①将生成的气体通入溴水中②将生成的气体通入KMnO4(H+)溶液中观察现象实验现象:(1)烧瓶中溶液逐渐变成黑色(2)加热到170℃后产生大量气体,分别通入溴水、酸性KMnO4溶液中,两种溶液均迅速褪色实验结论:(1)乙醇在浓硫酸催化作用下,发生消去反应,生成气体乙烯(2)乙烯被酸性KMnO4溶液氧化而使之褪色(3)乙烯与溴水中的溴发生加成反应而使之褪色。

苯酚【知识点】1.苯酚的分子组成、结构及酚的概念。
2.苯酚的物理性质3.苯酚的化学性质【知识点讲解】一、苯酚的分子组成、结构及酚的概念①概念:羟基直接和苯环相连的化合物②分子组成为C6H6O;结构或写成C6H5OH说明:注意醇和酚的区别和联系,醇为羟基和链烃基直接相连;而酚则为羟基和苯环相连。
二者官能团一样,但烃基不同,性质不同。
二、苯酚的物理性质苯酚为无色有特殊气味的晶体,熔点43℃,常温下在水中溶解度不大,当温度高于65℃时能跟水以任意比互溶。
易溶于有机溶剂(乙醇、苯等)。
苯酚有毒,浓溶液对皮肤有强烈的腐蚀性。
说明:①如果不慎将苯酚沾到皮肤上,应立即用酒精洗涤。
②苯酚常因被空气中氧气氧化而显粉红色。
三、苯酚的化学性质1.弱酸性,苯酚中羟基上的氢氧键在反应中可断裂,在溶液中可发生微弱电离而表现弱酸性,因此称为石炭酸。
具体表现在a、和金属Na反应:b.和碱(NaOH)反应:说明:①苯酚的酸性非常弱,比碳酸的酸性还弱。
有反应:此反应生成物不能写成Na2CO3,因可以发生如下反应:上述两个反应都是复分解反应,根据强酸制弱酸的原理,可以归纳出如下酸性强弱顺序:因此苯酚电离式表示为②醇和苯酚具有相同官能团羟基,但醇不能电离出H+,而苯酚则表现出弱酸性,说明苯环使羟基活化。
2.取代反应(1)卤代反应苯酚可以与浓溴水发生反应:此反应中生成物为白色不溶于水的物质。
因此,此反应常用苯酚的定性检验或定量测定。
小结:在苯酚分子中,由于-OH的影响,使苯环活化,比苯易发生取代反应;由于苯环的影响,使-OH活化,比醇中-OH易电离出H+表现出弱酸性(2)硝化反应3.显色反应苯酚遇到FeCl3溶液显紫色,发生反应:6C6H5OH+Fe3+→ +6H+,此为特征反应,可以检验苯酚,反之检验Fe3+。
4.加成反应苯酚中含有苯环,在一定条件下可以和H2发生加成反应。
5.氧化反应:①易被空气中的氧气氧化而显粉红色。
②苯酚可以使酸性高锰酸钾溶液发生氧化还原反应而褪色。


苯酚的特性王晓波林东一中化学教研组,赤峰市,内蒙古,中国025450纯净的苯酚是无色晶体,暴露在空气中会因部分氧化而呈粉红色,苯酚具有特殊气味,熔点43℃。
苯酚易溶于乙醇等有机溶剂。
常温下,苯酚在水中的溶解度不大(9.3g),当温度高于65℃时,能与水混溶。
苯酚的化学性质很多,在苯酚的化学性质中,其弱酸性特别引人注目。
现就酚羟基的弱酸性讲予师生,以供参考和借鉴!在苯酚分子中,苯环影响了与其相连的羟基上的氢原子,使它比H2O分子更容易电离出H+,表现出一定的酸性。
同时在苯酚分子中,羟基影响了与其相连的苯基上的氢原子,使邻、对位的氢原子更活泼,更容易被其他原子或原子团所取代。
一、苯酚不是酸而是酚类物质苯酚俗称石炭酸,那么其溶液能否使指示剂变色?它属于哪一类物质?就此进行了几组对比试验。
苯酚具有酸性,C6H5OH C6H5O-+H+或OH+H2O O+H3O+_①配制1.0mol/L的苯酚水溶液,取一定量的苯酚溶液,加入适量的钠块,收集产生的气体。
经检验该气体是氢气。
其对应的化学方程式为:2C6H5OH+2Na→2C6H5ONa+H2↑②配制1.0mol/L的苯酚水溶液,取一定量的苯酚溶液,逐滴加入稀的氢氧化钠溶液。
液体变澄清,并产生热量。
其对应的化学方程式为:C6H5OH+NaOH→C6H5ONa+H2O③取适量纯净的苯酚晶体于试管中,微热使其熔化为溶液,滴入5滴石蕊试液,溶液颜色仍无变化。
④在苯酚的稀溶液中滴入FeCl3溶液,溶液立即变为紫色。
其对应的化学方程式为:C6H5OH+Fe3+→[Fe(C6H5O)6]3-+6H+⑤在苯酚的水溶液中逐滴加入2—5滴浓溴水,溶液出现白色沉淀。
其对应的化学方程式为:OH+3Br2BrOHBr+3HBr↓苯酚不能使指示剂变色,从而确定苯酚不是酸类物质,只是具有酸性。
它应该属于一类新物质,通过④⑤确定是酚类物质。
二、苯酚不与弱碱反应苯酚分子的溶液呈现出一定的酸性,向苯酚水溶液中分别加入浓氨水、氢氧化铜、氢氧化铁粉末,三组实验的溶液均无任何变化,且固体粉末基本不明显变化。
《选修5》第2章第2节醇和酚(第2课时酚)【学习目标】1、能描述出酚的物理性质。
2、能预测酚具有的化学性质,会用实验进行验证。
3、能用所学解决实际问题。
4、能说出苯酚的用途【重点难点】1、教学重点酚羟基的弱酸性、苯酚的取代反应。
2、教学难点羟基与苯环相互影响对苯酚性质的影响,以及与醇、苯性质比较的差异。
【教学过程】环节三:苯酚物理性质【演示实验】观察实验,总结实验现象色:无色态:晶体味:特殊的气味溶解性:易溶于乙醇有机溶剂,可溶于水,当温度高于65℃,与水混容。
培养学生的观察能力、分析总结能力【目标评价】在实验中,如不慎将苯酚洒到手上应如何处理()A、立即用冷水冲洗B、用70℃热水冲洗C、立即用酒精冲洗D、用NaOH 溶液洗涤学生思考回答检测学生对目标一的掌握情况环节三:目标二学习苯酚的化学性质【问】如何能消除苯酚对新安江水的污染?按照研究物质化学性质的一般步骤进行研究还需要知道化学性质明确研究物质化学性质的步骤培养学生正确的科学探究步骤分析结构:羟基、苯环预测性质(依据醇和苯及其同系物的性质进行预测)明确本次实验的目的:是否有酸性?(Na、NaOH溶液、Na2CO3溶液、NaHCO3溶液反应))苯环氢能否被溴代?根据实验目的选取三组实验:苯酚与氢氧化钠、苯酚与碳酸钠、苯酚与浓溴水回答醇及苯的性质,思考酚是否能发生相似的反应根据含羟基的醇和羧酸比较,考虑苯酚可能有酸性,根据苯的性质预测苯酚也易取代培养学生分析问题解决问题的能力。
同时引导学生进行科学的猜想【改进实验】苯酚和浓溴水为挥发性的有毒物质,从实验安全的角度出发,对仪器进行了改进,用针筒和单孔橡皮塞代替胶头滴管,减少有毒物质的散发观察改进后的实验装置,安全无味的进行实验培养学生的创新精神【分组实验】苯酚的酸性震荡没有反应前的试管使分层的苯酚溶液浑浊,缓缓推入反应试剂。
培养学生利用实验验证假设的科观察实验现象、产物,思考结论根据溶液澄清、无气泡的现象确定苯酚有弱酸性,比碳酸还弱。