杂环化学
- 格式:doc
- 大小:1.16 MB
- 文档页数:16


化学中的无机化合物与杂环化学化学中的无机化合物与有机化学合成两大分支,无机化学是研究元素及其化合物性质、合成和应用的学科,而有机化学则是研究碳-碳和碳-氢的化学键以及由它们构成的分子结构、性质和反应的学科。
其中,无机化学中的杂环化学分支是研究带有其他原子的环状化合物的合成、结构和反应等方面的学科,其与有机化学中的杂环化学有些类似,但区别也很明显。
无机化合物与杂环化学无机化合物是由元素组成的化合物,包括金属、非金属和有机金属物质。
对于化学家而言,无机化合物与杂环化学的研究是非常重要的。
杂环化学是一种特殊的无机化合物,其中环中至少有一个不是碳原子。
从历史上看,很长时间以来,人们一直认为无机化合物是缺少创造力和潜力的。
但是已经发现了许多有用的无机化合物,它们被应用在各个领域。
对于这些化合物的研究,我们需要对它们的结构、性质和反应进行综合的分析和研究。
人们对无机化学的研究由来已久,该领域的研究成果被运用在冶金、制药、农业、工业等各个领域。
杂环化学的发展杂环化学的发展始于19世纪的晚期,当时许多科学家关注使用碳以外的原子构建杂环状的分子。
这种能够合成新型的有机杂环化合物的方法,具有许多优点,例如高效率和反应柔性。
随着科学技术和研究方法的不断进步,杂环化学已经成为现代化学的重要部分。
杂环化学在制药、细胞生物学、生命科学和化学工业中有重要的应用价值。
无机化合物和杂环化学的应用无机化合物已经被广泛地应用在工业领域,如生产化肥、电子器件、陶瓷工业、建筑材料、化学冶金等。
杂环化学的应用也非常广泛,主要用于生产药品、染料、维生素、抗菌剂、抗癌剂、抗感染药物等。
其中,许多药品都含有杂环结构,如吗啡、咖啡因、华法林和维生素B12等。
结语无机化学和杂环化学是两个重要的化学分支,它们对各自领域的研究和应用做出了很大的贡献。
在未来,这两个分支的研究将继续发展,并给化学行业带来更多的创新和发展。

三员杂环链状醚、硫醚、仲胺比饱和三元杂环的健角小,因此有较大的张力。
三元杂环的构象都是平面形。
氢原子的重叠也是它们产生张力的一个原因。
饱和三元杂环的杂原子都有孤电子对,容易受亲电试剂进攻。
环有偶极矩,亲电试剂和亲核试剂都容易与它们反应。
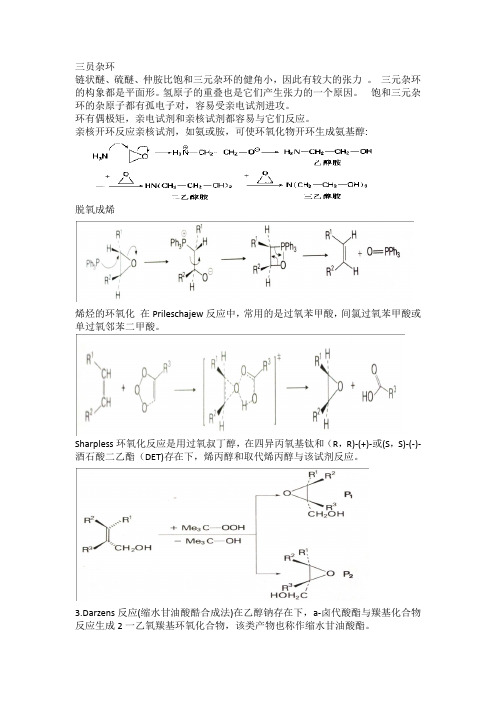
亲核开环反应亲核试剂,如氨或胺,可使环氧化物开环生成氨基醇:脱氧成烯烯烃的环氧化在Prileschajew反应中,常用的是过氧苯甲酸,间氯过氧苯甲酸或单过氧邻苯二甲酸。
Sharpless环氧化反应是用过氧叔丁醇,在四异丙氧基钛和(R,R)-(+)-或(S,S)-(-)-酒石酸二乙酯(DET)存在下,烯丙醇和取代烯丙醇与该试剂反应。
3.Darzens反应(缩水甘油酸酷合成法)在乙醇钠存在下,a-卤代酸酯与羰基化合物反应生成2一乙氧羰基环氧化合物,该类产物也称作缩水甘油酸酯。
Corey合成法该合成方法是由卤化三烷基锍盐或卤化三烷基亚砜盐衍生的S一叶立德与羰基化合物反应四员杂环1.β-氨基酸环化脱水制得【2+2】环加成反应(1)亚胺十烯酮.亲电取代反应呋喃发生亲电取代反应的速度要比苯快。
原因如下:①呋喃的共振能比苯低;②呋喃环上每个原子的电子密度大于1,而苯环上每个原子的 电子密度等于1。
1,4-二羰基化合物(Paal-Knorr反应)在酸碱平衡中,酸加到1,4-二羰基体系13中的一个羰基上,使第2个羰基能与其发生分子内亲核反应形成14;最后,在酸催化下,发生β-消除反应。
.Feist-Benary合成a-卤代羰基化合物和β-酮羧酸酯发生环缩合反应生成3-呋喃酸。
噻吩噻吩的芳香性小于苯大于呋喃,原因:①因为硫和氧相比有较低的电负性,硫上的电子对能更有效地共轭;②硫,作为第二短周期的元素,能够扩展其八隅体。
噻吩的亲电取代反应活性和苯甲醚相近。
反应机制与呋喃相同,取代反应发生在2-位或2,5-位。
光异构化反应最简单的方法是1,4-二碳基化合物硫化后再环化脱水,这和呋喃的Paal-Knorr合成类似。


第十二章 杂环化合物第一节杂环化合物:在环状化合物中,组成环的原子除碳原子外还有其他元素的原子时,称为杂环化合物。
一、 分类和命名 1. 分类:五元 含O环大小 六元 杂原子 含N稠杂环 含S2. 命名:按外文名词译音,并以口做偏旁,表示环状化合物。
例如:呋喃,读作“夫南”杂环编号:⑴ 单杂环编号时,总是以杂原子为”1”位.⑵ 环中有相同的原子则由带取代基的一个杂原子开始.(或从离取代基最近的一个杂原子开始.)⑶ 如果环中有两个或几个不同的杂原子,则按照O---S----N 的顺序编号. 例如:Ⅰ 五元环:N HOSNN HNN HNS呋喃 噻吩 吡咯 咪唑 吡唑 噻唑 五元环中含多个杂原子的,其中有一个为氮原子的叫做唑. Ⅱ 六元环:ON621345NN 621345N N621345吡喃 吡啶 咪啶 吡嗪Ⅲ 稠杂环N HN N N N HO11122233344455566677789吲哚 嘌呤 苯并吡喃NN N NNN11122233344455566677788喹啉 异喹啉 喋啶二、结构与芳香性:1. 呋喃:有芳香性。
2. 噻吩:有芳香性。
S::3. 吡咯:有芳香性。
N H::4. 吡啶:有芳香性。
NO::三、性质:(呋喃、噻吩、吡咯、吡啶)1.亲电取代反应:同芳环一样:可以发生卤代、硝化、磺化及傅氏反应。
呋喃、噻吩、吡咯等富电子杂环的亲电取代反应主要发生在α位,当两个α位被占时才可能进入β位;反应的活性比苯大。
吡啶等缺电子杂环的亲电取代反应主要发生在β位;反应的活性比苯小。
⑴卤代反应:O -0℃Cl2OCl+Cl Hα-氯代呋喃O 0℃BrHOBr+BrHα-溴代呋喃S CH COOHSBr+BrHα-溴代噻吩吡咯极易被卤代:N HNaOHNHIIII+I H2,3,4,5-四碘吡咯+I24 NH SO+Br2NBr+BrH~300℃β-溴代吡啶⑵硝化反应:硝化试剂-乙酰基硝酸酯(CH3COONO2)低温下反应。
phil baran 杂环化学讲义Phil Baran是一位著名的有机化学家,他的杂环化学讲义是有机化学领域的重要参考资料之一。
杂环化学是有机化学中的一个重要分支,研究的是含有杂原子(如氮、氧、硫等)的环状化合物的合成、性质和应用。
本文将介绍Phil Baran杂环化学讲义的主要内容。
一、杂环化学的基础知识杂环化学研究的是含有杂原子的环状化合物,这些杂环化合物在天然产物合成和药物研发中具有重要的地位。
在讲义中,Phil Baran 首先介绍了杂环化合物的命名规则和化学性质,包括环的大小、杂原子的位置和取代基的影响等。
二、杂环的合成方法杂环的合成是杂环化学的核心内容,也是有机合成的关键技术之一。
Phil Baran讲义系统地介绍了各种杂环的合成方法,包括常用的环化反应、氧化反应、还原反应等。
他还强调了绿色合成的重要性,提出了一些环境友好的合成方法。
三、杂环化合物的合成策略为了合成复杂的杂环化合物,研究人员需要制定合理的合成策略。
Phil Baran通过讲义详细介绍了一些合成策略,如串联反应、环内反应和环外反应等。
这些合成策略能够帮助研究人员高效地合成目标化合物。
四、杂环化合物的应用杂环化合物在药物研发、材料科学和农业等领域具有广泛的应用。
Phil Baran的讲义中列举了一些重要的应用案例,展示了杂环化学在解决现实问题中的潜力和价值。
他还介绍了一些热门领域,如抗肿瘤药物的开发和太阳能电池的制备等。
五、杂环化学的前沿研究杂环化学是一个活跃的研究领域,研究人员不断探索新的合成方法和应用。
Phil Baran的讲义中涵盖了一些前沿研究领域,如可见光催化、金属有机化学和电化学合成等。
这些新的研究方向为杂环化学的发展提供了新的思路和方法。
通过Phil Baran的杂环化学讲义,我们可以系统地学习和了解杂环化学的基础知识、合成方法、合成策略、应用和前沿研究。
这些知识不仅对于有机化学研究人员和化学工程师有重要意义,也对于其他相关领域的科学家和工程师具有参考价值。
化学反应一直以来都是化学领域研究的核心。
其中,杂环化学反应的研究尤为重要。
杂环化学反应是指在化学反应中涉及到嵌入有杂原子的环的过程。
杂环是指环中有一个或多个非碳原子,如氮、氧、硫等原子。
杂环化学反应的研究可以帮助我们了解杂环化合物的合成与性质,对药物、农药、材料科学等领域有着重要意义。
杂环化合物具有结构多样性和广泛的生物活性,对生命科学领域具有重要应用价值。
例如,吡啶、嘧啶、咪唑等杂环化合物是许多药物中常见的结构单元。
杂环化学反应的研究可以帮助我们合成出更多新的结构多样性的杂环化合物,从而寻找到更加有效的药物分子。
在杂环化学反应研究中,催化剂起着至关重要的作用。
催化剂可以加速反应速率,提高反应的选择性和收率。
近年来,金属催化剂在杂环化学反应中得到了广泛的应用。
例如,钯和铜催化剂在偶联反应中表现出了独特的催化性能。
此外,环加成反应也是杂环化学反应中的重要研究方向之一。
环加成反应是指通过两个或多个反应物之间的相互作用形成新的环状产物的反应。
通过环加成反应,可以构建出多种不同的杂环化合物。
在杂环化学反应研究中,还有一些常用的反应类型,例如酰胺合成和烯烃环化反应。
酰胺合成是指将胺和酸酐反应生成酰胺的过程。
酰胺化合物在生命科学领域有着广泛的应用,例如某些抗癌药物和抗生素就含有酰胺结构。
烯烃环化反应是指将烯烃转化为环状化合物的反应。
这种转化具有高度的化学活性,可以产生多种不同结构的杂环化合物。
此外,杂环化学反应的研究还涉及到机理的研究。
通过研究反应的中间体和过渡态,可以揭示反应的本质,从而提供了设计和优化反应的指导。
理解反应的机理有助于开发新的催化剂和反应方法,提高反应的效率和选择性。
总之,杂环化学反应的研究对于药物、农药、材料科学等领域具有重要意义。
通过杂环化学反应的研究,可以合成出多种结构多样性的杂环化合物,并揭示其合成机理,从而为相关领域的研究提供了基础和指导。
随着杂环化学反应的深入研究,相信将会有更多新的杂环化合物被合成出来,并在不同领域发挥重要作用。
杂环化学中的反应机理研究杂环化学是有机化学中一个非常重要的领域,一些常见的杂环包括吡咯、噻吩、吡唑和咪唑等。
在药物合成、自然产物杂环结构的合成等方面,杂环化学都扮演着不可替代的角色。
而在杂环化学的研究中,一个重要的方面就是反应机理的研究,这可以有效地引导杂环化学的研究方向,同时也有助于我们理解杂环化学中反应发生的本质。
杂环化学反应的机理可能因杂环的不同而异。
以吡咯为例,其特有的电子亲和性和共轭性质,使得它可以作为良好的亲电体或核磁体参与反应。
HDAC抑制剂Vorinostat的核心结构就包含一个吡咯环。
而在吡咯环的研究中,有一种重要的反应机理是电荷转移复合反应(CTC反应)。
电荷转移复合反应是指由两个反应物A和B中的一个基团从一个分子向另一个分子的空穴或离子缺陷转移。
在吡咯环的研究中,一个典型的例子是吡咯和三氟乙酸的反应。
当三氟乙酸与吡咯反应时,三氟乙酸中的羧基变得亲电,并以相向极性方式向吡咯环的孤对电子靠近。
随着原子之间的距离缩短,正电荷分布在吡咯的完整环上而不是在其缺失的孤对上。
随着两个分子的亲和性增强,它们的共价键可能断裂,并且电子转移到三氟乙酸上,产生吡咯阳离子中间体。
此中间体反应速度通常快于被称为Zwitterion形成的分子。
吡咯阳离子与无机盐合物的形成是吡咯参与酰基转移反应的重要基础,这类反应在有机合成中被广泛应用。
类似的,噻吩参与的反应机理也有其独特的特点。
噻吩是一种含有硫原子的五元杂环,它对各种化学反应都非常敏感。
噻吩在金属催化的氢化(H2)反应中被广泛应用,因其在牵涉到贵金属催化剂的反应中,其反应机理比较清楚。
金属催化剂可以降低反应的活化能,从而能够实现较低的反应温度。
以钯催化的氢化反应为例,其钯配位化合物和噻吩分子根据配位键相互作用并形成配合物,催化剂上的钯原子与噻吩分子中的硫原子有相互作用,有利于氢气分子的吸附。
通过这种方式,催化剂有助于降低反应的活化能,提高反应效率。
总的来说,反应机理的研究是杂环化学研究中不可缺少的一部分。
第二十章 杂环化合物 (Heterocyclic compounds)概述:杂环化合物:含有杂环的化合物,称为杂环化合物。
杂环:由碳原子和至少一个其它原子,如氧、硫、氮等组成的环。
杂环化合物来源、用途:有机化合物中约一半为杂环化合物。
许多杂环化合物存在于自然界中,并在生命体系中起着重要作用。
目前应用的药物中有很大一部分是杂环化合物。
此外,杂环化合物还用作杀虫剂、染料等。
杂环化合物分类:第一类:无芳香性的杂环化合物:OOOON HN H四氢呋喃 丁二酸酐 四氢吡咯 六氢吡啶例:第二类:具有一定程度的芳香性的杂环化合物:ONHN 呋喃 吡咯 吡啶例:一 分类和命名芳杂环的数目很多,可根据环大小、杂原子的多少以及单环和稠环来分类。
常见的杂环为五元、六元的单杂环及稠杂环。
稠杂环是由苯环及一个或多个单杂环绸合而成。
命名:采用外文名的音译,用带“口”字旁的同音汉字表示。
1 五元杂环Oβααβ12345S N Hfuran 呋喃噻吩吡咯thiophene pyrrole五元环中含两个或两个(至少有一个氮原子)以上的杂原子的体系称唑。
N H N 12345imidazole 咪唑N H N 12345pyrazole 吡唑S N 12345thiazole 噻唑O N 12345oxazole 噁唑 2 六元杂环N pyridine 吡啶N Npyrimidine 嘧啶NN pyridazine 哒嗪N Npyrazine 吡嗪3 稠杂环N15862347N 15862347N H 12345679N N N H 12345678quinoline 喹啉isoquinoline 异喹啉indole 吲哚purine 嘌呤二 吡咯、呋喃和噻吩 1 结构特点O 呋喃S噻吩N H吡咯平面结构 环上的原子均为sp 2杂化 闭环共轭体系 π电子数符合4m+2 具有芳香性Π56体系属于亲电取代反应活性:吡咯、呋喃、噻吩大于苯。
五元环亲电取代反应的主要产物:α-取代:XE+XEXEXEX EXE芳香性:苯>噻吩>吡咯>呋喃 2 性质 1). 吡咯N Ha. 吡咯的弱酸性它的pK a =16.5,比酚弱,比醇强,可与强碱(NaNH 2,KNH 2、RMgX )或金属作用。
NHKNH 2NH 3KN K N K吡咯钾H 2+NHC2H5MgBrN MgBrC2H6 +N HN K1. CO22. H3OCH3ICH3CClOCHCl3/KOHNHCOOHα-吡咯甲酸NCH3N-甲基吡咯△NHCH3NCOCH3N-乙酰基吡咯△NHCOCH3NHCHOα-吡咯甲醛b. 亲电取代反应主要产物为α-取代产物。
吡咯环的稳定性较差,遇酸容易聚合,因此进行亲电取代反应要用较温和的试剂。
例:磺化试剂:N SO3硝化试剂:CH3CONO2ON HNBSNHBr 吡啶SO3N HNHSO3H2-吡咯磺酸HNO3乙酐N H NHNO22-硝基吡咯N HN HAc2ODMF,POCl3NHCHO2-吡咯甲醛NHCCH3O2-乙酰基吡咯+N H C6H5N2 ClNHN N C6H5c. 加成反应+N HCH 2CHCO 2CH 3BF 3N HCH 2CH 2CO 2CH 32). 呋喃a. 亲电取代反应呋喃的稳定性较吡咯小,与亲电试剂往往得到加成产物,即使得到取代产物,也是由加成产物转化来的。
OBr 2,CS 2_50 ℃H BrHBr H BrBrH+HBrOBrb. 加成反应呋喃与亲双烯体迅速发生狄尔斯-阿德尔反应。
++OO OO25℃OO O OHH OHHOOOH 2 , NiOO HCl140℃, 0.4MPa Cl(CH 2)4ClNaCNNC(CH 2)4CN H 2OHOOC(CH2)4COOHH 2N(CH 2)4NH 2H 2,NI呋喃遇浓酸聚合,遇稀酸呋喃水解为二醛:(H +先与双键发生亲电加成,形成碳正离子,水进攻碳正离子形成质子化的半缩醛,进一步反应形成丁二醛。
)OHOHH H 2OOH H H OH 2O O HH 丁二醛OCH 3CH 3H 2O,H 2SO 4,HOAcCH 2CH 2C CCH 3CH 3OO2, 5-己二酮3). 噻吩a. 亲电取代反应SNBSSBrHNO 3, H 2SO 4S NO 2SH 2SO 4(95%)SSO 3H 应用:把粗苯中的噻吩除去。
SAc 2O, SnCl 4SCCH 3O DMF,POCl 3SCHOSSb. 加成反应++SOOO100℃高压SO O O H H H 2 , NiSCH 3CH 2CH 2CH 3H 2S3 合成a. 呋喃的工业制备C 5H 8O 4n聚戊糖H , H 2OHO CH CH OH C CH H OH HO HCHO戊糖3H 2OOCHOO CHOZnO-Cr 2O 3-MnO 2OAl 2O 3, NH 3A l 2O3, H2OON HAl 2O 3, NH 3Al 2O 3, H 2SSA l 2O 3, H2S A l 2O3, H2O400℃b. 取代吡咯、呋喃、噻吩的合成吡咯环的合成:①. Knorr (克诺耳)合成法:+CH 3COCH 3CH 2OOCC NH 2HCOCH 3CH 2COOCH 2CH 3HN HCOOCH 2CH 3CH 3CH 3CH 2OOCCH 3α-氨基酮β-二羰基化合物CH 3COCH 3CH 2OOCCH 2Na NO 2HOAcCH 3COCH 3CH 2OOCCH NOCH 3COCH 3CH 2OOCC NOHZn , HOAcCH 3COCH 3CH 2OOCC H 2NH②. Paal-Knorr (帕尔-克诺耳)合成法:+CH 2CH 2C CCH 3CH 3OONH 3△N HCH 3CH 32, 5-己二酮RNH 2CH 2CH 2C CCH 3CH 3OO+△N CH 3CH 3R③. Hantzsch (汉栖)合成法:+CH 3COCH 2CO 2Et RNH 2+CH 3C CHCO 2Et NHR CH C EtO 2CNHRH 3CClCH 2COCH 3N CH 3CH 3REtO 2C呋喃环和噻吩环的合成:CH 2CH 2CCH 2CO 2H CC 6H 5O O C 6H 6 , P 2O 5OCH 2CO 2HC 6H 5CH 2CH 2C CCH 3CH 3OOP 2S 5△SCH 3CH 34 吡咯、呋喃和噻吩的重要衍生物 1). 糠醛是一种无色液体,沸点162℃,在空气中易变黑。
是一种良好的溶剂。
它不含α-H ,性质类似于苯甲醛。
OCHO ++NaOHO CH 2OH OCOONaKCN OCHO醇溶液OCH COOH O+CH 3C OO2OCHO CH 3COONaOCH CH COOH2). 吲哚吲哚为白色结晶,熔点52.5℃。
具有极臭的气味,但纯粹的吲哚在极稀时有香味,可作香料。
可发生亲电取代反应,活性位置在第3位。
N HBr 2O O0℃N HBr3-溴吲哚C 6H 5CONO 2O0℃CH 3CN N HN HN H NO 23-硝基吲哚DMF, POCl 320-30℃N H CHO3-吲哚甲醛吡啶SO 3N HN H SO 3H3-吲哚磺酸含吲哚的生物碱广泛存在于植物中,如麦角碱、马钱子碱、利血平等。
N HCH 2COOHβ-吲哚乙酸(植物生长调节剂)N HCH 2CHCOOHNH 2色氨酸(蛋白质组分)N HCH 2CH 2NH 2HO5-羟基色胺(哺乳动物及人脑中思维活动的重要物质)吲哚环的合成:Fischer (费歇尔)吲哚合成法:将醛、酮、酮酸、酮酸酯或二酮的芳基取代腙在氯化锌、聚磷酸、三氟化硼等路易斯酸存在下加热。
N N CH 3HPPA 100℃N H 苯乙酮苯腙2-苯基吲哚N H N环己酮苯腙BF 3,CH 3CO 2H65℃N H 四氢咔唑机理:相当于联苯胺重排。
3). 卟啉环系化合物卟啉环系是由四个吡咯和四个次甲基交替相联组成的共轭体系。
卟啉环呈平面结构,环的中间空隙以共价键、配位键和不同的金属结合。
NH N N N H 231546781110913141512卟啉环NN NNCO 2HCO 2HFe血红素NH HN NNH H O O CO 2HCO 2H 胆红素 ⅨaN N NNCOO OCO 2MeMg 叶绿素 a三 含两个以上杂原子的五元杂环N HN SN ONN H N属吡咯系杂环咪唑 噻唑 噁唑 吡唑1 结构和性质 1). 弱碱性NH N新增加的一个氮原子上的孤电子对在环平面上,与环内的π电子不共轭,提供了接受质子的位置,因此吡咯系杂环的碱性都比吡咯强。
吡咯系杂环中除咪唑是中等强度的碱外,其它为弱碱,因为:N HN H+HN HNH H NHNHN HN的酸性大于N H为什么?咪唑分子间可形成氢键: NN HNN HNN H吡唑通过氢键可缔合成二聚体:N N H NN H2). 亲电取代反应吡咯系杂环的亲电取代反应活性小于吡咯、呋喃和噻吩。
N N HS N O N 吡唑 异噻唑 异噁唑N HNS NO N咪唑 噻唑 噁唑3). 环的生成(自学)四 吡啶1 结构和物理性质氮上有一对电子未参与共轭,易接受质子,具有碱性。
碱性:脂肪胺>吡啶>芳香胺吡啶是一个无色有恶臭的液体,与水及许多有机溶剂,如乙醇、乙醚等混溶,是良好的溶剂。
NN :sp 2杂化2 化学性质芳环亲电取代亲核取代氮上未成键电子对碱性亲核性 1). 吡啶环上氮的碱性及亲核性NHCl+N H Cl应用:OHCH 3CClO+NOCCH 3O2). 吡啶环上亲电取代反应与苯环比较吡啶环是缺电子的芳香杂环,性质类似于硝基苯,它不能进行傅氏烷基化和酰基化反应。
亲电取代位置在3-或5-位进行,为什么?NBr 2 , H 2SO 4(SO 3)130℃NBr3-溴吡啶265℃H 2SO 4(SO 3) , HgCl 2NNNSO 3H3-吡啶磺酸N NO 2300℃KNO 3 , H 2SO 4(SO 3)3-硝基吡啶NNH 220℃Br 2 , HOAcNNH 2Br3). 吡啶环上亲核取代反应吡啶环 2, 4, 6 位上的卤素容易被亲核试剂取代。
N Cl220℃NH 3 , ZnCl 2N NH 2NBr BrNH 3 , H 2O 160℃NBr NH 2NClNaOMe CH 3OHNOMe除吡啶环 2, 4, 6 位上的卤素容易被亲核试剂取代外,吡啶环2位上的负氢离子也能被取代。
NHNaNH 2NNHNaH 2++NNHNa+H 2ONNH 2NaOH+吡啶环上2位的负氢离子被亲核性极强的氨基负离子取代,同时有氢气放出,称齐齐巴宾(Chichibabin )反应。