乳腺导管原位癌
- 格式:ppt
- 大小:1.49 MB
- 文档页数:20

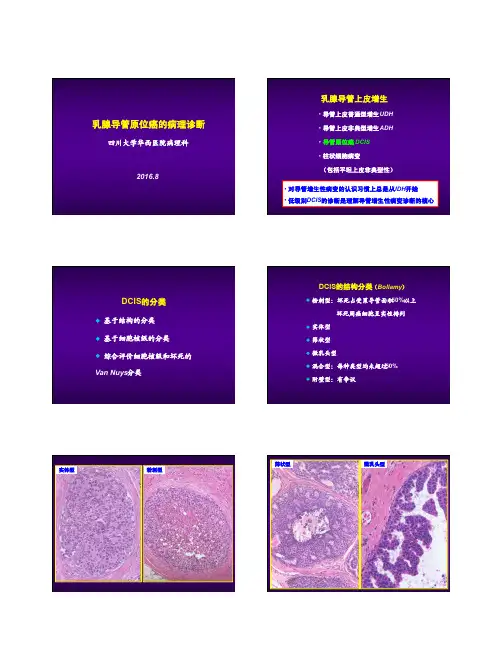
乳腺导管原位癌的病理诊断四川大学华西医院病理科2016.8乳腺导管上皮增生•导管上皮普通型增生UDH•导管上皮非典型增生ADH•导管原位癌DCIS•柱状细胞病变(包括平坦上皮非典型性)•对导管增生性病变的认识习惯上总是从UDH开始•低级别DCIS 的诊断是理解导管增生性病变诊断的核心DCIS的分类u 基于结构的分类u 基于细胞核级的分类u 综合评价细胞核级和坏死的Van Nuys 分类DCIS的结构分类(Bollamy)u粉刺型:坏死占受累导管面积50%以上坏死周癌细胞呈实性排列u实体型u筛状型u微乳头型u混合型:每种类型均未超过50%u 附壁型:有争议实体型粉刺型筛状型微乳头型所谓的“附壁型”2012 WHO:只有那些伴有高级别核改变的病变才能诊断为DCIS导管原位癌核级(低、中、高)Schnitt低级别DCIS的简要诊断标准u增生细胞纯化(特别是细胞核)u细胞分布较均匀u特征性的结构模式u病变往往累及多支导管低级别DCIS的结构模式u结构特点:1 筛状结构:细胞群内出现“冲凿”样圆形或椭圆形的腔隙,腔缘光滑、有张力、均匀分布2 微乳头:纺锤状(基底细,体部膨大)、量多体积大3 僵直的细胞搭桥、有张力的拱形结构4 实体结构:依赖对细胞形态的判断Tavassoli筛状结构有张力、均匀分布WHO纯化;细胞分布均匀WHO微乳头状结构WHO细胞纯化细胞纯化纺锤状Tavassoli僵直的细胞搭桥有张力的拱形结构WHO低级别DCIS诊断的量化标准u至少有两个导管完全受累(Page)u受累导管合计>2mm(Tavassoli )中等级别DCISu显示低核级,但部分导管含有坏死u 显示中等核级,坏死可有或无导管原位癌核级(低、中、高)Schnitt高级别DCISu核明显多形、极向紊乱、分布不均,核形不规则,染色质粗糙,核仁明显u核分裂常见,但不是诊断必需u呈单层、微乳头、筛状或实性u坏死常呈粉刺样,但并非必需u即使一个导管有典型形态学特点也足够诊断高级别核大汗腺型DCIS少见亚型u大汗腺型u梭形细胞型u印戒细胞型u透明细胞型u小细胞型u二态型u黏液型u鳞状细胞型u 囊性高分泌型梭形细胞型印戒细胞型透明细胞型二态型小细胞型p63黏液型囊性高分泌型鳞状细胞型如何报告“导管原位癌”• 核级(低、中、高)、坏死、钙化、组织学模式• 导管原位癌(高核级伴坏死、钙化,筛状、微乳头状结构)鉴别诊断UDH的简要诊断标准u 增生细胞间腔隙不规则,分布不均匀,多位于周边u 细胞核分布不均匀、有重叠(合体状)u 细胞形态多样,非纯化(杂)结构–细胞间腔隙WHO旺炽性增生florid hyperplasiaSchnitt 结构–细胞间腔隙结构 - 细胞间腔隙细胞 - 合体状Rosen细胞重叠、分界不清、合体状Schnitt细胞呈梭形,合体状Schnitt细胞呈梭形,流水状细胞形态多样,非纯化WHO 微乳头结构Schnitt细胞搭桥Schnitt TDLU内的UDHRosenUDH 伴有粉刺样坏死SchnittUDH 伴有坏死UDH 中有无肌上皮细胞成分?SMA calponinp63u 仅根据SMA 等肌上皮标记在导管增生性病灶中呈阴性表达就否定UDH 可能会导致误诊u UDH 偶尔表达p63Boecker ,J Pathol 2002绿色:SMA 红色:Ck8/18/19Note that the myoepithelial cells are not acomponent of the intraductal cell proliferation普通型增生Boecker :5 种细胞,即定向干细胞、腺中间细胞、腺上皮终端细胞、肌上皮中间细胞和肌上皮终端细胞仅表达高分子量CK ,如CK5/6仅表达CK8/18/19仅表达SMA 等表达CK5/6、CK8/18/19表达CK5/6、SMACK5/6UDH的增生细胞群确实含有多种成分,包括定向干细胞、腺中间细胞和腺终端细胞,但未发现具有肌上皮特点的细胞参与其中UDH ADHCK5/6DCIS DCISER染色UDH DCISWHO UDH DCIS UDHDCISADH 的传统诊断标准u 增生病灶出现低级别DCIS 的部分(不是全部)特征即可诊断ADH (不满足DCIS 定性标准)u 如果增生病灶具有低级别DCIS 的全部特征(包括细胞学和结构),只要不超过两个导管或大小不超过2mm ,也诊断ADH (不满足DCIS 定量标准)u 当诊断DCIS 有迟疑时则诊断ADHTavassoli :具有低级别DCIS 细胞学和结构特征的病变仅部分累及单个或多个导管非典型增生增生导管部分区域出现低核级DCIS 的特征Schnitt SchnittSchnitt• 变迁中的定量标准(ADH )- 1985 Page: < than 2 separate spaces (i.e., 1 space) - 1990 Tavassoli + Norris: < or = 2mm - 1998 Jensen and Page: 2-3mm - 2003 Page <4-5mm(2012 WHO :低级别DCIS 发生浸润性癌的时间间隔平均超过15年)• 多数情况下,是在TDLU受累以后使用• 仅测量形成充分的病灶• 病变导管呈纵切面时,不使用此标准SchnittSchnitt Koerner中等核级DCIS SchnittWHOADH是否存在分度(程度划分)?•完全受累(具有低核级DCIS特征),但范围小 - 重度•部分区域具有低核级DCIS特征,多病灶 - 中/重度•部分区域具有低核级DCIS特征,单病灶 - 轻/中度•导管内少数细胞具有纯化特征 - 轻度•如:borderline atypical d uctal hyperplasia / low-gradeductal carcinoma in situmarked ADH / severe ADH / extensive ADHfocal ADHRosen’ breast pathologySchnitt’ breast pathology2012 WHO易被误诊为浸润性癌的DCIS改变u DCIS的小叶癌化(lobular cancerization)u DCIS假浸润:纤维化导致DCIS形态不规则炎细胞浸润背景u DCIS出芽改变u DCIS累及腺病(硬化性、小管型、大汗腺型)和RS等u人工现象:如穿刺导致DCIS 细胞移位小叶癌化小叶癌化炎细胞浸润DCIS出芽改变貌似浸润癌的DCISHER2 DCIS假浸润DCIS假浸润DCIS假浸润DCIS累及腺病DCIS假浸润DCIS累及腺病穿刺导致DCIS细胞移位腺泡型浸润性小叶癌貌似DCIS 的癌栓特殊病例来自张祥盛老师女 38岁 左乳3cm肿物p63Calponin左腋窝淋巴结20/23、左侧锁骨下11/11有转移呈扩张性侵袭 / 膨胀性浸润的癌Bhargava, Dabbs缺乏肌上皮层的“DCIS”p63SMMHC病例p63ER ERPRPR病理诊断送检组织中查见癌,癌组织呈DCIS 形态,但部分肿瘤导管周围缺乏肌上皮层,不能排除其为呈膨胀性生长的浸润癌小 结• 乳腺DCIS 的病理诊断有章可循,但无绝对标准;诊断的主观性客观存在• 量化标准的运用• 基底型CK 的诊断价值• 真假浸润(包括DCIS 缺失肌上皮)致 谢u 华西医院病理科各位老师、同事!u 吴蕴 M.D. Anderson Cancer Center, USAu唐平 University of Rochester Medical Center, USA。

中国乳腺导管原位癌病理诊断共识(2022版)摘要乳腺导管原位癌具有独特的临床特征、组织形态学和分子特征。
本共识全面阐述了导管原位癌相关生物标志物的临床意义,旨在提高导管原位癌标本取材、病理评估以及相关检测的准确性和可重复性,从而促进导管原位癌病理报告内容的规范化,为临床治疗和预后评估提供可靠依据。
正文乳腺导管原位癌(ductaIcareinomainsitu,DCIS)是一种乳腺非浸润性上皮细胞恶性肿瘤,局限于导管-小叶系统,显示不同程度的结构异常和细胞核级。
在临床、影像、组织形态及基因改变上均具有异质性,有进展为浸润性癌的风险,但并非必然。
随着乳腺影像学检查的普及,DC1.S检出率明显增加,占所有新发乳腺癌的20%~25%°由于DC1.S生物学行为不一,给临床治疗带来挑战。
正确诊断DC1.S对于临床治疗方案的确定和患者预后的评估至关重要。
2016年中国乳腺原位癌诊疗共识专家组制定了《乳腺原位癌诊疗专家共识》,但目前还缺乏相应的中国乳腺DCIS病理诊断规范。
本共识由中华医学会病理学分会乳腺疾病学组、中国抗癌协会肿瘤病理专业委员会乳腺肿瘤学组和中国临床肿瘤学会肿瘤病理专家委员会组织编写,由病理医师和临床医师共同制定,涵盖DCIS标本取材、肿瘤生物标志物检测及病理诊断报告内容等各环节规范化操作要点,旨在使DC1.S的病理诊断更精准,为相关临床诊疗提供依据。
一、乳腺DCIS取材及切缘评估1.瘤床取材:手术科室应提供详细的临床病史和病理信息,包括病变解剖部位(左右侧及象限)、影像学检查结果、有无术前穿刺活检及病理诊断、有无乳腺癌病史和家族史等。
对于乳腺广泛切除或区段切除标本,外科医师应用缝合线或其他标志物作解剖学定位(如上、下、内、外侧)。
病理取材医师应涂染料标记切缘,并结合临床标记和影像学检查进行肿物定位,间隔5~10mm将整个标本平行切开,作好标记。
有条件的单位可对标本进行X线照相。
若病变区域的直径<5cm,建议全部取材;若病变区域的直径25cm,需间隔1Cm至少取材一块组织,有条件的单位尽可能更多取材。

不典型乳腺导管原位癌的X线表现导管原位癌(ductal carcinoma in-situ,DCIS)又称导管内癌,是非侵袭性乳腺癌的一种形式,有约30%-50%DCIS可发展为浸润癌。
而通过适当的治疗,DCIS又能获得很高的生存率,因此,DCIS的早期确诊是非常重要的。
DCIS以恶性钙化为最常见X线征象[1],而关于恶性钙化以外的表现报道很少。
本文回顾性分析27例经手术病理证实的DCIS,初步探讨不同于单纯恶性微钙化的钼靶X线表现。
1 材料与方法1.1 一般资料本组27例患者均为女性,平均年龄52.6岁,临床表现为乳房肿块或增厚感21例,溢液6例。
所有病例腋下淋巴结病理均阴性。
1.2 乳腺X线检查方法所有患者术前均行乳腺钼靶X线检查,常规摄取双乳侧斜位(mediolateraloblique,MLO)和轴位(craniocaudal,CC)。
根据乳腺内腺体组成的不同分成脂肪型、少量腺体型、多量腺体型和致密腺体型,对发现异常者从形态、边缘、密度等方面进行分析。
2 结果27例DCIS的钼靶表现为肿块者15例,占55.6%,同时伴钙化者4例;11例见于少量腺体型或脂肪型乳腺中;肿块高密度10例,等密度5例;边缘清晰3例,模糊11例,小分叶1例;形态为椭圆形4例,不规则形10例,分叶形1例。
非对称性致密影5例,占18.5%,均表现为无明显边缘的局限性密度增高影。
结构扭曲2例,占7.4%,多发生于多量腺体型乳腺,表现为乳腺结构紊乱,有局灶性收缩感,但无明显的肿块可见。
钼靶X线表现阴性5例,占18.5%,临床触及肿块4例,溢液1例,4例发生在致密或多量腺体型乳腺中,1例MRI表现为异常强化小结节和片状异常强化灶,4例由超声检查发现。
3 讨论早期诊断可以提高DCIS的生存率。
大多数DCIS通过钼靶X线检查是可以发现的,了解其钼靶X线表现,对诊断及确定准确的病变位置以获得病理结果显得非常重要。
在两个相互垂直的投照位置上均能见到的有一定轮廓的占位性病变。


一、概述乳腺癌导管癌是女性最常见的恶性肿瘤之一,占乳腺癌总数的70%以上。
导管癌起源于乳腺导管上皮细胞,分为导管原位癌和浸润性导管癌。
导管癌的治疗方案应根据患者的病情、年龄、身体状况等因素综合考虑,以下为乳腺癌导管癌的治疗方案。
二、治疗方案1. 早期导管癌(导管原位癌)(1)手术治疗:早期导管癌患者首选手术治疗,包括乳腺切除和乳房重建。
手术方式有全乳腺切除术、改良根治术和保乳手术。
(2)放射治疗:术后放疗是早期导管癌治疗的重要手段,可降低局部复发率。
放疗时间一般为术后4-6周。
(3)内分泌治疗:对于激素受体阳性的患者,内分泌治疗是重要的辅助治疗手段。
常用的内分泌药物有他莫昔芬、氟维司群、芳香化酶抑制剂等。
(4)化疗:早期导管癌患者化疗应用较少,仅在部分高危患者中考虑。
化疗药物有蒽环类药物、紫杉类药物等。
2. 浸润性导管癌(1)手术治疗:浸润性导管癌患者首选手术治疗,包括乳腺切除和乳房重建。
手术方式与早期导管癌相同。
(2)放射治疗:术后放疗是浸润性导管癌治疗的重要手段,可降低局部复发率。
放疗时间一般为术后4-6周。
(3)内分泌治疗:对于激素受体阳性的患者,内分泌治疗是重要的辅助治疗手段。
治疗方法与早期导管癌相同。
(4)化疗:浸润性导管癌患者化疗是重要的辅助治疗手段,可降低远处转移风险。
化疗方案应根据患者的病情、年龄、身体状况等因素综合考虑。
常用的化疗方案有CMF方案、CAF方案、FAC方案等。
(5)靶向治疗:针对HER2阳性的患者,靶向治疗是重要的辅助治疗手段。
常用的靶向药物有曲妥珠单抗、帕妥珠单抗等。
(6)免疫治疗:近年来,免疫治疗在乳腺癌治疗中逐渐受到关注。
针对PD-1/PD-L1通路的小分子抑制剂和抗体药物已取得一定疗效。
3. 复发或转移性导管癌(1)内分泌治疗:对于激素受体阳性的患者,内分泌治疗仍是重要的治疗手段。
(2)化疗:复发或转移性导管癌患者化疗是重要的治疗手段,可缓解症状、延长生存期。

乳腺导管癌能活多久时间导管癌简介乳腺导管癌,是一种常见的乳腺癌类型,起源于乳腺的导管系统。
乳腺导管癌通常进展较慢,大多数患者能够通过早期发现和治疗来延长生存期。
然而,患者的预后很大程度上取决于病程、癌症分型和治疗方法。
早期乳腺导管癌早期乳腺导管癌通常指没有侵犯淋巴结或其他组织的癌症。
对于早期乳腺导管癌的治疗,最常见的方法是手术切除肿瘤组织。
手术后,通常会进行辅助治疗,如放疗、化疗或内分泌治疗,以预防或控制病情的进展。
根据统计数据,早期乳腺导管癌的5年生存率通常在90%以上。
这意味着在接受标准治疗后,大多数早期患者可以存活至少5年以上。
然而,需要注意的是,这些数据只是统计结果,并不能代表个体患者的预后情况,因为许多其他因素也会影响患者的生存期。
晚期乳腺导管癌晚期乳腺导管癌是指已经侵犯了淋巴结或其他组织的癌症。
晚期患者的预后相对较差,但仍然有治疗的机会。
对于晚期乳腺导管癌的治疗,通常采用综合治疗的方式,包括手术切除、放疗、化疗和靶向治疗等。
个体化治疗方案的选择会根据患者的生理状况、病情严重程度、癌症分子表型等因素进行调整。
晚期乳腺导管癌的预后通常较早期患者差,但有些患者仍然可以通过治疗来延长生存期。
对于患者来说,积极配合治疗、保持良好的生活方式、接受心理支持都是至关重要的。
乳腺导管癌的复发即使患者接受了成功的治疗并且进入了缓解期,乳腺导管癌仍有可能复发。
复发的时间和形式会有很大的差异,有些患者在治疗后几个月内就出现复发,而有些则在多年后才复发。
乳腺导管癌的复发通常发生在原发肿瘤的周围组织或其他部位,如淋巴结、骨骼、肝脏、肺等。
复发对于患者的预后通常会产生重要的影响,因此对于复发的患者,及时进行评估和治疗非常重要。
乳腺导管癌的生存期预测预测乳腺导管癌患者的生存期是一项复杂的任务,涉及到多个因素的综合评估。
目前,医生通常会根据患者的年龄、性别、既往病史、癌症分期、分子表型等因素来进行生存期预测。
对于早期乳腺导管癌患者,一般认为预后较好,生存期通常在5年以上。


乳腺癌病理分型乳腺癌是女性最常见的恶性肿瘤之一,其病理分型对于治疗和预后的评估具有重要意义。
根据不同的组织学类型和病理特征,乳腺癌可以被分为多种不同的类型。
本文将详细介绍常见的乳腺癌病理分型。
一、浸润性导管癌(Invasive Ductal Carcinoma,IDC)浸润性导管癌是最常见的乳腺癌类型,占据了乳腺癌的大部分比例。
它起源于乳腺导管的上皮细胞,具有浸润性生长的特点。
该类型癌细胞可通过乳腺间质,沿导管向周围组织浸润,也可形成转移灶。
浸润性导管癌的组织学特征为肿块形状不规则,质地坚实,通常伴有乳头溢液或乳头凹陷。
肿瘤细胞结构具有多样性,细胞呈腺管状排列,核分裂活跃,核染色质深染,核器官明显,常伴有纤维化和淋巴管浸润。
二、浸润性小叶癌(Invasive Lobular Carcinoma,ILC)浸润性小叶癌是乳腺癌的次常见类型,占据了乳腺癌的10%至15%。
该类型乳腺癌起源于乳腺的小叶上皮细胞,具有向周围组织浸润的特点。
浸润性小叶癌的组织学特征为细胞排列呈单独散在的线状,呈羊群状,排列较为紧密,细胞间质较少。
肿瘤细胞结构相对均一,核小而规则,细胞间没有明显的粘附连接。
病灶周围乳腺组织的纤维化程度较轻,很少有炎症反应。
三、乳腺导管原位癌(Ductal Carcinoma In Situ,DCIS)乳腺导管原位癌是一种早期的非浸润性乳腺癌,癌细胞局限于乳腺导管内,尚未侵入乳腺间质。
乳腺导管原位癌往往是通过乳腺X线摄影或乳腺超声等检查发现的。
乳腺导管原位癌的组织学特征为癌细胞充填了乳腺导管腔,形成了腺管结构的扩张。
癌细胞排列有单列、多列和纵列等不同方式,核染色质较浓,核小而规则,细胞分裂常见。
四、乳腺纤维腺瘤样癌(Fibroadenoid Carcinoma)乳腺纤维腺瘤样癌是一种较为罕见的乳腺癌类型,组织学特征上具有纤维腺瘤和癌的混合特点。
该类型癌的生物学行为介于良性乳腺纤维腺瘤和恶性乳腺癌之间。


乳腺导管内原位癌临床特征及常用影像学检查诊断价值研究开题报告一、选题背景乳腺癌是女性最常见的恶性肿瘤之一,其发病率逐年增高,在临床上引起了广泛的关注。
乳腺癌的早期诊断和治疗对患者的生命质量和生存率有重要意义。
其中,乳腺导管内原位癌(DCIS)是一种早期乳腺癌,其特征为恶性细胞限于导管内生长,未侵犯基底膜,可以通过钼靶、乳腺X线摄影、乳腺超声、磁共振成像等影像学检查进行诊断。
然而,乳腺导管内癌不同于其他乳腺癌亚型,其临床表现、组织学类型和预后等均有差异,因此需要对其临床特征和常用影像学检查进行研究,以提高其诊断和治疗水平。
二、选题意义DCIS影响乳腺癌的生存和治疗选择,因此其早期诊断和治疗非常重要。
在临床实践中,乳腺影像学检查是DCIS诊断的重要手段之一,但其临床表现和组织学类型复杂多样,给诊断带来挑战。
因此,对DCIS的临床表现和常用影像学检查的诊断价值进行深入研究,有助于提高DCIS的早期诊断和治疗水平,对于改善患者的生命质量和延长生存期具有重要意义。
三、研究目的本文旨在探讨乳腺导管内原位癌的临床特征及常用影像学检查的诊断价值,为乳腺癌的早期诊断和治疗提供参考依据。
四、研究内容和方法本文将通过文献综述和病例分析的方式,就乳腺导管内原位癌的临床表现、病理学类型、发生率和预后等方面进行分析,总结常用的影像学检查方法,如钼靶、乳腺X线摄影、乳腺超声、磁共振成像等的优缺点及其诊断价值,并结合实例进行讨论和分析。
五、预期结果本文将系统地总结乳腺导管内原位癌的临床表现和组织学类型,并探讨常用影像学检查的诊断价值,以提高DCIS的早期诊断和治疗水平。
六、论文结构本文将分为引言、文献综述、病例分析、讨论和结论等几个部分。
其中,引言部分将介绍本文选题背景和意义,明确研究目的和内容。
文献综述将对乳腺导管内原位癌的临床特征和常用影像学检查的诊断价值进行全面的总结、归纳和分析。
病例分析将结合实例进行讨论和分析。
讨论将重点阐述乳腺导管内原位癌的诊断方法和诊断价值,并探讨其中存在的问题和不足。
乳腺癌的组织学分型和分子分型乳腺癌是女性最常见的癌症类型之一,它的组织学分型和分子分型是诊断和治疗该疾病的重要依据。
文章将从乳腺癌的组织学分型和分子分型两个方面进行探讨,以增加对该疾病的理解和认识。
一、乳腺癌的组织学分型乳腺癌的组织学分型是根据其组织学特征进行分类的。
根据不同的组织学类型,乳腺癌可分为以下几种类型:1.浸润性导管癌(IDC)浸润性导管癌是最常见的乳腺癌类型,占据乳腺癌的70-80%。
它起源于乳腺导管内的上皮细胞,其特征是癌细胞扩展至邻近的组织和淋巴结。
2.浸润性小叶癌(ILC)浸润性小叶癌是占据乳腺癌的10-15%的一种类型。
它源于乳腺小叶的上皮细胞,其特征是癌细胞渗透至乳腺小叶间的纤维组织。
3.乳腺导管原位癌(DCIS)乳腺导管原位癌是起源于乳腺导管内的非浸润性乳腺癌,占据乳腺癌的5-10%。
它的特征是癌细胞仅局限于导管内,没有侵犯周围组织。
4.浸润性乳腺癌伴高级别导管原位癌(IDC with high-grade DCIS)浸润性乳腺癌伴高级别导管原位癌是由浸润性导管癌和高级别导管原位癌同时存在的一种类型。
乳腺癌的组织学分型有助于医生评估癌症的发展程度和预后,并且为选择合适的治疗方法提供依据。
二、乳腺癌的分子分型乳腺癌的分子分型是根据癌细胞的基因表达谱进行分类的。
通过对乳腺癌组织样本进行分子生物学检测和分析,可以将乳腺癌分为以下几种分子分型:1.激素受体阳性(HR+)激素受体阳性乳腺癌是指癌细胞具有雌激素受体(ER)和/或孕激素受体(PR)的表达。
这种类型的乳腺癌对内分泌治疗(如荷尔蒙治疗)敏感。
2.人类表皮生长因子受体2阳性(HER2+)人类表皮生长因子受体2阳性乳腺癌是指癌细胞高表达人类表皮生长因子受体2(HER2)。
这种类型的乳腺癌对靶向治疗(如Trastuzumab)有效。
3.三阴性(Triple-negative)三阴性乳腺癌是指乳腺癌不表达ER、PR和HER2的一种类型。
乳腺导管癌可以不化疗吗文章目录*一、乳腺导管癌可以不化疗吗1. 乳腺导管癌可以不化疗吗2. 乳腺导管癌的症状3. 乳腺导管癌的原因*二、乳腺导管癌的治疗*三、乳腺导管癌的预防乳腺导管癌可以不化疗吗1、乳腺导管癌可以不化疗吗乳腺导管癌可以不化疗的。
乳腺导管癌分为微浸润导管癌和浸润性导管癌,属于原位癌的一种。
乳腺导管癌如果不及时治疗,就会发展为浸润性导管癌。
简单地说,原位癌的癌细胞都是局限在乳腺导管内,没有向外周扩散,也不会发生腋窝淋巴结癌转移。
因此,这类乳腺癌不需要化疗。
最常见的就是乳腺浸润性导管癌,占了所有乳腺癌的一半以上。
乳腺导管癌的化疗还要根据腋窝淋巴结是否有癌转移,可能简单地分为两种:一种有癌转移,哪怕只有一个淋巴结内见到癌细胞,这样的乳腺癌都需要化疗的;另一种是没有癌转移,这样的乳腺癌有可能不需要化疗,但还需要结合其他指标来最终判断化疗的必要性。
2、乳腺导管癌的症状肿块是部分乳腺导管癌患者的首发症状。
据临床观察,多数肿块位于外上象限,其次是内上及乳头乳晕区,下方较少。
乳腺疼痛常表现为乳腺刺痛、胀痛或隐痛,如癌周伴有乳腺囊性增生也可出现周期性疼痛。
局部皮肤凹陷,如同酒窝,称之为“酒窝征"。
另外肿瘤直接与皮肤粘连也可能造成此种情况。
酒窝征在乳腺癌较早时即可出现,在患侧手臂上下活动时更为明显。
同时还表现为腋窝淋巴结肿大,乳头凹陷等症状。
3、乳腺导管癌的原因遗传因素:患乳腺癌的妇女发生乳腺癌的危急性较无家族史者高2~3倍。
年龄因素:对一般人群而言,乳腺癌的发病率与死亡率的危急性随年龄的增大而增加,70岁乳腺癌的危急性是40岁的3倍,70岁乳腺癌的年死亡率是40岁的5倍。
乳腺疾病史:一些非增生性的乳腺良性疾病,如乳腺炎、乳腺导管扩张、乳腺囊肿及乳腺纤维瘤等,增加乳腺癌的风险大。
孕产史及哺乳史、月经初潮年龄早也是乳腺癌发病的原因。
乳腺导管癌的治疗1、单纯乳房切除术: 手术切除有肿瘤的整个乳房,同时或以后分开行腋窝部分淋巴结切除术。
乳腺导管内原位癌术中腋窝淋巴结清扫必要性探讨隋良芝【摘要】乳腺导管内原位癌(DCIS)手术中是否行淋巴结清扫一直是国内外争议的热点[1].由于DCIS局限于基底膜以内,未突破导管浸润间质或淋巴管血管等结构,因此其一般不会转移,但同时具有向浸润癌发展的趋势[2],故近年来关于DCIS的手术治疗过程中是否应行腋窝淋巴结清扫术争议较大.乳腺导管内原位癌伴微浸润( DCISM)介于原位癌和浸润癌之间,有浸润和远处转移的可能[3],手术中是否应行淋巴结清扫,国内外仍未达成一致.前哨淋巴结(( sentinel lymph node,SLN))活检可以较好地检测淋巴结转移情况[4],对DCISM的转移断有重要意义.本文就DCIS术中是否应行腋窝淋巴结清扫进行总结.【期刊名称】《湖北民族学院学报(医学版)》【年(卷),期】2011(028)004【总页数】3页(P50-52)【关键词】乳腺癌;导管内原位癌;导管内原位癌伴微浸润;腋窝淋巴结清扫【作者】隋良芝【作者单位】天津市津南区咸水沽医院妇产科天津300350【正文语种】中文【中图分类】R737.9乳腺导管内原位癌(DCIS)手术中是否行淋巴结清扫一直是国内外争议的热点[1]。
由于DCIS局限于基底膜以内,未突破导管浸润间质或淋巴管血管等结构,因此其一般不会转移,但同时具有向浸润癌发展的趋势[2],故近年来关于DCIS的手术治疗过程中是否应行腋窝淋巴结清扫术争议较大。
乳腺导管内原位癌伴微浸润(DCISM)介于原位癌和浸润癌之间,有浸润和远处转移的可能[3],手术中是否应行淋巴结清扫,国内外仍未达成一致。
前哨淋巴结((sentinel lymph node,SLN))活检可以较好地检测淋巴结转移情况[4],对DCISM的转移断有重要意义。
本文就DCIS术中是否应行腋窝淋巴结清扫进行总结。
1 DCIS与腋窝淋巴结清扫据美国肿瘤协会统计,美国每年约新增6万例DCIS,约占乳腺癌的五分之一。
乳腺导管原位癌的影像学表现及诊断价值
张文静;宋焕英
【期刊名称】《包头医学院学报》
【年(卷),期】2013(029)002
【摘要】乳腺导管原位癌(ductalcarcinomainsitu,DClS)也称导管内癌(intraductalcarcinoma),是指乳腺导管系统内恶性上皮细胞的增殖,在镜下其组织学特点是基底膜周围基质无浸润的迹象[1]。
近20多年来,随着乳腺X线摄影技术和其他影像技术的发展,能对微小癌变做到早期确诊,DCIS的发病率急剧上升。
【总页数】3页(P144-146)
【作者】张文静;宋焕英
【作者单位】包头医学院第一附属医院,内蒙古,包头,014010;包头医学院第一附属医院,内蒙古,包头,014010
【正文语种】中文
【相关文献】
1.乳腺导管原位癌的组织病理学特征及其与影像学表现的关系 [J], 唐小燕;付丽
2.乳腺导管原位癌的影像学表现及与病理分级的关系 [J], 姜婷婷;顾雅佳;彭卫军;尤超;刘芮;
3.不同类型乳腺导管原位癌常规超声及自动乳腺全容积成像的影像学表现分析 [J], 张丽; 包凌云; 戴超超; 许晓静; 颜红菊; 朱罗茜
4.乳腺导管原位癌的影像学表现及与病理分级的关系 [J], 姜婷婷;顾雅佳;彭卫军;
尤超;刘芮
5.MRI-DWI对单纯乳腺导管原位癌、浸润性导管癌的鉴别诊断价值 [J], 袁秀华;王刚;李德维
因版权原因,仅展示原文概要,查看原文内容请购买。
低级别导管原位癌原理低级别导管原位癌原理导管原位癌概述•导管原位癌是一种非常早期的乳腺癌类型,通常在乳腺内部的导管系统中出现。
•导管原位癌通常未向周围组织或其他部位扩散,是局部限制在乳腺内的乳腺癌。
•低级别导管原位癌是其中一种较为常见的亚型。
•了解低级别导管原位癌的原理对于乳腺癌的早期诊断和治疗非常重要。
低级别导管原位癌的细胞变化•低级别导管原位癌主要表现为乳腺导管内上皮细胞的异常增生和变异。
•细胞变化包括:细胞核增大、核分裂增多、细胞形态异常等。
•这些异常细胞可以填充导管腔,形成肿块。
•低级别导管原位癌细胞的异常程度较轻,不易侵犯周围组织。
低级别导管原位癌的发展过程1.阶段一:异常细胞开始在导管内生长,并形成肿块。
2.阶段二:异常细胞继续增殖,向导管腔内扩展。
3.阶段三:异常细胞侵入周围组织,但仍属于低级别癌。
4.阶段四:异常细胞继续增殖和分裂,并发展为高级别癌。
低级别导管原位癌的诊断与治疗•早期诊断是乳腺癌治疗的关键,包括定期乳腺检查、乳腺钼靶、乳腺超声、病理检查等。
•对于低级别导管原位癌,治疗方法主要包括手术切除、放疗、内分泌治疗等。
•手术切除是最常见的治疗方法,通常能够完全切除肿块。
•放疗可选择性地用于预防病变复发和转变为高级别癌。
•内分泌治疗常用于雌激素受体阳性的病例,通过调节激素水平来阻止癌细胞生长。
结论•低级别导管原位癌是早期乳腺癌的一种重要类型。
•了解低级别导管原位癌的细胞变化和发展过程,对于指导临床诊断和治疗非常重要。
•早期诊断和治疗可以显著提高患者的生存率和生活质量。