配合物理论
- 格式:pptx
- 大小:612.40 KB
- 文档页数:21



第3课时配合物理论简介一配位键1.配位键的概念是成键原子一方提供孤电子对,另一方提供空轨道形成的共价键,是一类特殊的共价键。
2.配位键表示方法:A→B,其中A是,B是。
如:NH4+3.配位键的形成条件①成键原子一方能提供孤电子对。
如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等。
①成键原子另一方能提供空轨道。
如H+、Al3+、B及过渡金属的原子或离子。
4.配位键的特点:配位键是σ键,特殊的共价键,同样具有饱和性和方向性。
一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
5.常见含配位键的物质:NH+4、H3O+、CO、AlO2-、[B(OH)4]-、H2SO4二配位化合物1.配合物的概念把与某些以结合形成的化合物称为配位化合物,简称配合物。
如[Cu(NH3)4]SO4、[Ag(NH3)2]OH、NH4Cl等均为配合物。
2.配合物的形成上述实验现象产生的原因主要是配离子的形成。
以配离子[Cu(NH3)4]2+为例,NH3分子中氮原子的孤电子对进入Cu2+的空轨道,Cu2+与NH3分子中的氮原子通过共用氮原子提供的孤电子对形成配位键。
配离子[Cu(NH3)4]2+可表示为3.配合物的组成配合物[Cu(NH3)4]SO4其组成如下图所示:(1)中心原子是提供空轨道接受孤电子对的原子。
中心原子一般都是带正电荷的阳离子(此时又叫中心离子),过渡金属离子最常见的有Fe3+、Ag+、Cu2+、Zn2+等。
(2)配体是提供孤电子对的阴离子或分子,如Cl-、NH3、H2O等。
配体中直接同中心原子配位的原子叫做配位原子。
配位原子必须是含有孤电子对的原子,如NH3中的N原子,H2O 中的O原子等。
(3)配位数是直接与中心原子形成的配位键的数目。
如[Fe(CN)6]4-中Fe2+的配位数为6。
形成配合物的条件形成配合物的中心原子(离子)必须存在空轨道,配体一般都存在着孤电子对。


第3课时配合物理论简介一、配位键1.概念:由一个原子单方面提供孤电子对,而另一个原子提供空轨道而形成的共价键,即“电子对给予-接受键”。
2.表示方法:配位键常用A→B表示,其中A是提供孤电子对的原子,叫给予体,B是接受孤电子对的原子,叫接受体。
如:H3O+的结构式为。
判断正误(1)任意两个原子都能形成配位键() (2)配位键和共价键没有本质区别()(3)形成配位键的条件是一方有空轨道,一方有孤电子对() (4)配位键是一种特殊的共价键()(5)共价键的形成条件是成键原子必须有未成对电子()答案(1)×(2)√(3)√(4)√(5)×应用体验1.Ag+、NH3、H2O、H+、Co3+、CO中能提供空轨道的是_________________;能提供孤电子对的是__________________。
答案Ag+、H+、Co3+NH3、H2O、CO2.以下微粒含配位键的是________________(填序号)。
①N2H+5②CH4 ③OH-④NH+4⑤Fe(CO)3 ⑥Fe(SCN)3 ⑦H3O+⑧[Ag(NH3)2]OH答案①④⑤⑥⑦⑧解析①氢离子提供空轨道,N2H4中氮原子提供孤电子对,所以能形成配位键,N2H+5含有配位键;②甲烷中碳原子满足8电子稳定结构,氢原子满足2电子稳定结构,无空轨道,无孤电子对,CH4不含有配位键;③OH-电子式为,无空轨道,OH-不含有配位键;④氨气分子中氮原子含有孤电子对,氢离子提供空轨道,可以形成配位键,NH+4含有配位键;⑤Fe(CO)3中Fe原子提供空轨道,CO提供孤电子对,可以形成配位键,故正确;⑥SCN-的电子式为,铁离子提供空轨道,硫原子提供孤电子对,Fe(SCN)3含有配位键;⑦H3O+中O提供孤电子对,H+提供空轨道,二者形成配位键,H3O+含有配位键;⑧Ag+有空轨道,NH3中的氮原子提供孤电子对,可以形成配位键,[Ag(NH3)2]OH 含有配位键。

一、实验目的1. 理解配合物的组成、结构及性质。
2. 掌握配位平衡、沉淀溶解平衡等基本概念。
3. 学习配合物生成的实验方法及观察现象。
4. 掌握溶度积常数的测定及应用。
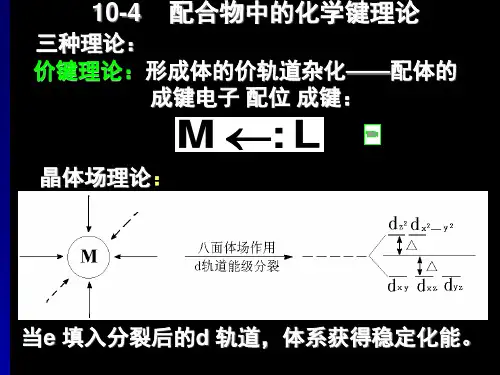
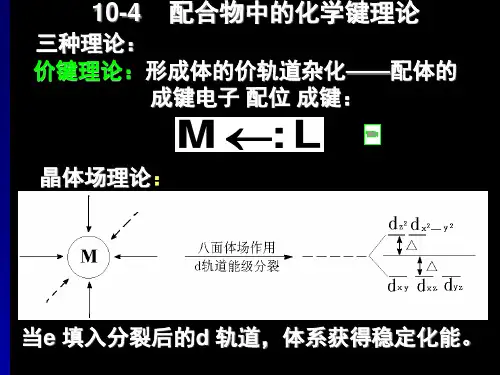
二、实验原理配合物是由中心离子(或原子)与一定数目的配体通过配位键结合而成的化合物。
配位键是一种特殊的共价键,其中一个原子提供一对孤电子,另一个原子提供空轨道。
配合物具有独特的性质,如颜色、溶解度、氧化还原性等。
1. 配位平衡:在一定条件下,中心离子与配体之间达到动态平衡,平衡常数称为稳定常数(Kf)。
2. 沉淀溶解平衡:在含有难溶电解质晶体的饱和溶液中,难溶电解质与溶液中相应离子间的多相离子平衡,平衡常数称为溶度积常数(Ksp)。
三、实验仪器与试剂1. 仪器:试管、滴管、烧杯、移液管、锥形瓶、pH计、电子天平、加热器等。
2. 试剂:氯化铜(CuCl2)、氨水(NH3·H2O)、硝酸银(AgNO3)、硫酸铜(CuSO4)、氢氧化钠(NaOH)、硫酸锌(ZnSO4)、氯化钠(NaCl)等。
四、实验步骤1. 配合物生成实验:(1)取一定量的CuCl2溶液于试管中,逐滴加入氨水,观察溶液颜色变化。
(2)继续加入氨水,观察沉淀的形成及溶解现象。
(3)观察配合物生成的颜色变化,记录实验结果。
2. 沉淀溶解平衡实验:(1)取一定量的AgNO3溶液于试管中,逐滴加入NaCl溶液,观察沉淀的形成。
(2)继续加入NaCl溶液,观察沉淀的溶解现象。
(3)记录沉淀溶解平衡时的现象,计算溶度积常数。
3. 溶度积常数测定:(1)取一定浓度的CuSO4溶液,加入过量的NaOH溶液,观察沉淀的形成。
(2)用pH计测定沉淀溶解平衡时的pH值。
(3)根据pH值计算Cu2+的浓度。
(4)根据Ksp的定义,计算溶度积常数。
五、实验结果与分析1. 配合物生成实验:实验过程中,CuCl2溶液逐渐由蓝色变为深蓝色,说明生成了[Cu(NH3)4]2+配合物。
继续加入氨水,沉淀溶解,说明配合物的稳定性较高。

第二单元分子结构与性质§2.2.3配合物理论(理科使用)【学习目标】1.知识与技能1. 了解配合物的组成、命名和某些性质。
2. 能说明简单配合物的成键情况【重点】配合物的基本概念和配位键的本质。
【难点】配合物和配位键第一学习时间自主预习案不看不讲【学习指导】1.、.先通读教材,勾画本课内容的基本知识点,完成教材助读设置的问题。
将预习中不能解决的问题填在“我的疑问”处。
2.、.发挥学生主体作用,按照思考、交流、观察、分析得出结论的方法进行学习【相关知识】1.配位键:由一个原子(如A)单方面提供而跟另一个原子(如B)的键叫做配位键,常用符号A B表示。
配位键的成键条件是:给予体有,接受体有。
2.配位化合物:通常把(或原子)与某些(称为配位体)以键结合形成的化合物称为配位化合物。
3.配合物的组成:在配合物[Co(NH3)6]Cl3中,中心离子是,配位体是,中心离子和配位体构成了配合物的,通常把它们放在括号内,内界中配位体总数称为。
Cl-称为,内外界之间形成了键,在水中电离。
4.配合物的命名:[Zn(NH3)2]SO4内界名称为(Ⅱ),K3[Fe(CN)6]内界名称为,[Zn(NH3)4]Cl2命名为,K3[Fe(CN)6]命名为,Cu(NH3)4]SO4命名为,[Ag(NH3)2]OH命名为。
K[Pt(NH3)Cl3] 读作。
1.配位键共享电子对由一个原子单方面提供而跟另一个原子共享的共价键叫做配位键。
(是一类特殊的共价键)如:NH+4的形成:NH3+H+ ====== NH+4氨分子的电子式是,氮原子上有对孤对电子。
当氨分子跟氢离子相作用时,氨分子中氮原子提供一对电子与氢原子共享,形成了配位键。
配位键也可以用A→B来表示,其中A是提供孤对电子的原子,叫做给予体;B是接受电子的原子,叫做接受体。
可见,配位键的成键条件是:。
[实验2-1]将下表中的少量固体溶于足量的水,观察实验现象并填写表格。