配合物理论简介(化学选修三)
- 格式:doc
- 大小:60.00 KB
- 文档页数:5





第3课时配合物理论简介一配位键1.配位键的概念是成键原子一方提供孤电子对,另一方提供空轨道形成的共价键,是一类特殊的共价键。
2.配位键表示方法:A→B,其中A是,B是。
如:NH4+3.配位键的形成条件①成键原子一方能提供孤电子对。
如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等。
①成键原子另一方能提供空轨道。
如H+、Al3+、B及过渡金属的原子或离子。
4.配位键的特点:配位键是σ键,特殊的共价键,同样具有饱和性和方向性。
一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
5.常见含配位键的物质:NH+4、H3O+、CO、AlO2-、[B(OH)4]-、H2SO4二配位化合物1.配合物的概念把与某些以结合形成的化合物称为配位化合物,简称配合物。
如[Cu(NH3)4]SO4、[Ag(NH3)2]OH、NH4Cl等均为配合物。
2.配合物的形成上述实验现象产生的原因主要是配离子的形成。
以配离子[Cu(NH3)4]2+为例,NH3分子中氮原子的孤电子对进入Cu2+的空轨道,Cu2+与NH3分子中的氮原子通过共用氮原子提供的孤电子对形成配位键。
配离子[Cu(NH3)4]2+可表示为3.配合物的组成配合物[Cu(NH3)4]SO4其组成如下图所示:(1)中心原子是提供空轨道接受孤电子对的原子。
中心原子一般都是带正电荷的阳离子(此时又叫中心离子),过渡金属离子最常见的有Fe3+、Ag+、Cu2+、Zn2+等。
(2)配体是提供孤电子对的阴离子或分子,如Cl-、NH3、H2O等。
配体中直接同中心原子配位的原子叫做配位原子。
配位原子必须是含有孤电子对的原子,如NH3中的N原子,H2O 中的O原子等。
(3)配位数是直接与中心原子形成的配位键的数目。
如[Fe(CN)6]4-中Fe2+的配位数为6。
形成配合物的条件形成配合物的中心原子(离子)必须存在空轨道,配体一般都存在着孤电子对。

新课标⾼中化学选修3第⼆节杂化轨道理论配合物理论第2课时杂化轨道理论配合物理论学业要求素养对接1.能运⽤杂化轨道理论解释和预测简单分⼦的⽴体构型。
2.知道配位键的特点,认识简单的配位化合物的成键特征,了解配位化合物的存在与应⽤。
微观探析:运⽤杂化轨道理论、配合物理论。
模型认知:根据杂化轨道理论确定简单分⼦的⽴体构型、根据配合物理论模型解释配合物的某些典型性质。
[知识梳理]⼀、杂化轨道理论简介1.⽤杂化轨道理论解释甲烷分⼦的形成在形成CH4分⼦时,碳原⼦的⼀个2s轨道和三个2p轨道发⽣混杂,形成四个能量相等的sp3杂化轨道。
四个sp3杂化轨道分别与四个H原⼦的1s轨道重叠成键形成CH4分⼦,所以四个C—H键是等同的。
可表⽰为C原⼦的杂化轨道2.杂化轨道的类型与分⼦⽴体构型的关系杂化类型sp sp2sp3参与杂化的原⼦轨道及数⽬n s 1 1 1 n p 1 2 3杂化轨道数⽬ 2 3 4 杂化轨道间的夹⾓180°120°109°28′杂化轨道⽰意图⽴体构型直线形平⾯三⾓形正四⾯体形实例BeCl2、CO2、CS2BCl3、BF3、BBr3CF4、SiCl4、SiH4【⾃主思考】1.⽤杂化轨道理论分析CH4的杂化类型和呈正四⾯体形的原因?提⽰在形成CH4分⼦时,碳原⼦的⼀个2s轨道与三个2p轨道混杂,形成4个能量相等的sp3杂化轨道,分别与四个氢原⼦的1s 轨道重叠成键形成CH4分⼦,4个σ键之间作⽤⼒相等,键⾓相等形成正四⾯体形。
⼆、配合物理论简介1.配位键(1)概念:共⽤电⼦对由⼀个原⼦单⽅⾯提供⽽跟另⼀个原⼦共⽤的共价键,即“电⼦对给予-接受键”,是⼀类特殊的共价键。
(2)实例:在四⽔合铜离⼦中,铜离⼦与⽔分⼦之间的化学键是由⽔分⼦提供孤电⼦对给予铜离⼦,铜离⼦接受⽔分⼦的孤电⼦对形成的。
(3)表⽰:配位键可以⽤A→B来表⽰,其中A是提供孤电⼦对的原⼦,叫做配体;B是接受电⼦对的原⼦。

第2课时杂化轨道理论配合物理论学业要求素养对接1.能运用杂化轨道理论解释和预测简单分子的立体构型。
2.知道配位键的特点,认识简单的配位化合物的成键特征,了解配位化合物的存在与应用。
微观探析:运用杂化轨道理论、配合物理论。
模型认知:根据杂化轨道理论确定简单分子的立体构型、根据配合物理论模型解释配合物的某些典型性质。
[知识梳理]一、杂化轨道理论简介1.用杂化轨道理论解释甲烷分子的形成在形成CH4分子时,碳原子的一个2s轨道和三个2p轨道发生混杂,形成四个能量相等的sp3杂化轨道。
四个sp3杂化轨道分别与四个H原子的1s轨道重叠成键形成CH4分子,所以四个C—H键是等同的。
可表示为C原子的杂化轨道2.杂化轨道的类型与分子立体构型的关系杂化类型sp sp2sp3参与杂化的原子轨道及数目n s 1 1 1 n p 1 2 3杂化轨道数目 2 3 4 杂化轨道间的夹角180°120°109°28′杂化轨道示意图立体构型直线形平面三角形正四面体形实例BeCl2、CO2、CS2BCl3、BF3、BBr3CF4、SiCl4、SiH4【自主思考】1.用杂化轨道理论分析CH4的杂化类型和呈正四面体形的原因?提示在形成CH4分子时,碳原子的一个2s轨道与三个2p轨道混杂,形成4个能量相等的sp3杂化轨道,分别与四个氢原子的1s轨道重叠成键形成CH4分子,4个σ键之间作用力相等,键角相等形成正四面体形。
二、配合物理论简介1.配位键(1)概念:共用电子对由一个原子单方面提供而跟另一个原子共用的共价键,即“电子对给予-接受键”,是一类特殊的共价键。
(2)实例:在四水合铜离子中,铜离子与水分子之间的化学键是由水分子提供孤电子对给予铜离子,铜离子接受水分子的孤电子对形成的。
(3)表示:配位键可以用A→B来表示,其中A是提供孤电子对的原子,叫做配体;B是接受电子对的原子。
例如:①NH+4中的配位键表示为。


实验:展示①CuSO4、②CuCl2·2H2O、③NaCl、④K2SO4固体的颜色,将它们溶于水,观察水溶液的颜色。
现象:CuSO4、CuCl2的溶液呈天蓝色,NaCl、K2SO4的溶液为无色。
思考:1)固态时,Cu2+、SO42-、Cl-呈什么颜色?
2)水溶液中,Cu2+、SO42-、Cl-呈什么颜色?
3)为什么Cu2+在固态时和水溶液中的颜色不同?
1、配位键:
(1)概念:共用电子对由一个原子单方向提供给另一原子共用所形成的共价键。
(2)表示: A → B
电子对给予体电子对接受体
(3)条件:其中一个原子必须提供孤对电子,另一原子必须有能接受孤对的原子轨道。
举例:H3O+ ()
NH4+()
2、配位化合物
(1)概念:金属离子或原子与某些分子或离子以配位键结合而形成的化合物称为配位化合物,简称配合物。
作为电子对接受体的金属离子或原子称为中心离子(原子),又称配合物的形成体,作为电子对给予体的分子或离子称为配体。
[Cu(H2O)4]2+的空间结构为平面正方形。
(2)配合物的结构
[Cu(NH3)4]SO4为例说明。
注意:离子型配合物是由内界和外界组成,内界由中心离子和配体组成。
(3)配合物的命名
例如:[Cu(NH3)4]SO4硫酸四氨合铜
练习:对下列配合物进行命名
[Cu(NH3)4]Cl2K3[Fe(SCN)6] Na3[AlF6]
3、几种常见的配合物
实验:硫酸四氨合铜的制备。
现象:向CuSO4溶液中加入氨水,生成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色溶液。
再加入乙醇,析出深蓝色的晶体。
有关反应的离子方程式为:
Cu2++2NH3·H2O=Cu(OH)2↓+2OH-
Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
蓝色沉淀深蓝色溶液
在[Cu(NH3)4]2+里,中心离子是Cu2+,配体是NH3,NH3分子的氮原子给出孤电子对,以配位键形成了[Cu(NH3)4]2+:
[Cu(NH3)4]2+的空间结构为平面正方形。
实验:硫氰化铁的制备。
向氯化铁溶液中滴加硫氰化钾溶液。
现象:形成血红色溶液。
有关反应的化学方程式为:
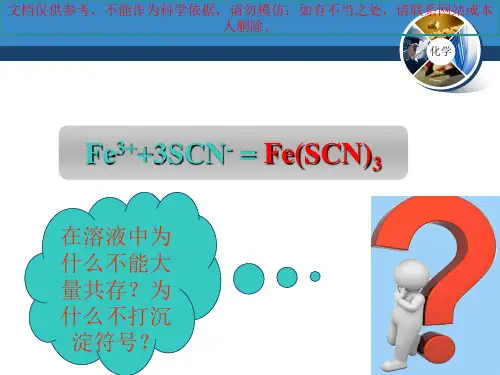
FeCl3+3KSCN=Fe(SCN)3+3KCl
Fe(SCN)3呈血红色,它是一种配合物。
上述实验可用于鉴定溶液中存在Fe3+。
呈血红色的是一系列配合物:Fe(SCN)2+、Fe(SCN)2+、Fe(SCN)3、Fe(SCN)4-、Fe(SCN)52-、Fe(SCN)63-,配位数从1~6。
注意:配位键的强度有大有小,因而有的配合物很稳定,有的不很稳定。
许多过渡金属离子对多种配体具有很强的结合力,因而,过渡金属配合物远比主族金属配合物多。
[随堂练习]
1.铵根离子中存在的化学键类型按离子键、共价键和配位键分类,应含有()
A.离子键和共价键B.离子键和配位键
C.配位键和共价键D.离子键
2.下列属于配合物的是()
A.NH4Cl B.Na2CO3·10H2O
C.CuSO4·5H2O D.Co(NH3)6Cl3
答案:CD
3.下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是()①H2O ②NH3③F-④CN-⑤CO
A.①②B.①②③
C.①②④D.①②③④⑤
答案:D
4.配合物在许多方面有着广泛的应用。
下列叙述不正确的是()
A.以Mg2+为中心的大环配合物叶绿素能催化光合作用
B.Fe2+的卟啉配合物是输送O2的血红素
C.[Ag(NH3)2]+是化学镀银的有效成分
D.向溶液中逐滴加入氨水,可除去硫酸锌溶液中的Cu2+
答案:D
5.下列微粒:①H3O+②NH4+③CH3COO-④NH3⑤CH4中含有配位键的是()A.①②B.①③
C.④⑤D.②④
答案:A
6.下列不属于配位化合物的是()
A.六氟和铝酸钠B.氢氧化二氨合银(银氨溶液)
C.六氰合铁酸钾D.十二水硫酸铝钾
7.指出配合物K2[Cu(CN)4]的配离子、中心离子、配位体、配位数及配位原子。
8.亚硝酸根NO2-作为配体,有两种方式。
其一是氮原子提供孤对电子与中心原子配位;另一是氧原子提供孤对电子与中心原子配位。
前者称为硝基,后者称为亚硝酸根。
[Co(NH3)5NO2]Cl2就有两种存在形式,试画出这两种形式的配离子的结构式。