元素与物质分类
- 格式:ppt
- 大小:2.23 MB
- 文档页数:7

2.1元素与物质分类考点1 元素与物质的关系1.根据元素组成对物质分类(1)元素具有相同核电荷数的一类原子的总称。
(2)元素组成物质元素――→组成⎩⎪⎨⎪⎧单质:同种元素组成的纯净物化合物:不同种元素组成的纯净物(3)纯净物与混合物①纯净物:由同种单质或化合物组成的物质。
②混合物:由几种不同的单质或化合物组成的物质。
③纯净物和混合物的区别纯净物 混合物 有固定的组成和结构 无固定的组成和结构 有一定的熔、沸点 无一定的熔、沸点 保持一种物质的性质保持原有物质各自的性质2.游离态与化合态元素以单质形式存在时,称为元素的游离态;元素以化合物形式存在时,称为元素的化合态。
3.“价-类”二维图主要表明氢化物、单质、氧化物、酸、碱、盐等类别的物质考点2 物质的分类与物质的性质1.酸性氧化物与碱性氧化物(1)酸性氧化物.(大多数非金属氧化物,如:SO2、SO3、CO2、Mn2O7)能与碱反应生成盐和水的氧化物叫酸性氧化物(注意只生成盐和水,不变价)。
注意:①酸性氧化物都能跟强碱反应,生成盐和水②大多数酸性氧化物能跟水化合生成酸(SiO2除外),不是全部。
③大多数酸性氧化物都可由非金属与O2化合生成点燃例如:①2NaOH + CO2 === Na2CO3 + H2O ②CO2 + H2O === H2CO3③C + O2CO2(2)碱性氧化物.(大多数金属氧化物,如:CaO、MgO、CuO、Fe2O3)能与酸反应生成盐和水的氧化物叫碱性氧化物。
CaO、Fe2O3等大多数金属氧化物都是碱性氧化物(3)两性氧化物.既能与碱反应生成盐又能与酸反应生成盐和水的氧化物叫两性氧化物。
如Al2O3。
【注意】正确理解几个“一定”“不一定”(1)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7为酸性氧化物。
(2)酸性氧化物不一定是非金属氧化物,如Mn2O7;非金属氧化物也不一定是酸性氧化物,如CO、NO。
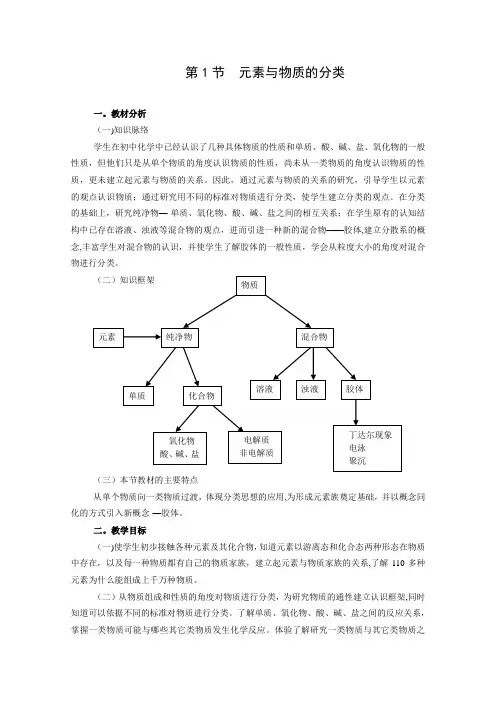
第1节 元素与物质的分类一。
教材分析 (一)知识脉络学生在初中化学中已经认识了几种具体物质的性质和单质、酸、碱、盐、氧化物的一般性质,但他们只是从单个物质的角度认识物质的性质,尚未从一类物质的角度认识物质的性质,更未建立起元素与物质的关系。
因此,通过元素与物质的关系的研究,引导学生以元素的观点认识物质;通过研究用不同的标准对物质进行分类,使学生建立分类的观点。
在分类的基础上,研究纯净物—-单质、氧化物、酸、碱、盐之间的相互关系;在学生原有的认知结构中已存在溶液、浊液等混合物的观点,进而引进一种新的混合物——胶体,建立分散系的概念,丰富学生对混合物的认识,并使学生了解胶体的一般性质,学会从粒度大小的角度对混合物进行分类。
(二)知识框架(三)本节教材的主要特点从单个物质向一类物质过渡,体现分类思想的应用,为形成元素族奠定基础,并以概念同化的方式引入新概念-—胶体。
二。
教学目标(一)使学生初步接触各种元素及其化合物,知道元素以游离态和化合态两种形态在物质中存在,以及每一种物质都有自己的物质家族,建立起元素与物质家族的关系,了解110多种元素为什么能组成上千万种物质。
(二)从物质组成和性质的角度对物质进行分类,为研究物质的通性建立认识框架,同时知道可以依据不同的标准对物质进行分类。
了解单质、氧化物、酸、碱、盐之间的反应关系,掌握一类物质可能与哪些其它类物质发生化学反应。
体验了解研究一类物质与其它类物质之物质元素纯净物混合物单质化合物溶液浊液胶体氧化物酸、碱、盐电解质非电解质丁达尔现象 电泳 聚沉间反应的关系的过程方法.(三)知道胶体是一种重要的分散系,了解胶体的丁达尔现象、电泳、聚沉等特性,能够列举生活中胶体的实例,了解胶体性质的简单应用.三.教学重点(一)知识与技能:元素与物质的关系;胶体的性质.(二)过程与方法:探讨各类物质的通性及其相互反应关系,学会如何以元素为核心认识物质,从多角度依据不同标准对物质进行分类并体验分类的重要意义。

第二章元素与物质世界第1节元素与物质的分类(第1课时)【学习目标】能运用元素的观点学习和认识物质,能从多种角度依据不同标准对物质进行分类。
能列举同种元素形成的不同物质,能从不同物种中抽取核心元素。
通过研究各类物质之间的反应关系,初步认识研究物质通性的思路和方法。
【重难点】理解酸、碱、盐、氧化物的概念及其相互联系【课前预习区】1、现有下列物质:①金属钠②氯气③氧化钠④次氯酸钙⑤二氧化碳⑥烧碱⑦纯碱⑧硫酸⑨氯水⑩过氧化钠以上物质中属于混合物的是(能用化学式表示的请写出化学式),单质,化合物,氧化物,酸,碱,盐。
2、元素在自然界的存在形态有几种?试说明金属钠、氯气、氧气、氧化钠、次氯酸钠等物质中元素的存在形态3、完成课本31页的(交流·研讨)【课堂互动区】一、元素与物质的关系【问题组一】1、物质都是如何组成的?从宏观和微观两个角度描述水的组成。
2、从组成上看,各类物质都具有怎样的特点?【规律总结1】1、物质都是由组成的。
2、元素可以形成单质也可以形成化合物,元素在物质中有两种存在形式:和。
3、同一种元素可以形成不同的单质,如,这些物质互称为同素异形体。
4、几种元素组成化合物时,有的只能形成一种化合物,有的则能组成几种不同的化合物。
由于元素可以按照一定的规律以不同的种类和不同的方式进行组合,因而110多种元素能够构成庞大繁杂的物质世界。
【课堂练习】1、标注下列各物质中各元素的化合价:Fe FeCl2HCl H2NaOH CaCO3CO2NaClO2、下列元素在自然界中既有游离态又有化合态存在的是()A. 氢B. 铜C. 碳D. 钠3、下列物质中,碳元素全部以游离态存在的是()A. 碳酸钙、石墨、二氧化碳B. 金刚石、石墨、C60C. 一氧化碳、金刚石、碳黑D. 碳酸氢钠、甲烷、金刚砂(SiC)【迁移应用】课本P32页①补充“省略号”中的物质(一类物质)。
②填写熟悉的化合物的化学式。
二、物质的分类1、分类方法【问题组一】1、列举初中所学物质分类方法,每种物质举出2-3个实例2、完成P34活动·探究【阅读整理】(1)根据在水溶液或熔融状态下能否导电:电解质:非电解质:(2)根据在化学反应中化合价变化的情况:氧化剂:还原剂:(3)根据被分散物质的颗粒大小,可将分散系分为:溶液、浊液和胶体2、根据物质类别研究物质性质【问题组二】1、列举酸碱盐的通性2、试分析金属和非金属分别具有哪些常见性质?3、酸性氧化物与碱性氧化物分别具有哪些性质?【规律总结3】用简图表示单质、酸、碱、盐、氧化物之间的关系【拓展视野】请在每一类物质后,写出1个实例【课堂练习】1、结合前面的学习,整理氯及其化合物的知识,完成下列问题。

《元素与物质分类》无机物与有机物在我们生活的这个丰富多彩的世界里,物质的种类繁多,令人眼花缭乱。
然而,通过科学的方法,我们可以对这些物质进行分类,从而更好地理解和研究它们。
其中,元素是构成物质的基本单位,而根据物质的组成和性质,又可以将其分为无机物和有机物两大类。
首先,让我们来了解一下什么是元素。
元素是具有相同质子数(即核电荷数)的一类原子的总称。
目前,人类已经发现了一百多种元素,它们组成了地球上的万物。
比如,我们熟悉的氧元素(O)、碳元素(C)、氢元素(H)等。
无机物,通常是指不含碳元素的化合物,但也包括一些简单的含碳化合物,如一氧化碳(CO)、二氧化碳(CO₂)、碳酸盐等。
无机物的种类繁多,涵盖了从常见的金属单质,如铁(Fe)、铜(Cu),到各种无机酸、碱、盐等化合物。
金属单质具有独特的性质,如良好的导电性、导热性和延展性。
以铁为例,它被广泛用于建筑、制造机械等领域。
而无机酸中的盐酸(HCl)和硫酸(H₂SO₄),在化工生产和实验室中经常被使用。
碱类物质如氢氧化钠(NaOH),是重要的化工原料。
盐类物质更是多种多样,氯化钠(NaCl)也就是我们日常食用的食盐,碳酸钙(CaCO₃)是大理石的主要成分。
相比之下,有机物则是含碳的化合物,但一些简单的含碳化合物,如上述提到的一氧化碳、二氧化碳和碳酸盐等除外。
有机物大多数是由碳、氢、氧等元素组成,少数还含有氮、硫、磷等元素。
有机物的种类极其丰富,从我们日常生活中的食物,如糖类、油脂、蛋白质,到各种塑料、橡胶、纤维等材料,再到药物、燃料等,都属于有机物的范畴。
糖类是为我们身体提供能量的重要物质,比如葡萄糖(C₆H₁₂O₆)。
油脂则不仅能提供能量,还在烹饪和工业中有广泛的用途。
蛋白质是构成生物体的重要成分,对于生命活动起着至关重要的作用。
在工业领域,塑料的出现极大地改变了我们的生活,聚乙烯、聚苯乙烯等各种塑料具有轻便、耐用等优点。
橡胶也有广泛的应用,从轮胎到橡胶手套。


选版知识点二元素与物质的分类一.元素与物质的关系:从本质上看,元素是物质的基本组成成分,物质都是由元素组成的;从数量上看,110多种元素组成了几千万种的物质。
二.元素的组成形式:(1)单质:相同一种元素自身组成的物质叫单质,有金属、非金属.(2)化合物:不同的元素之间组成的物质叫化合物。
①不同的元素之间可以形成不同的物质;②相同的元素之间可以形成不同的物质。
例如:O2和O3,CO和CO2三.元素的存在形态:(1)游离态:元素以自身形式结合成单质时的存在状态,此时的化合价为零价。
(2)化合态:元素与另外的元素之间结合成化合物时的存在状态,此时的化合价一般为正价或负价。
说明:同种元素在不同的化合物中可能呈现不同的价态。
例如CO中碳元素为+2价,但是CO2中碳元素为+4价。
四.物质分类的意义:物质的种类繁多、数量巨大,不可能逐一研究。
对物质进行科学分类,再分门别类地研究它们的结构、性质和用途,则容易找到有关规律,把握物质的本质属性和内在联系,来最大限度地服务于人类社会。
五.物质分类的方法:(1)按物质是否由同种物质(分子)组成,将物质分为纯净物和混合物。
由同种物质分子组成的物质叫纯净物;由不同物质的分子组成的物质叫混合物。
(2)按组成物质的元素的种类把纯净物分为单质和化合物。
(3)化合物的分类方法很多,如按化合物的性质分类,又把化合物分为酸、碱、盐、氧化物等;若按化合物在水溶液或在融化状态下是否导电,则可以分为电解质和非电解质;若按在化学反应中的表现,则分为氧化剂和还原剂。
(4)对于能与碱和酸反应的氧化物来说,又分为酸性氧化物和碱性氧化物。
能与碱反应生成盐和水的称为酸性氧化物,例如:CO2,SO2。
能与酸反应生成盐和水的氧化物称为碱性氧化物,例如:Na2O,CaO。
(5)按混合物中分散质粒子的直径大小可将混合物分类,分为溶液、胶体和浊液等。
6)总结:[思考题]:1. 只含有一种元素的物质一定是纯净物吗?2.盐一定含有金属元素吗?3.金属氧化物一定是碱性氧化物吗?碱性氧化物一定是金属氧化物吗?4.非金属氧化物一定是酸性氧化物吗?酸性氧化物一定是非金属氧化物吗?5.Na 2CO 3·10H 2O 、盐酸是混合物还是纯净物?例1:下列物质中属于纯净物、化合物、无机化合物、盐、钙盐的是( )A .石灰石B .Ca (OH )2C .CaCO 3D .CH 4解析:石灰石是混合物,主要成分是CaCO 3;Ca (OH )2是碱;CH 4是有机物。

【重点难点】重点:物质的分类及胶体的概念、性质。
难点:物质的分类,单质、氧化物、酸、碱和盐之间的相互关系。
【知识讲解】一、元素与物质的关系:1、元素组成物质:自然界中形形色色的物质都是由元素组成的,由元素组成的物质可能是单质,也可能是化合物。
2、元素在物质中的存在形态元素在物质中的存在形态有两种:游离态和化合态。
(1)游离态:元素以单质存在的形态。
例如:氧气中的氧元素就是以游离态存在。
(2)化合态:元素以化合物存在的形态。
例如:NaOH、Na2CO3中的氧元素就是以化合态存在。
元素的游离态、化合态可以相互转化,如O2与C反应生成CO或CO2,游离态的氧元素变成了化合态氧元素,又如KClO3加热制O2,化合态的氧元素又变成了游离态氧元素。
3、物质种类繁多的原因:(1)同种元素可形成不同的单质。
氧元素能形成O2、O3两种不同单质;碳元素形成金刚石、石墨、C60、C70等多种单质;磷元素能形白磷、红磷等单质。
(2)不同种类的元素形成不同种类的化合物。
大的方面可以分为氧化物、酸、碱、盐,而每种类别物质又可以再细分。
以后还要对物质进行详细分类。
(3)元素种类相同时,也可以组成不同的化合物。
如氮元素、氧元素可以组成N2O、NO、N2O3、NO2、N2O4、N2O5 等多种氧化物,主要就是氮元素的化合价不同,组成了不同种类的氧化物。
另外,有机物中还要出现同分异构体(分子式相同而结构不同的物质)。
以上这些原因都决定了元素种类虽然不多,但可以组成多种多样的物质。
二、物质的分类1、物质分类的方法依据不同的分类标准,可以对物质进行不同的分类。
例如:依据物质中所含物质种类的多少,可以把物质分为混合物和纯净物。
混合物是由两种或多种物质混合而成的物质,纯净物则是由一种物质组成的物质。
对于纯净物,依据所含元素种类的多少,可以划分为单质和化合物,由同种元素组成的纯净物叫单质,由不同种元素组成的纯净物叫化合物。
单质可以再分为金属单质、非金属单质、稀有气体单质。



元素与物质的分类教案第一章:物质的分类1.1 教学目标让学生了解和掌握物质的分类方法。
使学生理解纯净物和混合物的区别。
让学生掌握元素、化合物和物质之间的关系。
1.2 教学内容物质分类的基本概念:纯净物、混合物、元素、化合物。
物质分类的方法和原则。
物质分类的实际应用。
1.3 教学重点和难点物质分类的基本概念的理解和应用。
物质分类方法的掌握。
物质分类原则的理解。
1.4 教学方法和手段采用讲授法,讲解物质分类的基本概念、方法和原则。
使用案例分析法,分析物质分类的实际应用。
使用多媒体手段,展示物质分类的图像和实例。
1.5 教学步骤引入物质分类的概念,讲解纯净物和混合物的区别。
讲解元素的定义和特点,介绍元素周期表。
讲解化合物的定义和特点,介绍化合物的组成和性质。
通过实例分析,展示物质分类的方法和原则的应用。
总结物质分类的知识点,进行复习和巩固。
第二章:元素的概念和特点2.1 教学目标让学生了解和掌握元素的概念和特点。
使学生能够识别和记忆元素的符号和名称。
让学生了解元素在物质中的存在和作用。
2.2 教学内容元素的概念和定义。
元素的特点和性质。
元素周期表的结构和应用。
2.3 教学重点和难点元素的概念和特点的理解和应用。
元素符号的记忆和识别。
元素周期表的结构和应用的理解。
2.4 教学方法和手段采用讲授法,讲解元素的概念和特点。
使用案例分析法,分析元素的存在和作用。
使用多媒体手段,展示元素周期表的图像和实例。
2.5 教学步骤引入元素的概念,讲解元素的定义和特点。
讲解元素符号的表示方法,进行符号的记忆和识别练习。
介绍元素周期表的结构和应用,讲解周期表的排列规律。
通过实例分析,展示元素的存在和作用。
总结元素的知识点,进行复习和巩固。
第三章:化合物的组成和性质3.1 教学目标让学生了解和掌握化合物的组成和性质。
使学生能够识别和记忆化合物的名称和化学式。
让学生了解化合物在物质中的存在和作用。
3.2 教学内容化合物的组成和定义。

第二章元素与物质世界第一节元素与物质分类第1课时元素与物质的关系物质分类与物质性质1.了解各种元素及其化合物,知道元素有游离态和化合态两种形态。
2.了解单质、氧化物、酸、碱、盐之间的转化关系。
3.通过实验探究,理解并体验研究一类物质性质的方法,掌握各类物质的一般性质。
4.根据物质类别和元素价态构建元素的物质家族,建立起元素与物质家族的关系。
重点:物质的分类。
难点:物质的转化。
一、元素与物质的关系1.元素与物质的关系2.元素的存在形态(1)存在形态(2)元素的化合价①金属元素只有0价和正价,非金属元素一般有0价、负价和正价①在不同的化合物中同一元素的化合价可以相同,也可以不相同。
①在化合物中各元素的化合价的代数和等于0。
单质中元素的化合价为0。
【易错提醒】(1)单质一定是由同一种元素组成的物质,由同一种元素组成的物质不一定是单质。
(2)化合物一定是由不同种元素组成的纯净物,但纯净物不一定是化合物。
(3)纯净物是由一种成分(分子)组成的物质,有化学式,有固定熔、沸点。
(4)混合物是由多种成分(分子)组成的物质,无化学式,无固定熔、沸点。
二、物质分类与物质性质1.根据物质组成分类2.根据物质的性质分类3.其他分类方法【易错提醒】物质分类时应注意的事项:(1)纯碱叫碱不是碱。
纯碱是Na2CO3的俗名,它是一种盐,不属于碱类。
(2)能电离出H+的不一定是酸,如NaHSO4能电离出H+,同时电离出的阳离子还有Na+,它是一种酸式盐。
(3)酸性氧化物不一定是非金属氧化物,如Mn2O7是一种酸性氧化物;非金属氧化物也不一定是酸性氧化物,如CO、NO等属于不成盐氧化物。
(4)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7属于酸性氧化物,Al2O3属于两性氧化物。
三、金属单质、酸、碱、盐的化学通性及转化 1、单质、酸、碱、盐的化学通性 (1)一般金属单质的化学通性(2)酸的化学通性(3)碱的化学通性(4)盐的化学通性2、不同类别的无机物之间转化的一般规律 (1)金属单质及其化合物的转化金属单质――→O 2碱性氧化物――→H 2O碱――→酸盐 如:Na――→O 2Na 2O ――→H 2ONaOH ――→H 2SO 4Na 2SO 4符合上述转化关系的常见金属有Na 、K 、Ca 、Ba 等,但Mg 、Fe 、Al 、Cu 等不符合上述转化关系。
第1节元素与物质的分类一.教材分析(一)知识脉络学生在初中化学中已经认识了几种具体物质的性质和单质、酸、碱、盐、氧化物的一般性质,但他们只是从单个物质的角度认识物质的性质,尚未从一类物质的角度认识物质的性质,更未建立起元素与物质的关系。
因此,通过元素与物质的关系的研究,引导学生以元素的观点认识物质;通过研究用不同的标准对物质进行分类,使学生建立分类的观点。
在分类的基础上,研究纯净物——单质、氧化物、酸、碱、盐之间的相互关系;在学生原有的认知结构中已存在溶液、浊液等混合物的观点,进而引进一种新的混合物——胶体,建立分散系的概念,丰富学生对混合物的认识,并使学生了解胶体的一般性质,学会从粒度大小的角度对混合物进行分类。
概念三.教学重点(一)知识与技能:元素与物质的关系;胶体的性质。
(二)过程与方法:探讨各类物质的通性及其相互反应关系,学会如何以元素为核心认识物质,从多角度依据不同标准对物质进行分类并体验分类的重要意义。
(三)情感态度与价值观:体会分类的重要意义,依据不同的标准对物质进行分类;让学生树立运用化学知识,使自己生活得更健康。
四.教学准备(一)学生准备要求学生复习初中化学中单质、氧化物、酸、碱、盐之间的关系,复习第一章第二节研究物质性质的方法和程序,为学习本节教材做准备。
(二)教师准备教学媒体及课件;概念图;实验探究的药品及仪器。
第1课时【板书】第1节元素与物质的分类【板书】一.元素与物质的分类1.联想·质疑(提出..)..本节教材的核心问题(1)110多种元素是如何构成几千万种物质的?(2)为了更好地研究物质的性质和用途,应怎样对物质进行分类?用什么样的标准分类? (3)各类物质之间具有怎样的关系?2.交流·研讨(引发学生对于物质与元素之间的已有认识。
通过对熟悉物质....的组成元素的分析,逐渐建立起元素与物质的关系。
)【问题1】(P 30)找出组成元素;由已找出的元素重新组合成新的物质。