元素与物质的分类(三段)
- 格式:doc
- 大小:28.50 KB
- 文档页数:4
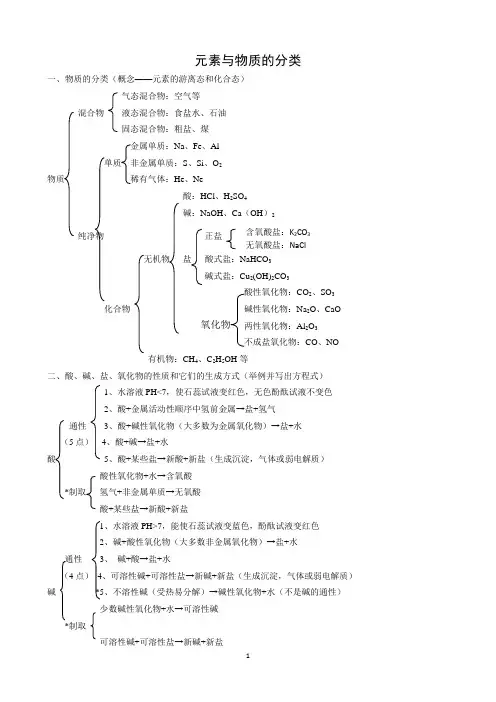
含氧酸盐:K2CO3 无氧酸盐:NaCl元素与物质的分类一、物质的分类(概念——元素的游离态和化合态)气态混合物:空气等混合物液态混合物:食盐水、石油固态混合物:粗盐、煤金属单质:Na、Fe、Al单质非金属单质:S、Si、O2物质稀有气体:He、Ne酸:HCl、H2SO4碱:NaOH、Ca(OH)2纯净物正盐无机物盐酸式盐:NaHCO3碱式盐:Cu2(OH)2CO3CO2、SO3化合物Na2O、CaOAl2O3CO、NO有机物:CH4、C2H5OH等二、酸、碱、盐、氧化物的性质和它们的生成方式(举例并写出方程式)1、水溶液PH<7,使石蕊试液变红色,无色酚酞试液不变色2、酸+金属活动性顺序中氢前金属→盐+氢气通性3、酸+碱性氧化物(大多数为金属氧化物)→盐+水(5点)4、酸+碱→盐+水酸5、酸+某些盐→新酸+新盐(生成沉淀,气体或弱电解质)酸性氧化物+水→含氧酸*制取氢气+非金属单质→无氧酸酸+某些盐→新酸+新盐1、水溶液PH>7,能使石蕊试液变蓝色,酚酞试液变红色2、碱+酸性氧化物(大多数非金属氧化物)→盐+水通性3、碱+酸→盐+水(4点)4、可溶性碱+可溶性盐→新碱+新盐(生成沉淀,气体或弱电解质)碱*5、不溶性碱(受热易分解)→碱性氧化物+水(不是碱的通性)少数碱性氧化物+水→可溶性碱*制取可溶性碱+可溶性盐→新碱+新盐溶解性:钾、钠、铵、硝酸盐都易溶于水,碳酸盐大多数溶于水1、可溶性盐+较活金属→新盐+较不活泼金属2、酸+某些盐→新盐+新酸(有沉淀,气体或弱电解质生成)盐 性质 3、可溶性盐+可溶性碱→新盐+新碱(有沉淀,气体或弱电解质生成) (4点) 、可溶性盐+可溶性盐→另两种盐(生成物中有沉淀)利用金属和非金属间的化合反应制取*制取 利用酸和金属,盐和金属等置换反应制取利用酸、碱、盐、氧化物之间的反应制取与碱反应生成盐和水大多数酸性氧化物+水→含氧酸 化合法:非金属单质与氧气反应分解法:与酸反应,生成盐和水少数碱性氧化物+水→可溶性碱 化合法:金属单质与氧气反应 分解法:如不溶性碱或盐受热分解三、单质、氧化物、酸、碱、盐相互关系四、胶体1.分散系定义:由一种(或几种)物质分散到另一种物质里形成的混合物统称为分散系。

【重点难点】重点:物质的分类及胶体的概念、性质。
难点:物质的分类,单质、氧化物、酸、碱和盐之间的相互关系。
【知识讲解】一、元素与物质的关系:1、元素组成物质:自然界中形形色色的物质都是由元素组成的,由元素组成的物质可能是单质,也可能是化合物。
2、元素在物质中的存在形态元素在物质中的存在形态有两种:游离态和化合态。
(1)游离态:元素以单质存在的形态。
例如:氧气中的氧元素就是以游离态存在。
(2)化合态:元素以化合物存在的形态。
例如:NaOH、Na2CO3中的氧元素就是以化合态存在。
元素的游离态、化合态可以相互转化,如O2与C反应生成CO或CO2,游离态的氧元素变成了化合态氧元素,又如KClO3加热制O2,化合态的氧元素又变成了游离态氧元素。
3、物质种类繁多的原因:(1)同种元素可形成不同的单质。
氧元素能形成O2、O3两种不同单质;碳元素形成金刚石、石墨、C60、C70等多种单质;磷元素能形白磷、红磷等单质。
(2)不同种类的元素形成不同种类的化合物。
大的方面可以分为氧化物、酸、碱、盐,而每种类别物质又可以再细分。
以后还要对物质进行详细分类。
(3)元素种类相同时,也可以组成不同的化合物。
如氮元素、氧元素可以组成N2O、NO、N2O3、NO2、N2O4、N2O5 等多种氧化物,主要就是氮元素的化合价不同,组成了不同种类的氧化物。
另外,有机物中还要出现同分异构体(分子式相同而结构不同的物质)。
以上这些原因都决定了元素种类虽然不多,但可以组成多种多样的物质。
二、物质的分类1、物质分类的方法依据不同的分类标准,可以对物质进行不同的分类。
例如:依据物质中所含物质种类的多少,可以把物质分为混合物和纯净物。
混合物是由两种或多种物质混合而成的物质,纯净物则是由一种物质组成的物质。
对于纯净物,依据所含元素种类的多少,可以划分为单质和化合物,由同种元素组成的纯净物叫单质,由不同种元素组成的纯净物叫化合物。
单质可以再分为金属单质、非金属单质、稀有气体单质。


元素与物质世界第1节元素与物质的分类一. 教学内容:第2章元素与物质世界第1节元素与物质的分类二. 教学目的1、了解元素与物质的关系、元素的两种存在形式。
2、掌握物质不同角度的分类方法,了解单质、氧化物、酸、碱、盐之间的反应关系,掌握一类物质可能与其他哪些类别的物质反应。
3、认识胶体是一种重要的分散系,了解胶体的丁达尔现象、电泳、聚沉等特性,能用胶体知识解释实例,了解胶体性质的简单应用。
三. 教学重点、难点元素与物质的关系、胶体的性质四. 知识分析(一)元素与物质的关系复习:由一种元素组成的纯净物叫_单质_,由不同元素组成的纯净物叫化合物。
研究讨论:你所认识的物质中哪些含有氧元素?这些物质中氧元素的存在形态?O2、O3、CO2、H2O、H2SO4、NaOH、KClO3等前两种都是游离态,其余都是化合态。
1、物质是由元素组成的。
元素在物质中有两种存在形式:游离态和化合态。
2、同一种元素可以形成单质也可以形成化合物,如氧元素可以形成单质O2、O3也可以和氢元素结合形成化合物H2O、H2O2。
在单质中元素是以游离态形式存在的,在化合物中元素是以化合态形式存在的。
练一练:下列元素在自然界中既有游离态又有化合态存在的是(C )A. 氢B. 铁C. 碳D. 钠3、同一种元素可以形成不同的单质,如碳元素的单质有石墨、金刚石、C60,这三种物质互称为同素异形体。
相同的多种元素也可以形成不同的化合物,如:氢、氯、氧三种元素可以形成HClO、HClO3、HClO4等多种化合物。
种类繁多的有机物中多数是由碳、氢、氧三种元素组成的。
正是由于组成物质的元素种类不同,各元素在物质中含量不同,组成的方式不同才形成了如此丰富的物质世界。
练一练:只含有一种元素的物质(D )A. 一定是纯净物B. 一定是一种单质C. 可能是单质也可能是化合物D. 可能是纯净物也可能是混合物4、元素之间化合时,每一种元素一定数目的原子只能与另一种或几种元素一定数目的原子结合,元素的这种性质表现为元素的化合价。

第1节元素与物质的分类一.教材分析(一)知识脉络学生在初中化学中已经认识了几种具体物质的性质和单质、酸、碱、盐、氧化物的一般性质,但他们只是从单个物质的角度认识物质的性质,尚未从一类物质的角度认识物质的性质,更未建立起元素与物质的关系。
因此,通过元素与物质的关系的研究,引导学生以元素的观点认识物质;通过研究用不同的标准对物质进行分类,使学生建立分类的观点。
在分类的基础上,研究纯净物——单质、氧化物、酸、碱、盐之间的相互关系;在学生原有的认知结构中已存在溶液、浊液等混合物的观点,进而引进一种新的混合物——胶体,建立分散系的概念,丰富学生对混合物的认识,并使学生了解胶体的一般性质,学会从粒度大小的角度对混合物进行分类。
概念三.教学重点(一)知识与技能:元素与物质的关系;胶体的性质。
(二)过程与方法:探讨各类物质的通性及其相互反应关系,学会如何以元素为核心认识物质,从多角度依据不同标准对物质进行分类并体验分类的重要意义。
(三)情感态度与价值观:体会分类的重要意义,依据不同的标准对物质进行分类;让学生树立运用化学知识,使自己生活得更健康。
四.教学准备(一)学生准备要求学生复习初中化学中单质、氧化物、酸、碱、盐之间的关系,复习第一章第二节研究物质性质的方法和程序,为学习本节教材做准备。
(二)教师准备教学媒体及课件;概念图;实验探究的药品及仪器。
第1课时【板书】第1节元素与物质的分类【板书】一.元素与物质的分类1.联想·质疑(提出..)..本节教材的核心问题(1)110多种元素是如何构成几千万种物质的?(2)为了更好地研究物质的性质和用途,应怎样对物质进行分类?用什么样的标准分类? (3)各类物质之间具有怎样的关系?2.交流·研讨(引发学生对于物质与元素之间的已有认识。
通过对熟悉物质....的组成元素的分析,逐渐建立起元素与物质的关系。
)【问题1】(P 30)找出组成元素;由已找出的元素重新组合成新的物质。
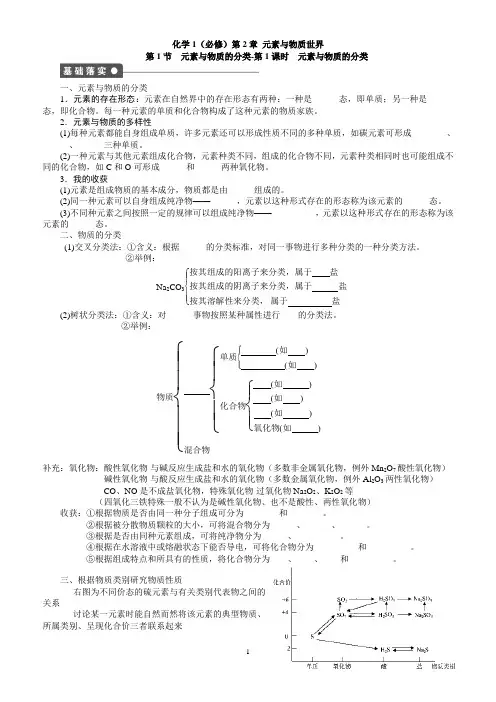
化学1(必修)第2章 元素与物质世界第1节 元素与物质的分类-第1课时 元素与物质的分类一、元素与物质的分类1.元素的存在形态:元素在自然界中的存在形态有两种:一种是______态,即单质;另一种是______态,即化合物。
每一种元素的单质和化合物构成了这种元素的物质家族。
2.元素与物质的多样性(1)每种元素都能自身组成单质,许多元素还可以形成性质不同的多种单质,如碳元素可形成________、______、______三种单质。
(2)一种元素与其他元素组成化合物,元素种类不同,组成的化合物不同,元素种类相同时也可能组成不同的化合物,如C 和O 可形成______和______两种氧化物。
3.我的收获(1)元素是组成物质的基本成分,物质都是由______组成的。
(2)同一种元素可以自身组成纯净物——______,元素以这种形式存在的形态称为该元素的______态。
(3)不同种元素之间按照一定的规律可以组成纯净物——__________,元素以这种形式存在的形态称为该元素的______态。
二、物质的分类(1)交叉分类法:①含义:根据______的分类标准,对同一事物进行多种分类的一种分类方法。
②举例:Na 2CO 3⎩⎪⎨⎪⎧ 按其组成的阳离子来分类,属于 盐按其组成的阴离子来分类,属于 盐按其溶解性来分类, 属于 盐(2)树状分类法:①含义:对______事物按照某种属性进行____的分类法。
②举例:物质⎩⎪⎪⎨⎪⎪⎧ ⎩⎪⎨⎪⎧ 单质⎩⎪⎨⎪⎧(如 ) (如 )化合物⎩⎪⎨⎪⎧ (如 ) (如 ) (如 )氧化物(如 )混合物补充:氧化物:酸性氧化物-与碱反应生成盐和水的氧化物(多数非金属氧化物,例外Mn 2O 7酸性氧化物)碱性氧化物-与酸反应生成盐和水的氧化物(多数金属氧化物,例外Al 2O 3两性氧化物) CO 、NO 是不成盐氧化物,特殊氧化物-过氧化物Na 2O 2、K 2O 2等(四氧化三铁特殊一般不认为是碱性氧化物、也不是酸性、两性氧化物)收获:①根据物质是否由同一种分子组成可分为________和________。



元素使等级划分
元素使等级划分,可以按照如下方式进行:
一级元素:包括广义元素、化学元素等。
二级元素:广义元素可再细分为物质元素、抽象元素等;化学元素可再细分为金属元素、非金属元素等。
三级元素:物质元素可再细分为自然元素、人造元素等;抽象元素可再细分为形象元素、抽象元素等。
四级元素:自然元素可再细分为生物元素、非生物元素等;人造元素可再细分为合成元素、人工元素等。
五级元素:生物元素可再细分为有机元素、无机元素等;非生物元素可再细分为地球元素、宇宙元素等。
六级元素:有机元素可再细分为生命元素、有机化合物元素等;无机元素可再细分为无机化合物元素、无机物质元素等。
请注意,以上仅为一种可能的等级划分方式,并非官方标准。
不得出现任何网址、超链接和电话。
第1节 元素与物质的分类一。
教材分析 (一)知识脉络学生在初中化学中已经认识了几种具体物质的性质和单质、酸、碱、盐、氧化物的一般性质,但他们只是从单个物质的角度认识物质的性质,尚未从一类物质的角度认识物质的性质,更未建立起元素与物质的关系。
因此,通过元素与物质的关系的研究,引导学生以元素的观点认识物质;通过研究用不同的标准对物质进行分类,使学生建立分类的观点。
在分类的基础上,研究纯净物—-单质、氧化物、酸、碱、盐之间的相互关系;在学生原有的认知结构中已存在溶液、浊液等混合物的观点,进而引进一种新的混合物——胶体,建立分散系的概念,丰富学生对混合物的认识,并使学生了解胶体的一般性质,学会从粒度大小的角度对混合物进行分类。
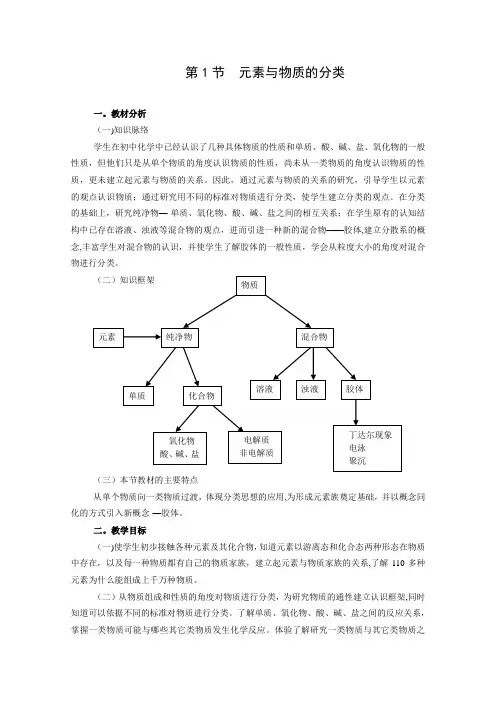
(二)知识框架(三)本节教材的主要特点从单个物质向一类物质过渡,体现分类思想的应用,为形成元素族奠定基础,并以概念同化的方式引入新概念-—胶体。
二。
教学目标(一)使学生初步接触各种元素及其化合物,知道元素以游离态和化合态两种形态在物质中存在,以及每一种物质都有自己的物质家族,建立起元素与物质家族的关系,了解110多种元素为什么能组成上千万种物质。
(二)从物质组成和性质的角度对物质进行分类,为研究物质的通性建立认识框架,同时知道可以依据不同的标准对物质进行分类。
了解单质、氧化物、酸、碱、盐之间的反应关系,掌握一类物质可能与哪些其它类物质发生化学反应。
体验了解研究一类物质与其它类物质之物质元素纯净物混合物单质化合物溶液浊液胶体氧化物酸、碱、盐电解质非电解质丁达尔现象 电泳 聚沉间反应的关系的过程方法.(三)知道胶体是一种重要的分散系,了解胶体的丁达尔现象、电泳、聚沉等特性,能够列举生活中胶体的实例,了解胶体性质的简单应用.三.教学重点(一)知识与技能:元素与物质的关系;胶体的性质.(二)过程与方法:探讨各类物质的通性及其相互反应关系,学会如何以元素为核心认识物质,从多角度依据不同标准对物质进行分类并体验分类的重要意义。
第二章元素与物质世界
第一节元素与物质的分类(第1课时)
【学习目标】
1、能从物质的性质和组成角度对物质分类。
2、建立起酸性氧化物和碱性氧化物的概念。
3、了解单质、氧化物、酸、碱、盐之间的反应关系,掌握一类物质可能与那
类物质发生反应,体验并了解研究一类物质与其他类物质之间反应关系的过程和方法。
4、了解可以依据不同标准对物质进行分类。
【学习重难点】
物质的分类及各类物质之间的反应
【学习过程】
【课前预习】
【自主预习】
一、元素与物质的关系:
交流研讨:P31
1、元素的定义。
物质都是由组成的。
每一种元素都能自身组成物质—。
绝大多数元素都能与其他元素组成物质——。
单质:举例、
化合物:举例、
2、元素在物质中的存在形态:、
如CO2、NaOH、AgNO3、O2、C、Mg,属于化合态的有
二、物质的分类
1、物质分类的依据
(1)物质是否由同一种分子组成。
物质:纯净物(单质,化合物——氧化物,酸,碱,盐)混合物——溶液,浊液,胶体(2)根据组成特点和所具有的性质,把化合物分为、、、
酸性氧化物:,如、、
碱性氧化物:如、、
(3)根据在水溶液中或熔融状态下能否导电,可将化合物分为、
(4)根据在氧化还原反应中的表现:可将反应物分为、
(5)根据被分散物质的颗粒大小,将混合物分为、、
【自我检测】
1. 只含有一种元素的物质是()
A.可能是混合物
B.可能是单质也可能是化合物
C.一定是纯净物
D.一定是一种单质
2. 关于氧化物的叙述正确的是()
A.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
B.碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物
C.碱性氧化物都能与水化合生成碱
D.酸性氧化物都能与水化合生成酸
3. 下列物质中属于纯净物的是()
A.液氯
B.漂白粉
C.盐酸
D.碘酒
4. 下列元素中,在自然界中只能以化合态存在的是()
A.钠
B.氧
C. 氮
D. 铁
【课中案】
【精讲点拨】交流研讨:P31
1、元素的两种存在形式是和。
2、物质的分类:
单质
纯
净
物
按组成分为:、、、
化合物
按水溶液或熔融状态能否导电分为、
按在氧化还原反应中的表现、
3、酸性氧化物:
碱性氧化物:
思考:1、CO是否是酸性氧化物?Na2O2是否是碱性氧化物?
2、酸性氧化物、碱性氧化物各有什么通性?
3、酸碱盐各有什么通性?
4、单质、氧化物、酸碱盐之间有什么相互关系?
【活动探究】探究单质,氧化物,酸,碱,盐间的关系实验方案。
指导:把所给试剂分类,分别选取一组中的一种物质,试验它与其它组物质的反应,并进行记录。
讨论:金属,非金属,碱性氧化物,酸性氧化物,酸,碱,盐分别可能与哪些类别的物质发生反应?将图中可能发生反应的物质类别用线连起来。
金属非金属
碱性氧化物酸性氧化物
碱酸
盐盐
【典例分析】
例1.下列物质中肯定为纯净物的是()
A.只由一种元素组成的物质B.只由一种原子构成的物质
C.只由一种分子构成的物质
D.只由一种元素的阳离子与另一种元素的阴离子构成的物质
【例2】请利用分类法把下列几种物质进行分类,
CaCl2 Ca(NO3)2KNO3K2SO4KCl
1、_________________________________________________
2、_________________________________________________-
3、_________________________________________________
【当堂达标】
1.单质和化合物的区别,在于是否由()A.同种物质组成B.同种元素组成C.同种分子组成D.同种离子组成
2.下列各组物质按化合物、单质、混合物的顺序排列的是()
A.烧碱、液态氧、碘酒B.生石灰、熟石灰、白磷
C.干冰、铜、氯化氢D.空气、氮气、胆矾
3.意大利科学家最近合成一种新型的氧分子,其化学式为O4,下列叙述正确的是()A.一个O4分子由2个O2分子组成B.O4是一种单质
C.O4是由O2组成的混合物D.O4是一种化合物
4、判断下列各种说法是否正确?为什么?
(1)非金属氧化物都是酸性氧化物。
(2)碱性氧化物一定是金属氧化物,金属氧化物一定是碱性氧化物。
(3)氧化铁不是碱性氧化物,因为氧化铁不能和水反应生成氢氧化铁。
(4)水在电解时,阴极能生成氢气。
因为水中含有氢单质。