元素与物质的分类
- 格式:docx
- 大小:20.92 KB
- 文档页数:9

2.1元素与物质分类考点1 元素与物质的关系1.根据元素组成对物质分类(1)元素具有相同核电荷数的一类原子的总称。
(2)元素组成物质元素――→组成⎩⎪⎨⎪⎧单质:同种元素组成的纯净物化合物:不同种元素组成的纯净物(3)纯净物与混合物①纯净物:由同种单质或化合物组成的物质。
②混合物:由几种不同的单质或化合物组成的物质。
③纯净物和混合物的区别纯净物 混合物 有固定的组成和结构 无固定的组成和结构 有一定的熔、沸点 无一定的熔、沸点 保持一种物质的性质保持原有物质各自的性质2.游离态与化合态元素以单质形式存在时,称为元素的游离态;元素以化合物形式存在时,称为元素的化合态。
3.“价-类”二维图主要表明氢化物、单质、氧化物、酸、碱、盐等类别的物质考点2 物质的分类与物质的性质1.酸性氧化物与碱性氧化物(1)酸性氧化物.(大多数非金属氧化物,如:SO2、SO3、CO2、Mn2O7)能与碱反应生成盐和水的氧化物叫酸性氧化物(注意只生成盐和水,不变价)。
注意:①酸性氧化物都能跟强碱反应,生成盐和水②大多数酸性氧化物能跟水化合生成酸(SiO2除外),不是全部。
③大多数酸性氧化物都可由非金属与O2化合生成点燃例如:①2NaOH + CO2 === Na2CO3 + H2O ②CO2 + H2O === H2CO3③C + O2CO2(2)碱性氧化物.(大多数金属氧化物,如:CaO、MgO、CuO、Fe2O3)能与酸反应生成盐和水的氧化物叫碱性氧化物。
CaO、Fe2O3等大多数金属氧化物都是碱性氧化物(3)两性氧化物.既能与碱反应生成盐又能与酸反应生成盐和水的氧化物叫两性氧化物。
如Al2O3。
【注意】正确理解几个“一定”“不一定”(1)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7为酸性氧化物。
(2)酸性氧化物不一定是非金属氧化物,如Mn2O7;非金属氧化物也不一定是酸性氧化物,如CO、NO。
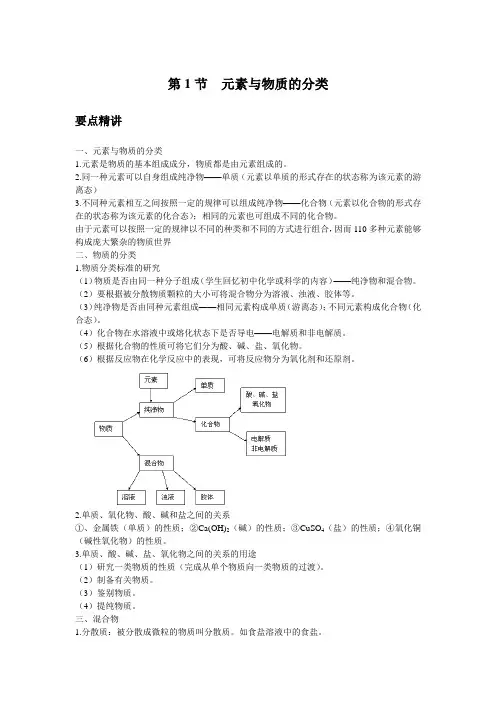
第1节元素与物质的分类要点精讲一、元素与物质的分类1.元素是物质的基本组成成分,物质都是由元素组成的。
2.同一种元素可以自身组成纯净物——单质(元素以单质的形式存在的状态称为该元素的游离态)3.不同种元素相互之间按照一定的规律可以组成纯净物——化合物(元素以化合物的形式存在的状态称为该元素的化合态);相同的元素也可组成不同的化合物。
由于元素可以按照一定的规律以不同的种类和不同的方式进行组合,因而110多种元素能够构成庞大繁杂的物质世界二、物质的分类1.物质分类标准的研究(1)物质是否由同一种分子组成(学生回忆初中化学或科学的内容)——纯净物和混合物。
(2)要根据被分散物质颗粒的大小可将混合物分为溶液、浊液、胶体等。
(3)纯净物是否由同种元素组成——相同元素构成单质(游离态);不同元素构成化合物(化合态)。
(4)化合物在水溶液中或熔化状态下是否导电——电解质和非电解质。
(5)根据化合物的性质可将它们分为酸、碱、盐、氧化物。
(6)根据反应物在化学反应中的表现,可将反应物分为氧化剂和还原剂。
2.单质、氧化物、酸、碱和盐之间的关系①、金属铁(单质)的性质;②Ca(OH)2(碱)的性质;③CuSO4(盐)的性质;④氧化铜(碱性氧化物)的性质。
3.单质、酸、碱、盐、氧化物之间的关系的用途(1)研究一类物质的性质(完成从单个物质向一类物质的过渡)。
(2)制备有关物质。
(3)鉴别物质。
(4)提纯物质。
三、混合物1.分散质:被分散成微粒的物质叫分散质。
如食盐溶液中的食盐。
2.分散剂:分散质分散到另一种物质中,这种物质(另一种物质)叫分散剂。
如食盐溶液中的水。
3.分散系:由分散质和分散剂构成的混合物统称为分散系。
如食盐溶液就是一种分散系。
教师要求学生列举几种分散系,并指出分散质和分散剂。
4.几种常见的分散系(根据分散系中分散质粒度大小进行分类)(1)溶液:分散质是分子或离子,分散质的粒度<1nm(10-9m),具有透明、均匀、稳定的宏观特征。

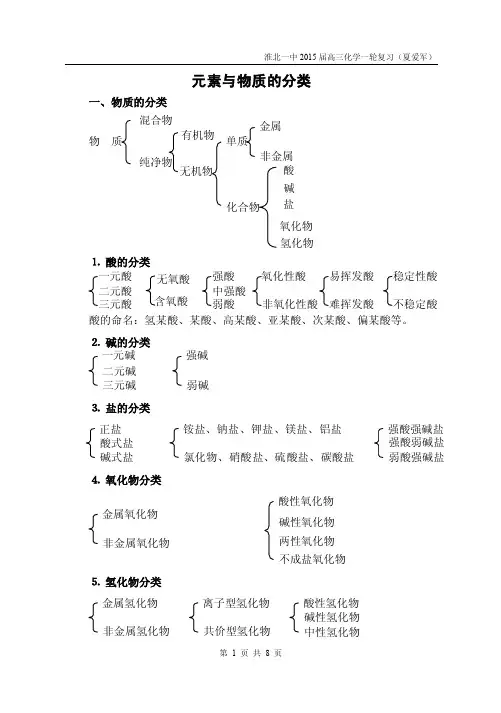
元素与物质的分类一、物质的分类酸的命名:氢某酸、某酸、高某酸、亚某酸、次某酸、偏某酸等。
⒉碱的分类⒊盐的分类⒋ 氧化物分类⒌ 氢化物分类正盐酸式盐碱 碱式盐 强酸强碱盐 强酸弱碱盐 弱酸强碱盐 铵盐、钠盐、钾盐、镁盐、铝盐氯化物、硝酸盐、硫酸盐、碳酸盐等一元碱 二元碱 三元碱 强碱 弱碱 金属氧化物 非金属氧化物酸性氧化物 碱性氧化物 两性氧化物 不成盐氧化物 金属氢化物 非金属氢化物离子型氢化物 共价型氢化物酸性氢化物 碱性氢化物 中性氢化物⒍元素物质家庭的构建金属元素:单质→氧化物(一般是碱性氧化物)→碱→盐;非金属元素:单质→氧化物(一般是酸性氧化物)→酸→盐;单质→氢化物(水溶液可能是酸性或碱性)→酸或碱→盐;二、无机反应规律(按物质类别分)㈠金属单质(常见包括钠、镁、铝、铁、铜等),只作还原剂⒈金属与非金属反应,如钠、镁、铝、铁、铜等与氧气、氯气、硫、氮气等反应。
⒉金属与水反应,如钠、镁、铁等与水反应。
⒊金属与某些氧化物反应,如镁与CO2反应、铝热反应等。
⒋金属与酸反应,如活泼金属与一般强酸反应、金属与氧化性酸反应、钝化等。
⒌金属与碱反应,如铝与强碱溶液反应。
⒍金属与盐反应,如活泼金属置换不活泼金属、铜与铁盐溶液反应、镁与铵盐溶液反应、钠与钛等金属的熔融卤化物反应。
⒎金属与有机物的反应,如钠与乙醇反应等。
㈡非金属单质(常见包括O2、Cl2、S、N2、H2、C、Si、P等),既可作氧化剂也可作还原剂⒈非金属与金属反应。
⒉非金属与非金属反应,如H2与多种非金属化合生成氢化物、O2与多种非金属化合生成氧化物、P、Si与Cl2反应、C与S反应。
⒊非金属与水反应,如F2、Cl2、C等与水的反应。
⒋非金属与某些氧化物的反应,如O2与CO等一些低价氧化物反应、H2、C等与一些金属氧化物反应等。
⒌非金属与碱反应,如Cl2、S、Si等与碱的反应。
⒍非金属与盐的反应,如活泼非金属置换不活泼非金属、Cl2与亚铁盐反应、O2与Na2SO3反应等。


元素与物质的分类教案引言:元素和物质是化学中非常重要的概念。
元素是构成所有物质的基本单位,而物质是由不同元素组成的。
了解元素和物质的分类可以帮助我们更好地理解化学世界。
本教案将介绍元素和物质的分类方法以及相关的例子。
一、元素的分类元素是由同一种原子组成的物质,可以通过原子序数和原子量等进行分类。
1.按照物性分类1.金属元素:具有良好的导电性、导热性和延展性,如铁、铜和铝等。
2.非金属元素:导电性差,通常是气体或固体,如氧气、碳和硫等。
3. 金属loid元素:介于金属和非金属之间,如硅和磷等。
2.按照物种分类按照元素的化学性质分类,主要可以分为两大类:有机元素和无机元素。
1.有机元素:主要包括碳、氢、氧、氮、磷和硫等,在生物体中广泛存在,构成有机化合物的基础。
2.无机元素:包括除了有机元素之外的所有元素,如金属元素铁和非金属元素氧等。
二、物质的分类物质是由不同元素组成的,可以通过物质的组成和性质进行分类。
1.按照组成分类1.纯物质:由同一种元素或化合物组成的物质。
a.元素:由同一种原子组成的物质,如纯铁、纯铝等。
b.化合物:由不同元素按照一定比例组成的物质,如水、二氧化碳等。
2.混合物:由不同元素或化合物混合而成的物质。
a.均匀混合物:组成均匀,各组成部分难以分辨,如盐水、空气等。
b.非均匀混合物:组成不均匀,各组成部分容易分辨,如沙土、果酱等。
2.按照性质分类1.可溶性物质:可以在溶剂中溶解的物质,如食盐等。
2.不溶性物质:不能在溶剂中溶解的物质,如石油等。
3.酸性物质:呈酸性反应的物质,如柠檬汁等。
4.碱性物质:呈碱性反应的物质,如氨水等。
5.中性物质:不呈酸性或碱性反应的物质,如纯水等。
三、案例分析以下是一些案例,用来对元素和物质的分类进行实际应用。
1. 试举例说明金属、非金属和金属loid元素。
答案:金属元素例如铁、铜;非金属元素例如氧气、碳;金属loid 元素例如硅和磷。
2.化学式H2O代表的是什么物质?是纯物质还是混合物?答案:H2O代表水,它是由同一种化合物组成的,因此是纯物质。

【重点难点】重点:物质的分类及胶体的概念、性质。
难点:物质的分类,单质、氧化物、酸、碱和盐之间的相互关系。
【知识讲解】一、元素与物质的关系:1、元素组成物质:自然界中形形色色的物质都是由元素组成的,由元素组成的物质可能是单质,也可能是化合物。
2、元素在物质中的存在形态元素在物质中的存在形态有两种:游离态和化合态。
(1)游离态:元素以单质存在的形态。
例如:氧气中的氧元素就是以游离态存在。
(2)化合态:元素以化合物存在的形态。
例如:NaOH、Na2CO3中的氧元素就是以化合态存在。
元素的游离态、化合态可以相互转化,如O2与C反应生成CO或CO2,游离态的氧元素变成了化合态氧元素,又如KClO3加热制O2,化合态的氧元素又变成了游离态氧元素。
3、物质种类繁多的原因:(1)同种元素可形成不同的单质。
氧元素能形成O2、O3两种不同单质;碳元素形成金刚石、石墨、C60、C70等多种单质;磷元素能形白磷、红磷等单质。
(2)不同种类的元素形成不同种类的化合物。
大的方面可以分为氧化物、酸、碱、盐,而每种类别物质又可以再细分。
以后还要对物质进行详细分类。
(3)元素种类相同时,也可以组成不同的化合物。
如氮元素、氧元素可以组成N2O、NO、N2O3、NO2、N2O4、N2O5 等多种氧化物,主要就是氮元素的化合价不同,组成了不同种类的氧化物。
另外,有机物中还要出现同分异构体(分子式相同而结构不同的物质)。
以上这些原因都决定了元素种类虽然不多,但可以组成多种多样的物质。
二、物质的分类1、物质分类的方法依据不同的分类标准,可以对物质进行不同的分类。
例如:依据物质中所含物质种类的多少,可以把物质分为混合物和纯净物。
混合物是由两种或多种物质混合而成的物质,纯净物则是由一种物质组成的物质。
对于纯净物,依据所含元素种类的多少,可以划分为单质和化合物,由同种元素组成的纯净物叫单质,由不同种元素组成的纯净物叫化合物。
单质可以再分为金属单质、非金属单质、稀有气体单质。



元素与物质的分类教案第一章:物质的分类1.1 教学目标让学生了解和掌握物质的分类方法。
使学生理解纯净物和混合物的区别。
让学生掌握元素、化合物和物质之间的关系。
1.2 教学内容物质分类的基本概念:纯净物、混合物、元素、化合物。
物质分类的方法和原则。
物质分类的实际应用。
1.3 教学重点和难点物质分类的基本概念的理解和应用。
物质分类方法的掌握。
物质分类原则的理解。
1.4 教学方法和手段采用讲授法,讲解物质分类的基本概念、方法和原则。
使用案例分析法,分析物质分类的实际应用。
使用多媒体手段,展示物质分类的图像和实例。
1.5 教学步骤引入物质分类的概念,讲解纯净物和混合物的区别。
讲解元素的定义和特点,介绍元素周期表。
讲解化合物的定义和特点,介绍化合物的组成和性质。
通过实例分析,展示物质分类的方法和原则的应用。
总结物质分类的知识点,进行复习和巩固。
第二章:元素的概念和特点2.1 教学目标让学生了解和掌握元素的概念和特点。
使学生能够识别和记忆元素的符号和名称。
让学生了解元素在物质中的存在和作用。
2.2 教学内容元素的概念和定义。
元素的特点和性质。
元素周期表的结构和应用。
2.3 教学重点和难点元素的概念和特点的理解和应用。
元素符号的记忆和识别。
元素周期表的结构和应用的理解。
2.4 教学方法和手段采用讲授法,讲解元素的概念和特点。
使用案例分析法,分析元素的存在和作用。
使用多媒体手段,展示元素周期表的图像和实例。
2.5 教学步骤引入元素的概念,讲解元素的定义和特点。
讲解元素符号的表示方法,进行符号的记忆和识别练习。
介绍元素周期表的结构和应用,讲解周期表的排列规律。
通过实例分析,展示元素的存在和作用。
总结元素的知识点,进行复习和巩固。
第三章:化合物的组成和性质3.1 教学目标让学生了解和掌握化合物的组成和性质。
使学生能够识别和记忆化合物的名称和化学式。
让学生了解化合物在物质中的存在和作用。
3.2 教学内容化合物的组成和定义。

化学元素与物质的分类化学元素是组成物质的基本单位,而物质是由不同元素的组合构成的。
根据元素和物质的特征和性质,可以将其进行不同的分类。
首先,我们可以根据元素的性质将其进行分类。
元素可以分为金属元素、非金属元素和半金属元素。
金属元素具有以下特点:导电性好、热导性好、金属光泽、具有延展性和韧性、高熔点和高密度等。
常见的金属元素有铁、铜、铝、银、金等。
非金属元素具有以下特点:导电性差、热导性差、大部分是气体或者在常温下是固体,脆性较大。
常见的非金属元素有氧、氮、氢、碳、硫等。
半金属元素具有金属和非金属的一些性质。
半金属元素可以是半导体材料,具有介于导电体和绝缘体之间的导电性。
常见的半金属元素有硅、锗、硼等。
其次,根据物质的组成和特性,我们可以将物质进行二元分法分类、化合物分类、混合物分类。
二元分法是指将物质分为无机物和有机物。
无机物是指不含有碳元素的物质,如水、盐等。
有机物是指含有碳元素的物质,如石油、木材等。
化合物是由两种或两种以上的元素通过化学反应结合而成的物质。
根据元素的不同,化合物可以分为无机化合物和有机化合物。
无机化合物主要是由非金属元素和金属元素结合而成的,如氧化物、硫化物等。
有机化合物是由碳元素和其他元素结合而成的,如醇、酮、酸等。
混合物是由两种或两种以上的物质通过物理方法混合而成的物质。
根据其组成和特性的不同,混合物可以分为均相混合物和非均相混合物。
均相混合物是指组成物质的物种均匀分布在整个混合物中,如盐水、空气等。
非均相混合物是指组成物质的物种不均匀地分布在混合物中,如混合油、混凝土等。
此外,我们还可以根据物质的物理状态将其进行分类。
根据物质的不同状态,物质可以分为固体、液体和气体。
固体具有一定的形状和体积,其分子间相互吸引力较大,分子振动范围较小。
液体具有固定的体积,但没有固定的形状,其分子间相互吸引力较小,分子振动范围较大。
气体没有固定的体积和形状,分子间相互吸引力非常小,分子振动范围很大。
元素与物质的分类
化学:2.1《元素与物质的分类》学案(2)(鲁科版必修1)
第一课时元素与物质的关系物质的分类课前延伸学案
【教师寄语】从认真自学中培养自己的能力
【学习目标】使学生初步接触各种元素及其化合物。
2.使学生知道元素可以游离态和化合态两种形态存在。
3.知道每一种元素都有自己的物质家族,建立起元
素与物质家族的关系。
4.了解110多种元素为什么能够组成上千万种物质。
5.使学生能从物质的性质和组成角度对物质分类。
使学生建立起酸性看氧化物和碱性氧化物的概念。
7.了解单质、氧化物、酸、碱、盐之间的反应关系,
掌握一类物质可能与那类物质发生反应,
体验并了解研究一类物质与其他类物质之间反应关
系的过程和方法。
8.了解可以依据不同标准对物质进行分类。
【知识重点难点】
重点:物质的分类及各类物质之间的反应
难点:各类物质之间的反应关系
【复习巩固】
1、化合价是。
指出下列物质中个各元素的化合价Cl2 O2 NaCl Mg CaCO3 H2S SO3 H2SO4
【自主预习】
一、元素与物质的关系:
交流研讨:P、元素的定义。
物质都是由组成的。
每一种元素都能自身组成物质—。
绝大多数元素都能与其他元素组成物质——。
单质:举例、
化合物:举例、
2、元素在物质中的存在形态:、
如CO2、NaOH、AgNO3、O2、C、Mg,属于化合态的有
二、物质的分类
1、物质分类的依据
(一)、物质分类的方法
(1)物质是否由同一种分子组成。
物质:纯净物(单质,化合物——氧化物,酸,碱,盐)
混合物——溶液,浊液,胶体
(2)根据组成特点和所具有的性质,把化合物分
为、、、。
酸性氧化物:,如、、
碱性氧化物:
如、、
(3)根据在水溶液中或熔融状态下能否导电,可将化合物分为、
(4)根据在氧化还原反应中的表现:可将反应物分为、
(5)根据被分散物质的颗粒大小,将混合物分为、、
【自我检测】只含有一种元素的物质是()
A.可能是混合物
B.可能是单质也可能是化合物一定是纯净物 D.一定是一种单质
2. 关于氧化物的叙述正确的是()
A.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
B.碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物
C.碱性氧化物都能与水化合生成碱
D.酸性氧化物都能与水化合生成酸下列物质中属于纯净物的是()
A.液氯
B.漂白粉
C.盐酸
D.碘酒下列元素中,在自
然界中只能以化合态存在的是()
A.钠
B.氧
C. 氮
D. 铁结合前面的学习,整理氯及其化合物的知识,完成下列问题。
(1)写出你所知道的含氯元素的物质(至少4个类别,5种物质):
(2)指出氯元素在你所列物质中的存在形态。
(3)请你对自己写出的5种物质进行分类
(4)完成某些含氯物质间的转化,写出反应的化学方程式(至少2个,可补充)
【错因分析】
【疑点解惑】
第一课时元素与物质的关系物质的分类课内探究学案
【教师寄语】从认真自学中培养自己的能力
【学习目标】
1、使学生初步接触接触各种元素及其化合物,知道元素可以游离态和化合态两种形态存在
2、使学生能从物质的组成和性质的角度对物质进行分类。
建立酸性氧化物和碱性氧化物的概念,了解单质、氧化物、酸、碱、盐之间的相互关系,掌握一类物质可
能与哪些类别的物质发生反应。
【知识重点难点】
知识重点:单质、氧化物、酸、碱、盐间的关系。
只是难点:各类物质之间的反应关系
【教学过程】
一、元素与物质的关系
【自主学习】
1、元素是。
目前自然界已发现110多种元素,物
质都是由组成的。
每一种元素都能自身组成物质,叫;绝大多数元素都能与其他元素组成。
而且几种元素组成化合物时,有的只能组成一种,有的则能组成几种不同
的化合物。
由于,所以110多种元素便组成了种类繁多的物质。
2、元素的两种存在形式是和。
3、物质的分类依据:
根据物质的组成分类:混合物
物质 ____________
__________
____________
根据组成特点和具有的性质,化合物分,,,和。
其中酸性氧化物指,如。
碱性氧化物指
如。
思考:CO是否是酸性氧化物?Na2O2是否是碱性氧化物?
根据在水溶液中熔融状态下能否导电,可将化合物分为根据在氧化还原反应中的表现,可将反应物分为
根据被分解物质的颗粒大小,将混合物分为
【活动探究】探究单质,氧化物,酸,碱,盐间的关系实验方案。
指导:把所给试剂分类,分别选取一组中的一种物质,试验它与其它组物质的反应,并进行记录。
反应物实验现象结论
讨论:金属,非金属,碱性氧化物,酸性氧化物,酸,碱,盐分别可能与哪些类别的物质发生反应?将图中可能发生反应的物质类别用线连起来。
金属非金属
碱性氧化物酸性氧化物
碱酸
盐盐
【教师精讲】
单质、氧化物、酸、碱、盐间的关系。
【巩固检测】
一、选择题:下列物质与氢氧化钠溶液作用,生成红褐色沉淀的是
A.FeCI3
B.CO2
C.HCI
D.CuCI2
2. 关于碱的叙述正确的是
A.含有氢氧根
B.能使紫色石蕊试液变蓝
C.能跟酸反应生成盐和水落石出
D.电离出的阴离子全部是氢氧根离子酸类具有相似的化学性质的原因是
A.都有酸根
B.分子中都有氢原子
C.能使紫色石蕊试液变红色
D.在水溶液中电离出的阳离子全部是氢离子
二、写出下列反应的化学方程式,并注明反应类型生石灰溶于水
2. 硝酸银与氯化钠溶液反应氢氧化钡与盐酸反应实验室制取氢气
三、标出下列各元素的化合价
NH4NO3 FeCI2 Fe2O3 NH3 HNO3 Cu(OH)2 Na22 SO 3 H2SO4 H2第一课时元素与物质的关系物质的分类课后延伸学案
【巩固习题】
一、选择题
1、将下列各物质按酸、碱、盐分类顺序排列,正确的是()
A、硫酸、纯碱、石膏
B、氢硫酸、烧碱、绿矾
C、碳酸、乙醇、醋酸钠
D、磷酸、熟石灰、苛性钠
2、下列各组物质中,前者是单质,后者是氧化物的是()
A、尿素磁铁矿石
B、金刚石水
C、液氧氯酸钾
D、汞碘酒
3、在Zn、ZnO、ZnCO3、盐酸、CuCl2和CaCl2溶液六种物质中,每两种物质反应能生成ZnCl2的方法有()
A、2种
B、3种
C、4种
D、5种
4、化学概念在逻辑上存在如下关系:
对下列概念的说法正确的是()
A、纯净物与混合物属于包含关系
B、化合物与氧化物属于包含关系
C、单质与化合物属于交叉关系
D、氧化反应与化合反应属于并列关系
5、由一种元素组成的物质()
A、一定是一种单质
B、一定是纯净物
C、一定是混合物
D、可能是纯净物,也可能是化合物
6、二氧化氯(ClO2)是一种新型的自来水消毒剂,下列关于它的描述错误的是()
A、它是一种氧化物
B、其中氯元素的化合价为+、它由氯原子和氧气构成 D、它的相对分子质量为、现有
氧气、氮气、碳、铜、硫、铁、二氧化碳、氧化镁、水、氯酸钾、空气、碱式碳酸铜等物质,请根据要求填空。
(1)属于混合物的有____________,属于非金属氧化
物的有__________。
(2)属于盐的有___________________。
(3)含元素种类最多的化合物是-___________。