第02章 热力学第一定律
- 格式:doc
- 大小:29.00 KB
- 文档页数:2

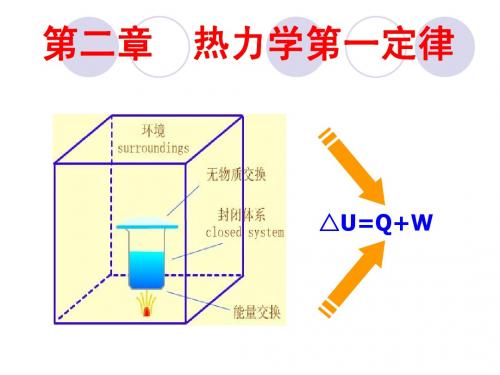

第二章 热力学第一定律第一节 第一定律的实质及热力学能和总能能量守恒与转换定律是自然界的基本规律之一,它指出:自然界中的一切物质都具有能量,能量不可能被创造,也不能被消灭;但能量可以从一种形态转变为另一种形态,且在能量的转化过程中能量总量不变。
热力学第一定律是能量守恒与转换定律在热现象中的应用。
它确定了热力过程中热力系统与外界进行能量交换时,各种形态能量数量上的守恒关系。
一、热力学能热力学能是与物质内部粒子的微观运动和粒子的空间位置有关的能量。
它包括分子移动、转动、粒子震动运动的内动能和分子间由于相互作用力的存在而具有的内位能,故又称内能。
内动能取决于分子热运动,是温度的函数,而内位能取决于分子间的距离,是比体积的函数,即u = f ( T, v )二、总能除热力学能外,工质的总能量还包括工质在参考坐标系中作为一个整体,因有宏观运动速度而具有动能、因有不同高度而具有位能。
前一种能量称之为内部储存能,后两种能量则称之为外部储存能。
我们把内部储存能和外部储存能的总和,即热力学能与宏观运动动能和位能的总和,叫做工质的总储存能,简称总能。
即p k E U E E =++ (2-1)E---总能; U---热力学能; E k ---宏观动能; E p ---宏观位能。
第二节 第一定律的基本能量方程及工质的焓一、焓在有关热力计算总时常有U+pV 出现,为了简化公式和计算,把它定义为焓,用符号H 表示,即H=U+pV (2-2)1kg工质的焓值称为比焓,用h表示,即h=u+pv (2-3)焓的单位是J,比焓的单位是J/kg。
焓是一个状态参数,在任一平衡状态下,u、p和v都有一定得值,因而焓h也有一定的值,而与达到这一状态的路径无关。
当1kg工质通过一定的界面流入热力系统时,储存于它内部的热力学能当然随着也进入到系统中,同时还把从外部功源获得的推动功pv带进了系统。
因此系统中因引进1kg工质而获得的总能量是热力学能与推动功之和(u+pv),即比焓。



第2章 热力学第一定律2-1 定量工质,经历了下表所列的4个过程组成的循环,根据热力学第一定律和状态参数的特性填充表中空缺的数据。
过程 Q/ kJ W/ kJ△U/ kJ1-2 0 100 -1002-3-11080 -1903-4 300 90 210 4-1 20 -60802-2 一闭口系统从状态1沿过程123到状态3,对外放出47.5 kJ 的热量,对外作功为30 kJ ,如图2-11所示。
(1) 若沿途径143变化时,系统对外作功为6 kJ ,求过程中系统与外界交换的热量; (2) 若系统由状态3沿351途径到达状态1,外界对系统作功为15 kJ ,求该过程与外界交换的热量;(3) 若U 2=175 kJ ,U 3=87.5 kJ ,求过程2-3传递的热量,及状态1的热力学能U 1。
图2-11 习题2-2解:(1)根据闭口系能量方程,从状态1沿途径123变化到状态3时,12313123Q U W −=∆+,得1347.5kJ 30kJ 77.5kJ U −∆=−−=−从状态1沿途径143变化到状态3时,热力学能变化量13U −∆保持不变,由闭口系能量方程14313143Q U W −=∆+,得14377.5kJ 6kJ 71.5kJ Q =−+=−,即过程中系统向外界放热71.5kJ(2)从状态3变化到状态1时,()31133113U U U U U U −−∆=−=−−=−∆,由闭口系能量方程35131351Q U W −=∆+,得35177.5kJ 15kJ 62.5kJ Q =−=,即过程中系统从外界吸热92.5kJ(3)从状态2变化到状态3体积不变,323232323232Q U W U pdV U −−−=∆+=∆+=∆∫,因此23233287.5kJ 175kJ 87.5kJ Q U U U −=∆=−=−=−由1331187.577.5kJ U U U U −∆=−=−=−,得1165kJ U =2-3 某电站锅炉省煤器每小时把670t 水从230℃加热到330℃,每小时流过省煤器的烟气的量为710t ,烟气流经省煤器后的温度为310℃,已知水的质量定压热容为 4.1868 kJ/(kg ·K),烟气的质量定压热容为1.034 kJ/(kg ·K),求烟气流经省煤器前的温度。
第2章 热力学第一定律一 基本要求:1. 深入理解热力学第一定律的实质,掌握热力学第一定律的表达式——能量方程,并熟练应用热力学第一定律解决工程实际中的有关问题。
2. 掌握储存能、热力学能和焓的概念。
3. 掌握体积变化功、流动功、轴功和技术功的概念,计算他们之间的关系。
二 重点、难点:1. 热力学第一定律的实质。
2. 焓的物理意义。
3. 热力学能及系统总储存能的区分。
4. 开口及闭口系统的能量方程。
5. 技术功、轴功、推动功和膨胀功的联系及区别。
6. 稳定流动能量方程式的应用。
三 典型题精解:例1:气缸内储有完全不可压缩的流体,气缸的一端被封闭,另一端是活塞。
气缸是绝热静止的。
试问:(1) 活塞能否对流体做功? (2) 流体的压力会改变吗?(3) 若使用某种方法把流体从0.2Mpa 提高到4Mpa ,热力学能有无变化?焓有无变化? 解:(1)汽缸活塞系统是闭口系统。
由于流体不可压缩,流体的体积不会变化,因此流体的体积变化功为零,活塞不能对流体做功。
(2)根据牛顿第三定律,流体的压力应与外力时时相等,因而当活塞上的作用力改变时,流体的压力也随之改变。
(3)根据已知条件,汽缸活塞系统与外界无热交换,Q=0,又W=0,由能量方程 Q=∆U+W 知∆U=0,故流体热力学能无变化。
焓H=U+pV ,当U ,V 不变,p 提高时,H 应增大。
讨论:(1) 从本题分析可以看到,闭口系统与外界有无功量交换,不在于压力大小或系统压力有无变化,而在于系统有无体积的变化。
(2) 本题由于系统与外界无热量交换,无功量交换,因而系统的热力学能变化为零,但焓的变化不为零。
应将热力学能和焓的概念加以正确区分。
例2.门窗紧闭的房间内有一台电冰箱正在运行,若敞开冰箱的大门就有一股凉气扑面,感到凉爽。
于是有人就想通过敞开冰箱大门达到降低室内温度的目的,你认为这种想法可行吗? 解:按题意,以门窗禁闭的房间为分析对象,可看成绝热的闭口系统,与外界无热量交换,Q=0,如图2.1(a)所示,当安置在系统内部的电冰箱运转时,将有电功输入系统,根据热力学规定:0<W ,由热力学第一定律W U Q +∆=可知,0>∆U ,即系统的内能增加,也就是房间内空气的内能增加。
第2章 热力学第一定律
思考题
1.判断下列6个过程中,哪些是可逆过程?
(1)用摩擦的方法生电;
(2)房间内一杯水蒸发为蒸气;
(3)水在沸点时变成同温、同压的蒸气;
(4)在等温等压下混合N 2(g)和O 2(g);
(5)恒温下将1mol 水倾入大量溶液中,溶液浓度未变;
(6)水在冰点时变成同温、同压的冰。
2.下面两种说法是否正确?
(1)状态固定后状态函数都固定,反之亦然。
(2)状态改变后,状态函数一定都改变。
3.因为ΔU=Q V ,ΔH=Q p ,所以Q V ,Q p 是特定条件下的状态函数。
这种说法对吗?
4.气缸内有一定量理想气体,反抗一定外压做绝热膨胀,则ΔH=Q p =0。
这种说法对不对?
5.理想气体绝热可逆和绝热不可逆过程的功,都可用公式W=C V ΔT 计算,两种过程的功是否一样?
6.请指出下面所列公式的适用条件:
(1)ΔH=Q p ;(2)ΔU=Q V ;(3)12
V ln V W nRT 7.用热力学概念判断下列各过程中功、热、热力学能和焓的变化值。
第一定律ΔU=W+Q 。
(1)理想气体自由膨胀;
*(2)van der Waals 气体等温自由膨胀;
(3)Zn(s) + 2HCl(l) = ZnCl 2 + H 2(g)进行非绝热等压反应;
(4)H 2(g) + Cl 2(g) = 2HCl(g)在绝热钢瓶中进行;
(5)常温、常压下水结成冰(273.15K ,101.325kPa )
8.在相同的温度和压力下,一定量氢气和氧气从4种不同的途径生成相同终态的水:(1)氢气在氧气中燃烧;(2)爆鸣;(3)氢氧热爆炸;(4)氢氧燃料电池。
请问这4种变化途径的热力学能和焓的变化值是否相同?
9.一定量的水,从海洋蒸发变为云,云在高山上变为雨、雪,并凝结成冰。
冰、雪融化变成水流入江河,最后流入大海。
整个循环,水的热力学能和焓的变化是多少?
10.298K ,101kPa 压力下,一杯水蒸发为同温、同压的蒸汽是不可逆过程。
试将它设计成可逆过程。
概念题
1.对于理想气体的热力学能有下述4种理解:
(1)状态一定,热力学能也一定;
(2)对应于某一状态的热力学能是可以直接测定的;
(3)对应于某一状态,热力学能只有一个数值,不可能有两个或两个以上的数值;
(4)状态改变时,热力学能一定跟着改变。
其中都正确的是:
(A )(1),(2)(B )(3),(4)(C )(2),(4)(D )(1),(3)
2.有一高压钢筒,打开活塞后气体喷出筒外,当筒内压力与筒外压力相等时关闭活塞,此
时筒内温度将:
(A )不变(B )升高(C )降低(D )无法判断
3.1mol373K ,标准压力下的水,经下列两个不同过程变成373K 、标准压力下的水汽:(1)等温、等压可逆蒸发;(2)真空蒸发。
这两个过程中功和热的关系(ΔU=W+Q )为:
(A )W 1<W 2,Q 1>Q 2(B )W 1<W 2,Q 1<Q 2
(C )W 1=W 2,Q 1=Q 2(D )W 1>W 2,Q 1<Q 2
4.在一个密闭绝热的房间里放置一台电冰箱,将冰箱门打开,并接触电源使其工作,过一段时间之后,室内的平均气温将如何变化?
(A )升高(B )降低(C )不变(D )不一定
5.凡是在孤立系统中进行的变化,其ΔU 和ΔH 的值一定是:
(A )ΔU >0,ΔH >0(B )ΔU =0,ΔH =0
(C )ΔU <0,ΔH <0(D )ΔU =0,ΔH 不确定
6.某理想气体的γ=C p /C V =1.40,则该气体为几原子分子气体?
(A )单原子(B )双原子(C )三原子(D )四原子
7.当5molH 2(g)与4molCl 2(g)混合,最后生成2molHCl(g)。
若以下式为基本单元:H 2(g) + Cl 2(g)→ 2HCl(g)。
则反应进度ξ应是:
(A )1mol (B )2mol (C )4mol (D )5mol
8.欲测定有机物燃烧热Q p ,一般使反应在氧弹中进行,实测得热效应为Q V ,公式Q p =Q V + ΔnRT 中的Δn 为:
(A )生成物与反应物总物质的量之差(B )生成物与反应物中气相物质的量之差
(C )生成物与反应物中凝聚相物质的量之差(D )生成物与反应物的总热容差
9.下述说法,哪一个正确?
(A )水的生成焓即是氧气的燃烧焓(B )水蒸气的生成焓即是氧气的燃烧焓
(C )水的生成焓即是氢气的燃烧焓(D )水蒸气的生成焓即是氢气的燃烧焓
10.298K 时,石墨的标准摩尔生成焓f m H O ∆:
(A )大于零(B )小于零(C )等于零(D )不能确定
11.石墨(C )和金刚石(C )在298K 、标准压力下的标准燃烧焓分别为-393.4kJ·mol -1和-395.3 kJ·mol -1,则金刚石的标准摩尔生成焓f m H O ∆(金刚石,298K )为:
(A )-393.4kJ·mol -1(B )-393.5kJ·mol -1(C )-1.9kJ·mol -1(D )1.9kJ·mol -1
12.人在室内休息时,大约每天要吃0.2kg 的酐酪(摄取的能量约为4000kJ )。
假定这些能量全部不储存在体内,为了维持体温不变,这些能量全部变为热使汗水蒸发。
已知水的汽化热为44kJ·mol -1,则每天需喝多少水:
(A )0.5kg (B )1.0kg (C )1.6kg (D )3.0kg
概念题:
1。
D 2。
C 3。
A 4。
A 5。
D 6。
B 7。
A 8。
B 9。
C 10。
C 11。
D 12。
C。