统编版2020版高考化学总复习 专题 镁的性质及应用导学案
- 格式:doc
- 大小:229.25 KB
- 文档页数:7

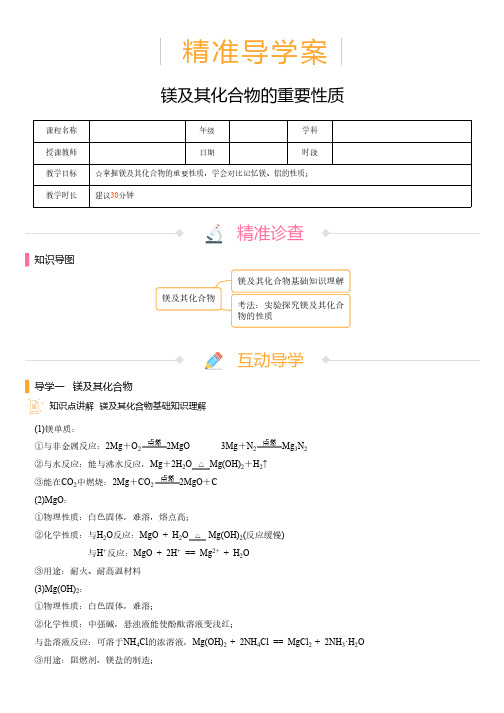
2MgO 3Mg Mg OMg(OH)2MgO O Mg(OH)2222例题我爱展示(4)Mg N 在水中能剧烈水解,生成Mg(OH)沉淀,NH 。
注意:MgO 与Al 粉不能组成铝热剂32231.[单选题][难度:★☆☆☆☆]下列关于镁的叙述中,不正确的是( )A .在空气中燃烧时发出耀眼的白光 B .由于镁能跟空气中的氧气反应,所以必须密封保存C .能跟盐酸反应放出氢气D .镁合金密度小但强度大,大量用于火箭、飞机等部件【参考答案】B【知 识 点】镁及其化合物的重要性质【学科能力】辨识记忆【题目解析】解:A .镁在空气中燃烧发出耀眼的白光,生成白色固体MgO ,镁还能和二氧化碳反应生成MgO ,故A 正确;B .镁和氧气反应是生成一层致密的氧化物薄膜而阻止镁进一步给氧化,所以不需要密封保存,故B 错误;C .在金属活动性顺序表中,镁位于氢之前,所以镁能和酸反应生成氢气,故C 正确;D .合金密度小、强度大、熔点高,所以镁合金能应用于火箭、飞机等部件,故D 正确;故选:B 。
1.[双选题][难度:★★☆☆☆]金属镁在二氧化碳中燃烧生成MgO 和C ,将一定量金属镁在含二氧化碳、氧气的混合气体中燃烧后得到的固体,加入足量盐酸中,充分反应后,将溶液蒸干,然后隔绝空气灼烧,得到的固体成分可能是( )A .MgO 和C B .MgO C .MgCl 和C D .Mg(OH)【参考答案】A;B【知 识 点】镁及其化合物的重要性质【学科能力】辨识记忆【题目解析】解:发生的反应依次为:2Mg+O =2MgO ;2Mg+CO =2MgO+C ;C+O =CO ;MgO+2HCl =MgCl +H O ;MgCl +2H O =Mg(OH)↓+2HCl(水解),加热使得HCl 挥发逸出,促进MgCl 的水解生成Mg(OH),Mg(OH)MgO+H O(加热),故最终得到的固体成分可能是MgO 和C ,或是MgO 。
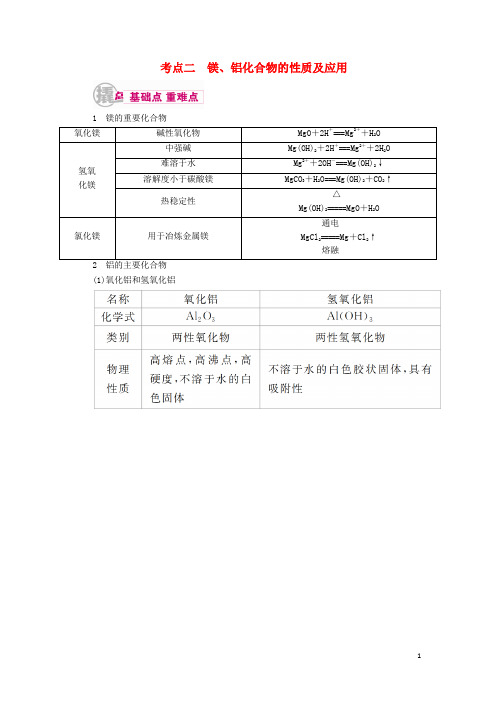
考点二镁、铝化合物的性质及应用1 镁的重要化合物(1)氧化铝和氢氧化铝(2)复盐——硫酸铝钾①复盐定义:由两种不同的金属离子(或NH+4)与一种酸根离子组成的盐叫复盐。
②明矾明矾的化学式为KAl(SO4)2·12H2O,可溶于水,电离方程式为KAl(SO4)2===K++Al3++2SO2-4。
水溶液的pH<7(填“>”“<”或“=”),原因是Al3++3H23+3H+。
明矾可用于净水,其原因是Al3+水解产生Al(OH)3胶体,Al(OH)3胶体可以和悬浮于水中的泥沙形成絮状不溶物而沉降下来,使水澄清。
(1)由于Mg(OH)2的溶解度比MgCO3的小,故水垢的主要成分中是Mg(OH)2,而非MgCO3。
(2)Al2O3、Al(OH)3只与强酸、强碱溶液反应,与氨水和碳酸溶液不反应。
(3)Al3+只能存在于酸性溶液中,AlO-2只能存在于碱性溶液中。
若将分别含Al3+和AlO-2的盐溶液混合,发生反应:Al3++3AlO-2+6H2O===4Al(OH)3↓。
(4)Al2O3、Al(OH)3是中学阶段接触的唯一与碱反应的金属氧化物和氢氧化物,经常应用到除杂、计算题中,所以一定要熟记这两个反应的离子方程式。
(5)明矾净水只能除去水中的悬浮杂质,不能杀菌消毒,与氯气消毒原理不同。
1.思维辨析(1)在加热情况下利用氢气还原氧化铝的方法得到金属铝。
( )(2)将Al(OH)3沉淀转入蒸发皿中,加足量稀硫酸,加热蒸干得无水Al 2(SO 4)3固体。
( ) (3)将NaOH 溶液缓慢滴入Al 2(SO 4)3溶液中至过量,最终观察到有沉淀生成。
( ) (4)日用铝制品表面覆盖着氧化膜对内部金属起保护作用。
( ) (5)Al 2O 3的熔点很高,可用作耐高温材料。
( )(6)明矾水解形成的Al(OH)3胶体能吸附水中的悬浮物,可用于对水的杀菌、消毒。
( ) 答案 (1)× (2)√ (3)× (4)√ (5)√ (6)×2.将等体积的AlCl 3溶液和NaOH 溶液混合后,沉淀物中含铝元素的物质的量与溶液中含铝元素的物质的量相等,则原AlCl 3溶液与NaOH 溶液的物质的量浓度之比是 ( )A .1∶3B .2∶5C .1∶4D .2∶7 答案 D解析 设AlCl 3和NaOH 的物质的量分别为a 、b 。

第2讲镁、铝及其重要化合物
一、镁
1.物理性质
具有银白色金属光泽的固体,密度、硬度均较小,熔点较低,有良好的导电性、导热性和延展性。
2.化学性质
注:Mg3N2极易水解,其化学方程式为Mg3N2+6H2O3Mg(OH)2↓+2NH3↑
3.用途
生产合金,冶金工业上用作还原剂和脱氧剂
二、铝
1.铝的原子结构和存在
铝位于元素周期表④,原子结构示意图为⑤。
铝元素在地壳中含量丰富,仅次于⑥。
自然界中的铝全部以⑦态存在。
2.金属铝的物理性质
⑧色金属,有良好的⑨、⑩和导热性等,密度较小,质地柔软。
3.金属铝的化学性质
写出图中有关反应的化学方程式或离子方程式:
a.
b.
c.
d.
e.
4.铝的制备
(1)铝土矿Al2O3。
(2)2Al2O3(熔融)。
5.铝的用途
(1)用纯铝作导线。
(2)用铝合金制备汽车、飞机、生活用品等。
6.铝热反应
(1)本质
利用铝的还原性,将难熔金属从其氧化物中置换出来:2mAl+3M n O m mAl2O3+3nM。
(2)反应特点
在高温下进行,反应迅速,放出大量的热。
新生成的金属单质呈液态且易与Al2O3分离。
(3)应用
a.在生产上可用于焊接钢轨等。
b.在冶金工业上可用于冶炼难熔金属。
(4)铝热剂
a.在铝热反应中,反应混合物(铝粉、金属氧化物)称为铝热剂。
b.能与Al组成铝热剂的常见金属氧化物有Fe2O3、Fe3O4、Cr2O3、MnO2、V2O5等。
三、铝的重要化合物。

《镁及其化合物》导学案第一课时 镁的性质高二、 班 组 姓名 学号学习目标:1、 通过对海水中提取镁的过程的讨论,掌握其中的反应原理和生产流程2、 了解镁的物理性质,掌握镁的化学性质自主学习:一、镁的提取1.提取流程:浓缩的海水――→加石灰乳__________――→分离加盐酸________――→干燥电解Mg2.有关化学反应方程式:(1)利用贝壳制取石灰乳:________________________________,________________________________ 。
(2)沉淀Mg 2+:_________________________________________________________。
(3)提取MgCl 2:________________________________________________________。
(4)制取金属镁:_________________________________________________________。
二、镁的原子结构1.原子结构示意图:__________________。
2.结构和性质的关系:容易________最外层的______个电子,形成______的稳定结构,表现______性。
三、镁的化学性质1.与非金属单质反应:(1)在O 2中燃烧:________________________________________________________。
(2)在Cl 2中燃烧:______________________________________________________。
(3)在N 2中燃烧:_______________________________________________________。
2.与CO 2反应:(1)现象:镁条________燃烧,发出燿眼的________,放出大量的热,生成________粉末,同时在瓶底有__________生成。

第1讲钠、镁及其重要化合物【2020·备考】最新考纲:1.理解并能应用常见金属的活动性顺序。
2。
了解Na、Mg及其重要化合物的主要性质和重要应用。
3。
了解金属材料在生产和生活中的重要应用。
4。
认识化学在海水等自然资源综合利用和实现物质间转化等方面的实际应用.新课标要求:结合真实情境中的应用实例或通过实验探究,了解钠及其重要化合物的主要性质,了解这些物质在生产、生活中的应用.能从物质类别、元素价态的角度,依据复分解反应和氧化还原原理,预测物质的化学性质和变化,设计实验进行初步验证,并能分析、解释有关实验现象。
能利用典型代表物的性质和反应,设计常见物质制备、分离、提纯、检验等简单任务的方案.能从物质类别和元素价态变化的视角说明物质的转化途径。
最新考情:金属钠、镁及其化合物涉及金属钠、Na2O、Na2O2、NaOH、Na2CO3、NaHCO3、Mg等的性质,多在选择题中,一是考查性质及应用,二是考查转化关系,填空题多出现在流程题中,考查钠的化合物的性质及应用.考点一钠的主要性质及其应用[知识梳理]1.钠的物理性质颜色密度熔点硬度银白色,有金属光泽ρ(水)大于ρ(钠)大于ρ(煤油)小于100 ℃质地柔软2。
钠的化学性质(1)完成上述标号反应的化学方程式。
①4Na+O2===2Na2O。
②2Na+O2Na2O2。
③2Na+2H2O===2NaOH+H2↑。
④2Na+Cl2错误!2NaCl。
提醒:①钠的取用方法:用镊子夹取一小块钠,用滤纸吸干表面的煤油,用小刀切取黄豆大小的钠,剩余的钠放回原试剂瓶。
②钠失火的处理:干沙土盖灭,不能用水或泡沫灭火器灭火。
(2)钠与含有酚酞的水反应的现象及解释。
(3)钠与盐反应与盐溶液反应与熔融盐反应如Na投入CuSO4溶液中,反应的离子方程式为2Na+2H2O+Cu2+===2Na++Cu(OH)2↓+H2↑。
4Na+TiCl4=====,熔融Ti+4NaCl。
(4)与酸、乙醇反应和C2H5OH反应和H2O反应和稀酸反应反应原理2Na+2C2H5OH→2C2H 5ONa + H2↑2Na+2H2O===2NaOH +H2↑(和水电离的H+反应)2Na+2HCl===2NaCl +H2↑(和酸电离的H+反应)反应速率v(酸)〉v(H2O)>v(C2H5OH)3.钠的制取、保存及用途(1)制取:化学方程式为2NaCl(熔融)错误!2Na+Cl2↑.(2)保存:密封保存,通常保存在石蜡油或煤油中.(3)用途。
2020届高三化学第一轮复习精品学案(紧扣考纲·精华版)镁和铝高中化学第三讲 镁 铝及其化合物【考纲要求】1.把握镁和铝单质的化学性质,并重点把握镁和铝的特性;2.把握镁和铝的化合物的性质,并重点把握铝及其化合物的两性;3.注重图像在化学解题中的应用。
教与学方案 笔记与反思【自学反馈】一〕镁和铝的复习 1.镁和铝的性质 镁铝周期表中位置第三周期ⅡA 族第三周期ⅢA族金属性镁强于铝结构单质还原性镁强于铝物理性质共性:密度小熔点较低,硬度较小银白色金属.不同点:Al 的上述性质都比镁略高.1.跟O 2及其它非金属反应2Mg+O 2点 燃2MgO 3Mg+N 2点 燃Mg 3N 24Al+3O 2点 燃2Al 2O 32Al+3S ∆Al 2S 32.跟某些氧化物2Mg+CO 2点 燃2MgO+C 2Al+Fe 2O 3 ∆2Fe+Al 2O 3 (铝热反应)3.跟水反应Mg+2H 2O ∆Mg(OH)2+H 2↑(冷水慢,沸水快)很难反应4.跟酸的反应Mg+2H +Mg 2++H 2↑2Al+6H +2Al 3++3H 2↑(在浓H 2SO 4、浓HNO 3中钝化)化学性质2. 铝与强碱溶液反应的实质反应过程:(1) (2)Al 与水专门难反应,且生成的Al(OH)3附在Al 的表面,阻止了Al 连续反应,但强碱NaOH能溶解Al(OH)3,故可促使Al与强碱液反应,而弱碱如氨水,不溶解Al(OH)3,故Al在弱碱溶液中不反应。
2. 镁和铝的氧化物的要紧性质(1)MgO具有性氧化物的性质,写出相关的化学方程式〔2〕Al2O3具有性氧化物的性质,写出相关的化学方程式3. 镁和铝的氢氧化物的要紧性质〔1〕Mg〔OH〕2具有氧化物的性质,写出相关的化学方程式〔2〕Al〔OH〕3具有氧化物性质,写出相关的化学方程式4. 重要的铝盐:明矾:十二水合硫酸铝钾[KAl(SO4)2·12H2O]a.结构:硫酸铝钾是由两种不同的金属离子和一种酸根离子组成的化合物,它电离时能产生两种金属的阳离子,是一种复盐。
【2019-2020】高考化学一轮复习铝、镁的性质及应用学案(含解析)李仕才基础知识梳理1.铝的结构和存在铝位于元素周期表第三周期ⅢA 族,原子结构示意图为。
铝是地壳中含量最多的金属元素。
自然界中的铝全部以化合态的形式存在。
2.金属铝的物理性质 银白色有金属光泽的固体,有良好的延展性、导电性和导热性等,密度较小,质地柔软。
3.金属铝的化学性质写出图中有关反应的化学方程式或离子方程式:①________________________________________________________________________。
②________________________________________________________________________。
③________________________________________________________________________。
④________________________________________________________________________。
答案 ①4Al +3O 2=====△2Al 2O 3②2Al +Fe 2O 3=====高温2Fe +Al 2O 3③2Al +6H +===2Al 3++3H 2↑④2Al +2OH -+2H 2O===2AlO -2+3H 2↑4.铝的用途纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
5.对比记忆镁的化学性质单质的性质、用途和制法(1)铝在自然界中有游离态和化合态两种形式( )(2)MgO与Al粉的混合物也可称为铝热剂( )(3)Mg粉与浓NH4Cl溶液反应放出H2和NH3( )(4)冶炼铝时常用焦炭作还原剂( )(5)1 mol Al与足量的硫酸或足量的氢氧化钠溶液反应转移电子数相同( )(6)铝与少量NaOH溶液反应得到铝盐,与足量NaOH溶液反应生成偏铝酸盐( )(7)相同质量的镁条分别在足量的CO2和O2中完全燃烧,所得固体的质量相同( )(8)工业上制造镁粉时,可将镁蒸气在N2中冷却( )答案(1)×(2)×(3)√(4)×(5)√(6)×(7)×(8)×依据Mg、Al单质的性质,思考回答下列问题:(1)铝的化学性质活泼,为什么日常生活中广泛使用的铝制品通常具有较强的抗腐蚀性能?(2)铝与酸、碱反应的实质是什么?氧化剂是什么?(3)镁在空气中充分燃烧,所得固体产物可能有________(用化学式表示)。
高中化学镁的性质教案
一、教学目标
1. 了解镁的基本性质和物理性质;
2. 掌握镁与水、氧气的反应特点;
3. 掌握镁的化学性质及其应用。
二、教学重点和难点
重点:镁的化学性质及其应用;
难点:化学性质与应用的联系。
三、教学内容
1. 镁的基本性质和物理性质;
2. 镁与水和氧气的反应;
3. 镁的化学性质及其应用。
四、教学过程
1. 导入
通过展示一块镁的样品,引导学生对镁的性质进行猜想和讨论。
2. 学习和讨论
(1)镁的基本性质和物理性质;
(2)镁与水的反应:让学生观察将镁片放入水中的反应过程,并引导学生总结镁与水的
反应特点;
(3)镁与氧气的反应:让学生观察将镁片点燃后与氧气反应的现象,并引导学生总结镁
与氧气的反应特点;
(4)镁的化学性质及其应用:通过案例分析,让学生了解镁在日常生活和工业中的应用。
3. 总结
对镁的性质和应用进行总结,并强调镁的重要性。
4. 练习与检测
让学生进行相关练习题,检测他们对镁的性质和应用是否掌握。
五、教学反馈
根据学生的表现和讨论情况,及时纠正错误,巩固学生对镁的性质的理解。
六、教学拓展
让学生自主探究其他金属的化学性质和应用,并进行小组讨论和展示。
七、板书设计
镁的性质
- 物理性质
- 化学性质
- 与水的反应
- 与氧气的反应
- 应用
八、教学反思
通过教学实践,不断完善教学设计,确保教学内容生动有趣,让学生通过实验和案例分析,深入理解镁的性质及其应用。
专题二镁及其化合物【考纲要求】1.知道Mg及其化合物的性质。
2.能规范解答以Mg及其化合物为载体的实验探究及化工题。
【教学重难点】镁及其化合物的化学性质及综合应用【教学内容】【重要知识点】一.物理性质1.镁:是一种的金属,密度,柔软,有较强的韧性、延展性和良好的、。
2.氧化镁:白色粉末,密度小,熔点,是制耐火材料的重要原料。
3.氢氧化镁:难溶于水,溶解度比MgCO3小。
4.氯化镁:易溶水,在空气中易潮,味苦。
二. 化学性质------镁及其重要化合物的转化关系【问题解决部分】1.根据上面物质的转化关系掌握相关物质的化学性质(用方程式或离子方程式表示)【习题部分】【题型一】镁的基本知识及应用1.镁着火时,可用于灭火的物质是( )A.干冰 B.氮气 C.水D.黄沙2.某同学通过系列实验探讨 Mg 及其化合物的性质,操作正确且能达到目的的是 ( )A.将水加入浓硫酸中得稀硫酸,置镁片于其中探讨 Mg 的活泼性B.将 NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成C.将 Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀D.将Mg(OH)2 沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体3.Mg3N2是一种在工业上应用非常广泛的离子化合物,呈微黄色,遇水发生水解反应,需密封保存。
某化学兴趣小组利用如下装置制取氮气,并用氮气制备Mg3N2。
回答下列问题:(1)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式:。
(2)C的作用是________ 。
该装置中发生反应的离子方程式为_______________ 。
C、D装置能否对调________(填“能”或“不能”)。
(3)写出E中发生反应的化学方程式:。
(4)Mg3N2的电子式_________;写出Mg3N2水解反应的化学反应方程式。
(5)实验结束后,取装置E的硬质玻璃管中的少量固体于试管中,加少量蒸馏水,把润湿的红色石蕊试纸放在管口,观察实验现象,该操作的目的是___________;再弃去上层清液,加入盐酸,观察是否有气泡产生,该操作的目的是__________________。
镁的性质及应用考点解读 1.镁的性质(1)物理性质:具有银白色金属光泽的固体,密度、硬度均较小,熔点较低,有良好的导电、传热和延展性。
(2)化学性质: A 、与非金属单质的反应①镁条在O 2中燃烧,发出耀眼的强光,生成白色固体物质,反应的化学方程式为2Mg +O 2=====点燃2MgO 。
②镁条能与N 2反应,化学方程式为3Mg +N 2=====点燃Mg 3N 2。
B 、与水或酸的反应①镁与水反应:镁不易与冷水反应,能与沸水反应Mg +2H 2O=====△Mg(OH)2+H 2↑。
②镁与酸的反应:镁是活泼金属,能与盐酸、稀硫酸反应放出H 2,反应的离子方程式为Mg +2H +===Mg 2++H 2↑。
C 、与某些氧化物的反应镁能在CO 2中燃烧,反应的化学方程式为2Mg +CO 2=====点燃2MgO +C 。
2.海水提镁沉淀Mg 2+→Mg 2++2OH -===Mg(OH)2↓↓制MgCl 2→Mg(OH)2+2HCl===MgCl 2+2H 2O ↓电解得Mg →MgCl 2(熔融)=====电解Mg +Cl 2↑ 3.用途生产合金,冶金工业上用作还原剂和脱氧剂。
镁合金:用于制造火箭、导弹和飞机的部件 镁:制造信号弹和焰火 氧化镁:耐高温材料 4.镁的重要化合物物质主要性质氧化镁碱性氧化物MgO+2H+===Mg2++H2O氢氧化镁中强碱Mg(OH)2+2H+===Mg2++2H2O难溶于水Mg2++2OH-===Mg(OH)2↓溶解度小于碳酸镁MgCO3+H2O=====△Mg(OH)2+CO2↑考向分析考向一、镁的性质及应用典例1.某同学通过系列实验探讨Mg及其化合物的性质,下列对整个过程说法正确的是( )A.将水加入浓硫酸中得到稀硫酸,置镁片于其中探讨Mg的活泼性B.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀D.将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体解析:选B 浓H2SO4稀释时应将浓H2SO4加到水中,A错误;过滤时应用玻璃棒引流,C 错误;由于MgCl2水解,故加热蒸干MgCl2溶液时得不到MgCl2固体。
考向二:镁及其化合物的转化关系典例2、某同学通过系列实验探讨Mg及其化合物的性质,操作正确且能达到目的的是( ) A.将水加入浓硫酸中得到稀硫酸,置镁片于其中探讨Mg的活泼性B.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀D.将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体【答案】B【解析】本题考查镁及其化合物的性质、常见的基本实验操作。
稀释浓硫酸时,应将浓硫酸沿着器壁或玻璃棒慢慢加入水中,并及时搅拌,A是错误的;过滤时需要用玻璃棒引流,因此C不正确;蒸发溶液时应该用蒸发皿而不是表面皿,由于MgCl2水解,所以加热时必需在HCl的气氛中加热才能得到MgCl2固体,所以D不正确。
方法指导:镁及其化合物的转化关系图考向三、镁的提取工艺及原理典例3、将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。
一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺流程提取其他产品。
回答下列问题:(1)下列改进和优化海水综合利用工艺的设想和做法可行的是________(填序号)。
①用混凝法获取淡水②提高部分产品的质量③优化提取产品的品种④改进钾、溴、镁等的提取工艺(2)海水提镁的一段工艺流程如下图:浓海水的主要成分如下:离子Na+Mg2+Cl-SO2-4浓度/(g·L-1) 63.7 28.8 144.6 46.4,产品2的化学式为________,1 L浓海水最多可得到产品2的质量为________g。
(3)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为___________________;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式______________________。
【答案】(1)②③④(2)Ca2++SO2-4===CaSO4↓ Mg(OH)2 69.6(3)MgCl 2(熔融)=====电解Mg +Cl 2↑ Mg +2H 2O=====高温Mg(OH)2+H 2↑【解析】 (1)利用混凝法只能除去海水中的悬浮物不能获取淡水,故设想和做法可行的是②③④。
(2)根据浓海水的成分及工艺流程可知,脱硫后的澄清液中主要含有Na +、Mg 2+、Cl -,则加入石灰乳发生反应,Ca(OH)2+Mg 2+===Ca 2++Mg(OH)2,经过沉降过滤,滤渣干燥得到产品2,即Mg(OH)2,滤液主要含有Na +、Cl -和大量的Ca 2+,用于浓海水脱硫,则脱硫阶段的主要离子反应为:Ca 2++SO 2-4===CaSO 4↓,即产品1为CaSO 4。
由表中数据,可知 1 L 浓海水中含有28.8 g Mg 2+,则最多可得到产品2的质量为:m Mg(OH)2]=28.8 g·L -1×1 L 24 g·mol-1×58 g·mol -1=69.6 g 。
(3)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为:MgCl 2(熔融)=====电解Mg +Cl 2↑,熔融MgCl 2中若有少量的水存在,则会发生Mg +2H 2O=====高温Mg(OH)2+H 2↑,从而造成产品镁的消耗。
对点训练1.下列关于镁的性质叙述正确的是( )A .能在空气中燃烧,但不能在二氧化碳中燃烧B .不能与氮气发生反应C .不与冷水反应,但与热水反应D .可用电解氯化镁溶液的方法来制取 【答案】C【解析】A .镁在空气中燃烧能和二氧化碳反应生成氧化镁和碳,故A 错误;B .镁和氮气反应生成氮化镁,故B 错误;C .镁较活泼,不和冷水反应,但和热水反应生成氢氧化镁和氢气,故C 正确;D .镁是活泼金属,工业是采用电解熔融氯化镁的方法冶炼,故D 错误;故选C 。
2.镁粉在焰火、闪光粉、鞭炮中是不可少的原料,工业上制造镁粉是将镁蒸气在某种气体中冷却.现有下列气体:①空气、②CO 2、③Ar 、④H 2、⑤N 2,其中可作为冷却气体的是( )A .①和②B .②和③C .③和④D .④和⑤ 【答案】C3.等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是( ) A.2mol/L-1 H2SO4溶液 B.18mol/L-1 H2SO4溶液C.6mol/L-1 KOH 溶液 D.3mol/L-1 HNO3溶液【答案】A【解析】A.镁、铝都和稀硫酸反应生成氢气;B.镁与浓硫酸(18mol/LH2SO4)反应生成SO2气体,铝与浓硫酸发生钝化(常温);C.镁不能和氢氧化钾反应,铝和氢氧化钾反应生成氢气;D.硝酸为强氧化性酸,和镁、铝反应不产生氢气;根据以上分析知,生成氢气最多的是稀硫酸,故选A。
4.向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液.下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)( )A. B.C. D.【答案】D5.世界上60%的镁是从海水中提取的,其提取步骤如下:①把贝壳制成生石灰;②向海水中加入生石灰,过滤,洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤;④在氯化氢热气流中加热晶体;⑤电解上述所得盐(熔融条件下)。
下列说法正确的是( ) A.向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净B.上述变化过程中包括了分解、化合、复分解、置换四种反应类型C.在氯化氢热气流中干燥晶体是为了加快干燥速度D.步骤⑤也可以采用电解该盐水溶液的方法解析:选A 洗涤液中如果含有Ca2+,滴加碳酸钠溶液会生成白色沉淀,所以可检验沉淀是否洗涤干净,A正确。
提取镁的过程中涉及的反应主要有:CaCO3CaO+CO2↑、CaO +H2O===Ca(OH)2、Ca(OH)2+MgCl2===CaCl2+Mg(OH)2↓、Mg(OH)2+2HCl===MgCl2+2H2O、MgCl2·6H2O MgCl2+6H2O↑、MgCl2(熔融)Mg+Cl2↑。
上述反应中没有置换反应,故B错误。
在氯化氢热气流中干燥晶体是为了抑制MgCl2水解,故C错误。
电解MgCl2溶液将得到氢氧化镁,故D错误。
6.等质量的金属镁分别在下列气体中充分燃烧:①O2、②CO2、③N2、④空气,燃烧后固体的质量分别是W1 g、W2 g、W3 g、W4 g,试比较它们的大小:____________。
答案:W2>W1>W4>W37.氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:(1)MgCO3与稀硫酸反应的离子方程式为______________________________________;(2)加入H2O2氧化时,发生反应的化学方程式为_ ______________________;(3)滤渣2的成分是___________________________;(4)煅烧过程存在以下反应:2MgSO4+C2MgO+2SO2↑+CO2↑MgSO4+C MgO+SO2↑+CO↑MgSO4+3C MgO+S↑+3CO↑利用如图装置对煅烧产生的气体进行分步吸收或收集.①D中收集的气体可以是_________(填化学式).②B中盛放的溶液可以是_________(填字母).a.NaOH 溶液 b.Na2CO3溶液c.稀硝酸 d.KMnO4溶液③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式 ________。
【答案】(1)MgCO3+2H+═Mg2++CO2↑+H2O (2)2FeSO4+H2O2+H2SO4═Fe2(SO4)3+2H2O(3)Fe(OH)3(4)① CO② d③3S+6OH-△2S2-+SO32-+3H2O。