手性药物合成举例之三
- 格式:ppt
- 大小:396.00 KB
- 文档页数:10


手性合成的综述姓名:学号:专业:院系:目录手性合成的概念与简介 (2)手性药物的合成的发展历程 (3)手性合成的方法 (5)几种手性药物合成方法的比较 (7)化学—酶合成法合成手性药物的实例 (7)手性药物的研究现状和展望 (10)参考资料 (13)手性药物的概念与简介手性(英文名为chirality, 源自希腊文cheir)是用来表达化合物分子结构不对称性的术语。
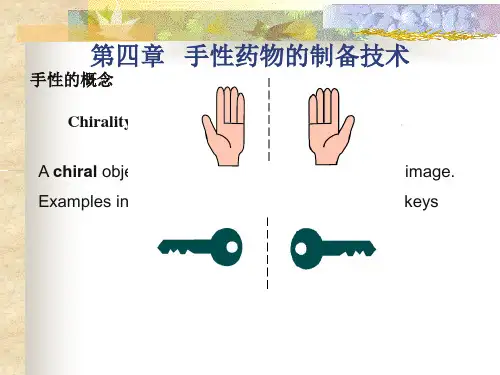
人的手是不对称的,左手和右手相互不能叠合,彼此是实物和镜像的关系,这种关系在化学中称为“对映关系”,具有对映关系的两个物体互为“对映体”。
化合物的手性与其空间结构有关,因为化合物分子中的原子的排列是三维的。
例如,图1中表示乳酸分子的结构式1 a和1 b,虽然连接在中心碳原子上的4个基团,即H, COOH, OH和CH3都一样,但它们却是不同的化合物。
它们之间的关系如同右手和左手之间的关系一样,互为对映体。
手性是人类赖以生存的自然界的本质属性之一。
生命现象中的化学过程都是在高度不对称的环境中进行的。
构成机体的物质大多具有一定空间构型,如组成蛋白质和酶的氨基酸为L-构型,糖为D-构型,DNA的螺旋结构为右旋。
在机体的代谢和调控过程中所涉及的物质(如酶和细胞表面的受体)一般也都具有手性,在生命过程中发生的各种生物-化学反应过程均与手性的识别和变化有关。
由自然界的手性属性联系到化合物的手性,也就产生了药物的手性问题。
手性药物是指药物的分子结构中存在手性因素,而且由具有药理活性的手性化合物组成的药物,其中只含有效对映体或者以有效的对映体为主。
这些对映异构体的理化性质基本相似,仅仅是旋光性有所差别,分别被命名为R-型(右旋)或S-型(左旋)、外消旋。
药物的药理作用是通过与体内的大分子之间严格的手性识别和匹配而实现的。
手性制药是医药行业的前沿领域,2001年诺贝尔化学奖就授予分子手性催化的主要贡献者。
自然界里有很多手性化合物,这些手性化合物具有两个对映异构体。



手性合成的综述姓名:学号:专业:院系:目录手性合成的概念与简介 (2)手性药物的合成的发展历程 (3)手性合成的方法 (5)几种手性药物合成方法的比较 (7)化学—酶合成法合成手性药物的实例 (7)手性药物的研究现状和展望 (10)参考资料 (13)手性药物的概念与简介手性(英文名为chirality, 源自希腊文cheir)是用来表达化合物分子结构不对称性的术语。
人的手是不对称的,左手和右手相互不能叠合,彼此是实物和镜像的关系,这种关系在化学中称为“对映关系”,具有对映关系的两个物体互为“对映体”。
化合物的手性与其空间结构有关,因为化合物分子中的原子的排列是三维的。
例如,图1中表示乳酸分子的结构式1 a和1 b,虽然连接在中心碳原子上的4个基团,即H, COOH, OH和CH3都一样,但它们却是不同的化合物。
它们之间的关系如同右手和左手之间的关系一样,互为对映体。
手性是人类赖以生存的自然界的本质属性之一。
生命现象中的化学过程都是在高度不对称的环境中进行的。
构成机体的物质大多具有一定空间构型,如组成蛋白质和酶的氨基酸为L-构型,糖为D-构型,DNA的螺旋结构为右旋。
在机体的代谢和调控过程中所涉及的物质(如酶和细胞表面的受体)一般也都具有手性,在生命过程中发生的各种生物-化学反应过程均与手性的识别和变化有关。
由自然界的手性属性联系到化合物的手性,也就产生了药物的手性问题。
手性药物是指药物的分子结构中存在手性因素,而且由具有药理活性的手性化合物组成的药物,其中只含有效对映体或者以有效的对映体为主。
这些对映异构体的理化性质基本相似,仅仅是旋光性有所差别,分别被命名为R-型(右旋)或S-型(左旋)、外消旋。
药物的药理作用是通过与体内的大分子之间严格的手性识别和匹配而实现的。
手性制药是医药行业的前沿领域,2001年诺贝尔化学奖就授予分子手性催化的主要贡献者。
自然界里有很多手性化合物,这些手性化合物具有两个对映异构体。

手性合成方法在药物合成中的应用手性化学是现代有机化学中的一个重要分支,随着医药行业的不断发展,手性合成方法在药物合成中的应用也越来越广泛。
手性合成是指生成手性化合物的合成方法,通俗来讲就是合成单一手性异构体的化学合成方法。
手性合成在药物合成中的应用已经成为许多药物合成的首选方法,本文将介绍手性合成方法在药物合成中的应用以及其优缺点。
手性化学的重要性手性化合物因其空间结构的不对称性,在药物学中具有重要的作用。
许多药物分子都是手性分子,它们的生物活性和药效都是由其立体结构决定的。
以最广泛的手性药物——阿司匹林为例,阿司匹林是由丙酸和水合氧化铁经过一系列化学反应后得到的,其中丙酸分子里有一个手性碳中心,总共有两种立体异构体,其中一种具有丰富的生物活性,而另一种则没有生物活性。
因此,如果我们想让阿司匹林产生丰富的生物活性,那么必须控制其手性。
然而,一些手性化学合成的挑战包括:合成单一手性异构体的成本过高,化学分离方法面临着困难,而且手性化合物的生产效率较低。
基于这些限制,开发出有效和可行的手性合成方法就显得非常重要。
手性化合物的制备需要控制其立体构型,通常要在合成操作中控制立体化学过程。
在药物合成中,业界已经发展出很多种手性合成方法,下面将介绍一些主要的手性合成方法及其适用范围:1.立体选择性配体辅助制备(SLA)SLA方法是目前应用最为广泛的手性合成方法之一。
在这种方法中,底物(通常是不对称的)被配合到手性配体上,形成新的手性化合物。
这个手性化合物与底物之间的反应组成了一系列的不对称反应,最终得到手性选择性较高的化合物。
SLA方法的优点是选择性高,反应良好,可以制备出一定量、高纯度和可控性的化合物。
但是,该方法在产量、环境友liness和经济性方面存在一些限制。
2.手性诱导手性诱导是一种手性合成方法,在这种方法中,分子间作用力使两个不对称部分保持相同的构型。
该方法能够改善分子的立体选择性并减少不需要的立体异构体的生成。

手性药物在自然界中,手性分子的存在是非常普遍的,造物主也似乎十分偏爱手性分子。
像我们已知的自然界中所有的天然糖类都是D型,所有的天然氨基酸为R型,蛋白质与DNA的结构都为右螺旋。
因此对于具有旋光性质的手性药物,不同的分子结构也会在生物体内引起不同的分子识别。
很多时候,我们所研制的未经手性拆分的外消旋体药物只有一个异构体有疗效,另一个或者是疗效较弱,或者有其他作用,当然也有可能有极大的副作用。
比如S-氯胺酮(ketamine)的麻醉作用是R-氯胺酮的1/3,但致幻作用较R型强;还有丙氧芬的两个立体异构体:(2R,3S)是镇咳药,(2S,3R)是止痛药。
但遗憾的是,曾经人们并没有意识到这个巨大的问题,因而导致的20世纪50年代沙利度胺致畸的惨痛教训。
研究表明,沙利度胺的(R)-对映体具有缓解孕妇呕吐的镇静作用,但(S)-对映体则有很强烈的致畸作用。
在药物的合成上,不同光学异构体往往是将其看做完全不同的化合物来加以研究,因此做到手性的拆分或者直接催化合成单一的对映体就是世界的药物科学家致力解决的问题。
在研究过程中,William S.Knowles, K.BarryShapless和RyojiNoyori三位化学家做出了卓越的贡献被授予了2001年的诺贝尔化学奖。
William S.Knowles的主要贡献是首次使用被手性膦化物取代的三苯基膦作为不对称氢化催化剂证明了催化不对称反应是可行的,并且成功的利用DiPAMA与Rh配合形成的Rh(DiDOPA)作为催化剂实现了L-DOPA的工业化生产,为帕金森病的治疗提供了巨大的福音。
同时也开创了药物不对称合成的先河。
RyojiNoviri的研究紧随其后,他在1980年就二膦配位体Rh-BINAP的合成进行了论述,并且用于了L-薄荷醇的工业生产,带来了巨大的经济效应。
此外改造的Ru-BINAP适用于更多的具有其他官能团的分子发生氢化反应,异构体率更高,为工业化生产奠定了基础。


化学合成中的手性控制技术手性是指物质的非对称性质,即左右对称性不同。
手性分子是指与它们的镜像像不重合的分子(类似左手和右手),也被称为立体异构体。
手性分子在自然界中普遍存在,但它们具有不同的生物学活性。
因此,形成一种特定手性的分子是化学合成中的一个重要挑战。
化学家们采用各种手性控制技术来合成单一的手性分子,其中包括对称物的拆分、对映选择性合成、对映异构体的分离等。
手性控制技术之一:对称物的拆分对称物的拆分技术是一种重要的手性控制方法,利用其对称性容易混合为镜像成像对称的立体异构体。
这种方法的基本思想是将对称物拆分成两个非对称分子,然后处理其中一个非对称分子,获得单一手性的产物。
最常见的对称物是二元醇和α- 酮酸。
二元醇拆分通常使用转化为二留脱基反应或手性酶催化拆分。
α-酮酸拆分则是将其转化为异构双酐、亚胺或烯醇,然后进行各种反应得到单一手性的产物。
手性控制技术之二:对映选择性合成对映选择性合成是化学合成中最常用的手性控制方法,它指的是合成分子的特定手性构型。
在有机化学中,对映选择性合成通常采用不对称合成方法。
这些方法包括手性药物催化剂、手性配体、手性试剂和手性多孔材料等。
手性药物催化剂通常是一种有效合成手性化合物的方法。
手性配体则是将于底比对映体选择性配位的化合物。
手性试剂包括手性亚砜和手性二醇等,可用于反应中选择单一手性的配体。
手性多孔材料则可以有效地选择性去除具有一定手性的分子,从而实现对映选择性反应。
手性控制技术之三:对映异构体的分离对映异构体的分离是手性控制中三种常用方法中最常见和容易实现的方法,它是通过分离手性分子的两种镜像像来实现的。
传统的单一手性柱层析、手性逆相层析、手性萃取剂抽提等技术被广泛应用。
新型手性分离材料如手性金属配合物、手性多孔材料以及手性膜等亦在不断出现,为手性控制技术带来新的突破。
结语手性控制技术在有机合成中具有重要的应用价值。
在人类历史上,手性药物和农药的不同手性构型的效果被广泛研究,探究其机制已成为合成有用手性化合物的重要方法之一。

手性药物的合成与药理学研究手性药物的合成与药理学研究引言:手性药物是指分子结构中存在手性中心,存在两个或多个异构体,且不同异构体对生物体产生不同的药理效应的药物。
手性药物的合成与药理学研究是药物化学与药理学领域的重要研究方向,对于药物研发、合成和临床应用具有重要意义。
本文将从手性药物的合成方法、手性药物的药理学研究以及手性药物的临床应用等方面进行探讨。
一、手性药物的合成方法:手性药物的合成方法主要包括对映选择性合成、手性催化合成和手性分离等。
对映选择性合成是通过选择性合成某个手性异构体,或通过合成手性前体后再进行手性转化来制备手性药物。
常用的方法包括对映选择性还原、对映选择性氧化、对映选择性取代等。
手性催化合成是利用手性催化剂催化反应,使得反应产物中生成手性异构体。
常用的手性催化剂包括手性有机催化剂、手性金属催化剂等。
手性分离是将手性药物中的手性异构体分离出来,常用的方法有晶体分离法、液相色谱法、气相色谱法等。
二、手性药物的药理学研究:手性药物的药理学研究主要包括对手性异构体的药效学、药代动力学和药物相互作用的研究。
药效学研究是研究不同手性异构体对生物体的药理效应和作用机制。
药代动力学研究是研究不同手性异构体在生物体内的吸收、分布、代谢和排泄等过程。
药物相互作用研究是研究不同手性异构体与其他药物或生物体内分子的相互作用,包括药物相互作用的强度、机制和影响等。
三、手性药物的临床应用:手性药物的临床应用主要包括药物研发和药物治疗。
手性药物的研发是为了寻找更有效、更安全的药物,通过对手性异构体的研究,可以选择性地设计和合成具有理想药效的手性药物。
药物治疗是利用手性药物对疾病进行治疗,手性异构体的选择将直接影响药物的疗效和副作用。
临床应用中,对手性药物的药代动力学和药物相互作用的研究也是十分重要的,可以指导药物的用量和用药方案。
结论:手性药物的合成与药理学研究对于药物研发和临床应用具有重要意义。
通过对手性药物的合成方法的研究,可以提高手性药物的合成效率和产率。
手性药物及其不对称催化合成摘要:本文介绍了手性及发展手性药物的重要性;叙述了手性药物的合成方法,并且结合实例对化学不对称催化技术合成手性药物作简要概述,包括不对称催化氢化、不对称催化氧化、不对称环丙烷化、不对称催化羰基还原、不对称催化羰基合成等;对不对称催化反应在手性药物合成中存在的问题,展望了其发展方向。
1.手性及发展手性药物的意义手性是人类赖以生存的自然界的最重要的属性之一。
手性是指与碳原子相连的4个原子或基团以两种形式形成空间排列不同结构不同的对映体,互成镜像,彼此对称而不重合。
就像人的左手和右手相互不能叠合,彼此是实物和镜像的关系,这种关系在化学中称为“对映关系”,具有对映关系的两个物体互为“对映体”。
作为生命活动重要基础的生物大分子,如蛋白质、多糖、核酸和酶等几乎全是手性的,如组成蛋白质和酶的氨基酸为L-构型,糖为D-构型,DNA的螺旋结构为右旋。
在机体的代谢和调控过程中所涉及的物质(如酶和细胞表面的受体)一般也都具有手性,在生命过程中发生的各种生物-化学反应过程均与手性的识别和变化有关。
因此,手性在生命过程中发挥着独特的功能。
在人和其他生物体系的复杂手性环境中,手性分子的精确识别有可能导致手性体系产生宏观的物理与化学性质的变化以及生理反应,手性药物就是最为典型的例子[1-2]。
当手性药物分子作用于生物体时,不同构型的药物分子产生的对映相互作用往往是不同的,甚至是截然相反的,结果表现为截然不同的药理和毒理作用。
手性药物按其作用可分为3类:(l)异构体具有相似的药理性质,如异丙嗪(Promethazine)的2个异构体具有相同的抗组织胺的活性;(2)异构体中一个有药理活性,另一个则没有,如抗炎镇痛药茶普生(Naproxen),(S)一异构体的疗效为(R)一异构体的28倍,后者可认为没有活性;(3)异构体具有完全不同的药理作用,一个典型的例子是20世纪50年代末期发生在欧洲的“反应停”事件,孕妇因服用酞胺呱陡酮(俗称反应停)而导致海豹畸形儿的惨剧。
在有机合成中产生手性化合物的方法有4种:1.使用手性的底物2.使用手性助剂3.采用手性试剂4.使用不对称催化剂常常需要使用天然产物,如:氨基酸、生物碱、羟基酸、萜、碳水化合物、蛋白质等。
1.使用手性的底物这种方法局限于比较有限的天然底物如图,该化合物的硼氢化反应中,由于羟基的作用产生另外新的立体中心(反应从分子的背后发生)以下两个反应,第一个是由于羧基的控制得到相应的手性产物..另一个则是由于反应中间体烯醇阴离子的构象决定了构型2.使用手性助剂如图,在第一步使用LDA去质子化时,为了使得上边的醇锂和下边的烯醇锂相距最远,Z-异构体占优势,在下一步与EtI的反应中得以产生了立体中心。
类似地,用烯醇锆替代烯醇锂(使用LDA,ZrCp2Cl2)确保烯醇的构型,再和醛反应产生不对称中心。
这些反应多数通过手性助剂的金属原子和底物中已有手性的O、N等原子络合,之后再加入其他试剂实现不对称中心的形成。
这其中手性唑啉环是一个非常不错的手性助剂,它水解后可以生成一个羧基(潜在官能团)另外一个试剂是手性的3-烷基哌嗪-2,5-二酮(一个环状二肽,可由两个氨基酸环合生成),如图在羰基的α位进行不对称烷基化使用的是以下两种试剂A和B(B称为SAMP),如图,对环己酮的反应中采用A得到S异构体而采用B得到R异构体.在氨基的α位进行不对称烷基化使用的试剂如下二图,用胺和它们作用后再用LDA、MeI甲基化,最后用N2H4脱去助剂得到产物.还有一些有趣的反应如脯氨酸的α烷基化,涉及到一个立体化学的"存储"问题,经历了一个消失和再产生的过程::手性亚砜的作用:分离得到手性亚砜试剂和卤代烷作用后在下一步反应中诱导手性基团的产生,Al/Hg可以方便地除去亚砜基团。
3.采用手性试剂通过铝锂氢化物与手性二胺或氨基醇作用可以得到一个用于不对称还原的试剂。
如图。
利用α-蒎烯和9-BBN作用得到的试剂是一个很好的不对称还原试剂.如图不对称硼氢化反应也是一个很好的构造立体化学中心的反应。
药物催化合成案例
药物催化合成是指利用催化剂加速药物合成反应的过程。
以下是一个药物催化合成的案例:
案例名称:手性药物——紫杉醇的合成
目标药物:紫杉醇
手性药物简介:紫杉醇是一种具有抗癌活性的手性药物,其结构中包含一个手性中心。
由于手性药物的生物活性与其立体构型密切相关,因此合成具有特定立体构型的手性药物是药物研发的关键步骤之一。
合成方法:采用催化不对称合成法,通过手性催化剂控制反应的立体选择性,以获得具有所需立体构型的手性紫杉醇。
该合成方法使用一种手性钛络合物催化剂,该催化剂能够与底物发生配位作用,并控制反应的立体化学性质,从而生成具有所需构型的手性紫杉醇。
该合成方法的优点包括:高选择性、高效率、环保等。
与传统合成方法相比,该方法避免了繁琐的分离和纯化步骤,减少了原料和能源的消耗,降低了生产成本。
总之,药物催化合成是一种高效、环保的药物合成方法,有助于降低生产成本、提高生产效率,促进药物研发和生产的可持续发展。