从确认靶点到获批上市肺癌药crizotinib诞生记
- 格式:docx
- 大小:188.40 KB
- 文档页数:7
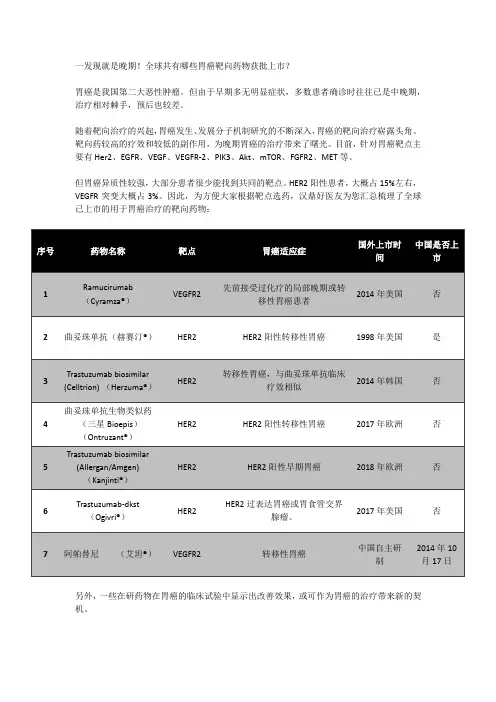
一发现就是晚期!全球共有哪些胃癌靶向药物获批上市?胃癌是我国第二大恶性肿瘤。
但由于早期多无明显症状,多数患者确诊时往往已是中晚期,治疗相对棘手,预后也较差。
随着靶向治疗的兴起,胃癌发生、发展分子机制研究的不断深入,胃癌的靶向治疗崭露头角。
靶向药较高的疗效和较低的副作用,为晚期胃癌的治疗带来了曙光。
目前,针对胃癌靶点主要有Her2、EGFR、VEGF、VEGFR-2、PIK3、Akt、mTOR、FGFR2、MET等。
但胃癌异质性较强,大部分患者很少能找到共同的靶点。
HER2阳性患者,大概占15%左右,VEGFR突变大概占3%。
因此,为方便大家根据靶点选药,汉鼎好医友为您汇总梳理了全球已上市的用于胃癌治疗的靶向药物:另外,一些在研药物在胃癌的临床试验中显示出改善效果,或可作为胃癌的治疗带来新的契机。
注:未完全统计近年来,以免疫检查点抑制剂为代表的免疫治疗已经彻底颠覆了晚期肿瘤的治疗模式。
在胃癌组织中也观察到了PD-L1的过表达,使抑制PD-1通路成为治疗胃或胃食管结合部癌患者的新靶点。
帕博利珠单抗(Keytruda):在既往接受治疗的胃癌患者中,具有抗肿瘤活性和可控的安全性。
由于疗效良好,获FDA批准用于治疗表达PD-L1(CPS≥1)的接受两种或以上治疗后进展的复发性局部晚期或转移性胃或胃食管结合部腺癌患者。
2018年7月中国获批上市,用于一线治疗失败的不可切除或转移性黑色素瘤,针对胃癌国内有临床试验在研。
纳武利尤单抗(Opdivo):在日本已获批用于化疗后进展的不可切除的晚期或复发性胃癌,无论患者的PD-L1状态。
此外,在美国,基于KEYNOTE-059研究,获批用于PD-L1表达阳性的胃癌和胃食管交界部癌。
2018年6月中国获批上市,用于治疗非小细胞肺癌,针对胃癌国内有临床试验在研。
12月17日,首个国产PD-1单抗——特瑞普利单抗注射液(商品名:拓益)上市,用于治疗既往标准治疗失败后的局部进展或转移性黑色素瘤。

2021.v5版⾮⼩细胞肺癌NCCN指南新鲜出炉!⼗⼤靶点治疗⽅案更新解读!NCCN全称美国国⽴综合癌症⽹络(National Comprehensive Cancer Network ),每年都会发布各种恶性肿瘤临床实践指南,已成为全球临床医师遵循和认可的临床治疗标准和参考,意义重⼤。
2021年6⽉,NCCN官⽹将⾮⼩细胞肺癌(NSCLC)的临床实践指南更新⾄第五版,主要是两⼤重磅抗癌新药JNJ-6372和AMG510接连提前获批上市,实现了EGFR 20ins和KRAS两⼤靶点0靶向药的突破,对肿瘤患者意义重⼤,指南及时将这些抗癌“特药”纳⼊指南,给病友们带来新的选择和希望。
全球肿瘤医⽣⽹医学部为病友们整理了指南更新的最新治疗⽅案,希望给⼤家带来帮助。
NCCN指南:⾮⼩细胞肺癌需要检测的⼗⼤靶点⽬前,⾮⼩细胞肺癌NCCN指南推荐肺癌患者应检测的靶点为EGFR(19del和L858R)、EGFR 20ins、KRAS G12C、ALK、ROS1、BRAF、NTRK1/2/3、MET、RET、PD-L1⼗⼤靶点。
注:最新版指南推荐的检测中,将敏感的EGFR突变阳性,分为EGFR突变阳性(19del和L858R),以及EGFR 20外显⼦插⼊突变阳性,此靶点之前没有专门获批的靶向药物,4代EGFR药物Amivantamab-vmjw上市,使得其成为可⽤药靶点,这是EGFR外显⼦20插⼊突变肺癌患者的⾸款靶向疗法,是医学届对于这部分患者的⼀项重⼤进步,具有⾥程碑式的意义!最新版指南推荐的检测中,增加了KRAS G12C阳性突变,此靶点堪称史上“最难治”靶点,研发40年终于在今年迎来新药AMG510这款重磅药物上市。
肺癌NCCN指南⼗⼤靶点治疗⽅案更新解读EGFREGFR(epidermal growth factor receptor,ErbB-1或HER1)全称表⽪⽣长因⼦受体。
主要在肺腺癌、亚裔、⾮吸烟及⼥性患者中,⼤约有 15% 的⽩种⼈和 30-50% 的亚洲⼈中有 EGFR 基因突变。

6年来FDA首次批准上市肺癌药物-Xalkori
佚名
【期刊名称】《药学与临床研究》
【年(卷),期】2011(19)5
【摘要】美国FDA日前通过简化程序批准了美国辉瑞公司研制的一种肺癌新药上市。
这是6年来FDA首次批准肺癌药物上市。
新药名为Xalkori,是一种激酶抑制剂,适用于间变型淋巴瘤激酶基因表达异常的晚期或局部转移的非小细胞肺癌患者,可以通过阻断对肿瘤细胞生长和存活起关键作用的多种细胞通路,使肿瘤保持稳定或消退。
【总页数】1页(P456-456)
【关键词】美国FDA;肺癌患者;药物上市;批准上市;肿瘤细胞生长;激酶抑制剂;基因表达异常;新药上市
【正文语种】中文
【中图分类】R95
【相关文献】
1.FDA批准首例用于治疗巨细胞动脉炎药物Actemra/FDA批准首个治疗ADHD
仿制药/FDA批准Ceritinib用于一线治疗ALK阳性的转移性非小细胞肺癌 [J],
2.降胆固醇药物立普妥的仿制药首次获FDA批准上市 [J],
3.美国FDA批准Xalkori(crizotinib)治疗一种罕见肺癌 [J], 夏训明
4.FDA首次批准艾滋病预防药物上市 [J],
5.FDA首次批准由转基因动物生产药物上市 [J],
因版权原因,仅展示原文概要,查看原文内容请购买。

肿瘤的靶向药物选择——国内外已经上市的分子靶向(MTT)药物...一、靶向药物(targeted medicine)简介靶向药物是目前最先进的用于医治癌症的药物,是随着今世分子生物学、细胞生物学的发展产生的高科技药物。
靶向药物与常规化疗药物最大的不同在于其作用机理:常规化疗药物通过对细胞的迫害发挥作用,由于不能准确识别肿瘤细胞,因此在杀灭肿瘤细胞的同时也会殃及正常细胞,所以产生了较大的毒副作用。
而靶向药物是针对肿瘤基因开发的,它能够识别肿瘤细胞上由肿瘤细胞特有的基因所决定的特征性位点,通过与之结合(或类似的其他机制),阻断肿瘤细胞内控制细胞生长、增殖的信号传导通路,从而杀灭肿瘤细胞、阻止其增殖。
由于这样的特点,靶向药物不仅效果好,而且副作用要比常规的化疗方式小得多。
靶向药物可以分为以下几类:(一)小分子药物小分子药物一般是信号传导抑制剂,它能够特异性地阻断肿瘤生长、增殖进程中所必需的信号传导通路,从而达到医治的目的。
例如诺华制药生产的格列卫(Gleevec,通用名Imitinib)、阿斯利康生产的易瑞沙(Iressa,通用名Gefitinib)均属此类;(二)细胞凋亡诱导药物通过特异性地诱导肿瘤细胞凋亡,达到医治的目的。
如美国千年制药公司生产的Velcade (通用名bortezomib)、Genta公司生产的Genasense(oblimersen);(三)单克隆抗体例如赫塞汀(Herceptin,通用名Trastuzumab),用于医治HER2基因阳性(过量表达)的乳腺癌。
这种药物是通过抗原抗体的特异性结合来识别肿瘤细胞的。
除上述列举的已经进入临床利用的靶向药物外,另外还有多种靶向药物正在开发中。
二、肿瘤的靶向药物上市历史回顾:■白血病费城染色体开启靶向医治之门早在1960年,美国费城的研究者发现慢性髓性白血病(CML)患者中存在一个染色体异样。
数年后,研究者发现这是9号和22号染色体长臂易位的结果。

鲁先平:平衡药物靶点药效和副作用的创新药研发思路剖析药品是一种特殊商品,关系人命,应立足于科学,而非政治、宗教和商业利益。
作为海归团队中的一分子,我们享受在创新研发中,用自己学习掌握的科学智慧去治病救人、服务于社会的过程。
虽然我国医药产业与发达国家的差距暂时还很大,但我们在原创新药、原料药和制剂的国际化方面,以及生物医药的知识产权和金融交易方面,都实现了从无到有,并不断发展和攀升。
我相信,在“大众创业,万众创新”浪潮中,高科技企业将迎来发展的春天,中国将涌现出更多原创企业和创新团队。
——鲁先平汇聚中国精神,研发经济可及原创药15年前,时任Galderma北美研发中心主任鲁先平博士及Nanogen项目首席科学家程京博士提议创建基于化学基因组学的新型药物发现公司。
3年后的2001年3月21日,由清华大学鲁先平教授、程京教授(2009年当选中国工程院院士)、宁志强博士等5位资深留美的跨国药企高管和大学教授在深圳成立微芯生物——一家生物高科技领先企业,专注于原创小分子药物研发,满足尚未满足的临床需求。
微芯的理念是“原创、安全、优效、中国”,致力于为患者提供经济可承受、全新机制的新颖药物。
“我们想做中国真正的原创药。
然而,原创药的开发风险是最大的,周期也是最长的。
理想很美好,过程很艰辛。
”深圳微芯生物科技有限责任公司的主要发起和筹建人,总裁兼首席科学官鲁先平说。
2001年我国国内生产总值(GDP)9.59万亿元,医药工业总产值2767亿元,医药工业总产值占GDP的2.88%,而美国和发展中国家的这一数字分别是9.0%和4.2%。
《药物发现自然评论》(Nature Reviews Drug Discovery)杂志2011年的文献显示,2003~2010年187个新药中,源自中国的新药(国家食品药品监督管理总局统计数字)有70种,但其中真正的原创药(First-in-class)寥若晨星。
2003~2010年,相关国际化合物专利授权的我国在研1.1类和1-2类化学药及1类生物药,在美国或欧洲获准进入临床研究阶段的仅有2个。

【药物名】Xalkori【商品名】Crizotinib(克唑替尼)【美国上市时间】o ROS-1阳性非小细胞肺癌;o FDA 批准的检测方法确定的间变性淋巴瘤激酶(ALK)阳性的局部晚期患者;上市时间:2011年【类别】酪氨酸酶抑制剂【靶点】ALK【分子结构】分子式:C21H22C l2FN5O化学名:(R)-3-[1-(2,6-Dichloro-3-fluorophenyl)ethoxy]-5-[1-(piperidin-4-yl)-1H-pyrazol-4-yl]pyridin-2-amine结构式为:分子量为:KDa【生产公司】Pfizer 辉瑞公司【购买地】美国【剂型和规格】口服胶囊,剂量为250mg和200mg。
250mg胶囊:硬明胶胶囊,大小0,粉色不透明帽和体,在帽上有“Pfizer”和体上“CRZ 250” ,60胶囊瓶:NDC 0069-8140-20。
200mg胶囊:硬明胶胶囊,大小1,白色不透明体和粉色不透明帽,帽上有“Pfizer”和体上“CRZ 200”,60胶囊瓶:NDC 0069-8141-20。
【本质】克唑蒂尼胶囊硬壳含250 mg或200 mg的克唑蒂尼胶体二氧化硅,微晶纤维素,无水磷酸氢钙,羟基乙酸淀粉钠,硬脂酸镁和硬胶囊胶囊壳为无活性成分。
粉红色不透明胶囊壳组分含明胶,二氧化钛,和氧化铁红。
白色不透明胶囊壳组分含明胶和二氧化钛。
印刷油墨含有虫胶,丙二醇,强氨水溶液,氢氧化钾,和黑色氧化铁。
【作用机理】克唑替尼是酪氨酸激酶受体包括ALK,肝细胞生长因子受体(HGFR, c-Met),ROS1(c-ros),和酪氨酸激酶(RON)的一种抑制剂。
易位可影响ALK基因导致致癌融合蛋白的表达。
ALK融合蛋白的形成导致激活和基因表达和增加细胞增殖有贡献信号的调节异常而生存肿瘤表达这些蛋白。
克唑蒂尼就是通过阻断对肿瘤细胞生长与存活起关键作用的多种细胞通路,导致肿瘤的稳定或消退。

2024年克唑替尼市场需求分析1. 介绍克唑替尼(Crizotinib)是一种常用的抗癌药物,属于酪氨酸激酶抑制剂(TKI)类药物。
它主要用于治疗ALK(成纤维母细胞生长因子受体激酶)重排阳性的非小细胞肺癌(NSCLC)和ROS1(ROS receptor tyrosine kinase)重排阳性的晚期非小细胞肺癌。
本文将对克唑替尼市场需求进行分析,为相关企业制定市场策略提供基础数据。
2. 市场规模克唑替尼是肺癌治疗领域的重要药物之一,其市场规模受多个因素影响。
根据数据显示,全球每年新确诊的非小细胞肺癌病例超过百万,其中约有5-7%的患者具有ALK或ROS1重排。
而这一患者群体中,大约有50%的患者适合使用克唑替尼进行治疗。
因此,克唑替尼在全球的市场潜力巨大。
3. 市场竞争目前,关于ALK或ROS1重排阳性的非小细胞肺癌治疗的选择有限,其中包括克唑替尼在内的几种药物,如氟西汀(Alectinib)和雷莫芦单抗(Ramucirumab)。
这些药物在临床研究和数据支持方面存在差异,因此在市场上存在一定程度的竞争。
除了药物本身的竞争,市场还受到价格、渠道和医保政策等因素的影响。
克唑替尼的价格较高,患者承担的治疗费用较大,这对市场需求带来一定压力。
此外,不同地区的医保政策对克唑替尼的报销情况也存在差异,这在一定程度上影响了患者的购买意愿和药物的市场份额。
4. 市场趋势近年来,克唑替尼的市场趋势呈现以下几个方面的特点:a. 个体化治疗需求增加随着分子生物学技术的发展,越来越多的肺癌患者能够通过基因检测明确其ALK或ROS1的重排情况,从而确定是否适合使用克唑替尼进行个体化治疗。
这使得克唑替尼在临床应用中的需求有所增加。
b. 临床研究不断深入克唑替尼作为一种新型抗癌药物,其在临床研究方面还有很大的发展空间。
目前,研究人员正在探索克唑替尼在其他肿瘤类型中的应用,如转移性胃肠道起源的肿瘤和乳腺癌等。
这些研究结果将进一步拓宽克唑替尼的市场需求。

肺腺癌基因突变靶点全文共四篇示例,供读者参考第一篇示例:肺腺癌是一种常见的恶性肿瘤,属于呼吸系统肿瘤的一种。
据统计,肺腺癌在所有恶性肿瘤中的发病率和死亡率均排名第一。
肺腺癌的发病机制十分复杂,其中基因突变是导致肺腺癌发生和发展的重要原因之一。
而基因突变靶点是允许医生精准干预的重要标志。
本文将对肺腺癌基因突变靶点进行详细介绍。
第一篇文章是关于EGFR基因突变靶点的研究。
EGFR(表皮生长因子受体)是肿瘤细胞生长和分化的重要信号传导通路之一,EGFR基因突变是肺腺癌中最常见的突变之一。
通过对EGFR基因的突变进行检测,可以明确患者对EGFR抑制剂的治疗反应,为临床治疗提供重要依据。
研究表明,EGFR基因突变靶点在肺腺癌的个体化治疗中具有重要作用,并且与肺腺癌的预后密切相关。
第二篇文章是关于ALK基因突变靶点的研究。
ALK(酪蛋白激酶)是一种重要的蛋白激酶,在肺腺癌中ALk基因突变是少数能够激活信号通路的突变之一。
目前,临床已经开发出针对ALK基因突变的靶向治疗药物,比如克唑替尼(Crizotinib)。
通过对ALK基因突变的检测,可以明确患者对靶向治疗的治疗效果,提高治疗的成功率,延长患者的生存期。
通过对肺腺癌基因突变靶点的研究,不仅可以更准确地评估患者的病情和预后,还能为临床治疗提供更为个体化的治疗方案。
随着对肿瘤基因突变的深入研究,相信肺腺癌的治疗水平将不断提高,患者的生存期也将得到进一步延长。
希望本文可以帮助更多的医生和患者了解肺腺癌基因突变靶点的重要性,推动肺腺癌的个体化治疗进程。
第二篇示例:肺腺癌是肺癌中最常见的一种类型,它起源于肺部的腺体组织。
肺腺癌的发病率逐年上升,给患者和家庭带来了严重的健康负担。
为了更好地了解和治疗肺腺癌,科学家们对其基因突变靶点进行了深入研究。
基因突变是导致肺腺癌发生的重要原因之一。
在肺腺癌的发展过程中,一系列基因的突变和异常表达会导致正常细胞发生恶性变化,最终形成肿瘤。

肺癌分子靶向药物治疗的研究进展分子靶向治疗是指针对参与肿瘤发生、发展过程的细胞信号转导和其他生物学途径的治疗手段,具有高效和低不良反应的特点。
随着近年来肿瘤相关研究的不断进步,在恶性肿瘤的个体化治疗和靶向治疗方面取得了令人瞩目的进展。
本文主要针对肺癌的分子靶向治疗研究进展进行概括总结。
标签:肺癌;血管内皮生长因子受体;表皮生长因子受体;肿瘤干细胞;肿瘤抑制基因肺癌是当前发病率和死亡率最高的肿瘤之一,80%以上患者就诊时已处于晚期,失去手术机会。
目前,肿瘤化疗已经处于治疗瓶颈,毒副反应大,有效率低,5年生存率不足15%。
近年来发展起来的靶向治疗,具备高效、低副反应等特点,已成为目前肺癌治疗的研究热点。
其作用靶点包括细胞内信号转导通道中重要的蛋白质、酶、细胞表面的生长因子受体,而广义的分子靶点则包括参与肿瘤细胞分化、凋亡、迁移、浸润、淋巴结转移、全身转移等过程的从DNA到蛋白酶水平的任何亚细胞分子。
1 血管内皮生成因子(VEGF)VEGF是一种细胞因子,它能诱导内皮细胞增生、蛋白酶的表达、抗内皮细胞凋亡和细胞重组,最终形成毛细血管。
在病理血管生成方面,它还能增强血管的通透性,形成不成熟的血管网络。
血管上皮生长因子能够刺激血管内皮细胞的增生,在大多数人体肿瘤组织中,VEGF的表达大大高于其他正常组织[1]。
研究证实贝伐单抗以VEGF作为靶点,具有一定的抗肿瘤作用[2]。
VEGF家族包含6个生长因子(VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E以及胎盘生长因子)和3个受体(VEGFR-1、VEGFR-2(KDR/FIk.1)和VEGFR-3)。
VEGF 的过度表达与肿瘤进展及不良预后相关。
目前针对VEGF途径的治疗包括抗VEGF单克隆抗体和VEGFR-TKI两大类。
1.1贝伐单抗(Bevacizumab)Bevacizumab即重组人抗VEGF单克隆抗体,可与VEGFR结合,阻断肿瘤血管的细胞信号转导,抑制肿瘤血管生长,抑制肿瘤细胞。

DOI:10.3969/j.issm1672-9463.2021.04.025•综述. ROS1融合基因突变非小细胞肺癌的诊断与ROS1抑制剂研究进展王大壮王泽雨陈立江王欣近年来随着社会日益进步,人类疾病也越来越复杂。
在众多疾病中,癌症的发病率与日俱增,已成为一种常见的疾病,且治疗难度较大。
诸多癌症中肺癌的发病率和致死率分别可达11.6%和18.4%[1],在我国更是居于首位。
其中非小细胞肺癌(NSCLC)占我国肺癌患者的80%囱,且大多数都是高龄患者,早期不重视,发现较晚,失去了手术机会,5年生存率很低叫常规的治疗方法包括手术、放疗和化疗等,效果欠佳,给患者带来巨大痛苦。
近年来随着个体化治疗理念的普及,靶向治疗非小细胞肺癌成为热点叫随着基因分析和基因检测技术的发展以及对相关致癌基因研究的逐步深入,表皮生长因子受体(EGFR)、间变性淋巴瘤激酶(ALK)等肿瘤相关靶点相继被检测出来,针对它们的靶向药物也相继上市。
这些靶向药物在临床中疗效良好,毒副作用明显降低,但也存在着长期使用后出现耐药的问题。
近年来,也不断有一些新的驱动基因被发现,如MET基因、HER-2及R0S1融合基因等,针对它们的靶向药物也在不断研发中。
ROS1基因是上世纪80年代于UR2鸟肉瘤病毒中发现的具有独特致癌作用的原癌基因,野生型的R0S1定位于染色体6q21上,共编码2347个氨基酸[5],尚未发现相应的活化配体,关于ROS1的生理功能也尚不清楚叫目前共发现了包括CD47等22种ROS1基因融合形式叫ROS1基因重排在非小细胞肺癌患者中的发生率为1%~2%,常见于年轻、不吸烟或少量吸烟的腺癌患者中,而且年龄偏小,多为女性、亚裔,与ALK阳性患者表型有着重叠性咲训,且有研究发现ROS1的进化过程与ALK密切相关,两者在激酶结构域内有49%同源性的氨基酸序列[11],目前已上市的ALK靶向抑制剂,大部分能有效控制ROS1融合患者的病情[12]0但由于ROS1基因重排在非小细胞肺癌患者中发生概率较低,这一分子亚型在治疗中常被忽视,目前还没有单纯针对ROS1融合突变的抑制剂,但是每年都出现大量的肺癌新病例,使得研究人员对ROS1抑制剂的开发更加关注,基于ALK和ROS1的激酶结构域的相似性,以及ALK靶向抑制剂对ROS1融合患者的治疗效果,开发ROS1靶向抑制剂或ALK/R0S1双重靶向抑制剂具有高度的可行性。

几种小分子c-Met抑制剂类抗肿瘤药物概述肖飞;彭红;金鑫;张婷【摘要】癌症现已成为社会家庭的严重负担,特别是对患者本身带来的精神以及生理上的痛苦是巨大的.由于小分子c-Met抑制剂类抗肿瘤药物具有耐受性好、对抗肿瘤的发生和转移的特点,使其迅速成为目前抗肿瘤药物研究的热点.这类药物中的c-Met抑制剂作用于c-Met受体,达到抑制c-Met结合域磷酸化,阻止酪氨酸激酶活化从而抑制下游信号传导产生抗肿瘤作用.本文主要就各种小分子c-Met抑制剂类抗肿瘤药物的研究概况进行阐述.【期刊名称】《江西中医药》【年(卷),期】2018(049)010【总页数】4页(P77-80)【关键词】c-Met抑制剂;抗肿瘤;磷酸化【作者】肖飞;彭红;金鑫;张婷【作者单位】江西中医药大学药学院南昌 330004;江西中医药大学药学院南昌330004;江西中医药大学药学院南昌 330004;江西中医药大学药学院南昌330004【正文语种】中文【中图分类】R285.5c-Met或称HGFR,是一种由c-Met原癌基因(主要存在于干细胞、祖细胞)编码的蛋白产物,它是一类具有高度亲和性的受体酪氨酸激酶,是肝细胞生长因子跨膜受体,具有酪氨酸激酶活性属于RON亚族[1]。
c-Met是由α链和β链相连而形成的异二聚体[2],主要表达于上皮细胞,也可见于内皮细胞、肝细胞、神经细胞及造血细胞,在胚胎发育和创伤愈合中发挥着重要作用。
肝细胞生长因子(HGF)是由间质细胞分泌的c-Met受体唯一配体。
c-Met受体在细胞的代谢、分化以及调亡的信号转导过程中起着重要作用,其与配体结合,可激活下游5条信号转导通路[3],如RAS/RAF、磷脂酰肌醇3激酶(PI3K)、信号转导与转录激活子(STAT)、Notch以及Beta-catenin,促进细胞有丝分裂、形态发生等生物学反应,从而参与胚胎发育、组织损伤修复、肝再生以及肿瘤的侵袭和转移。
c-Met信号通道和癌细胞耐药性相关[4],使得多靶点激酶抑制剂的开发获得理论支撑。
找到ALK钻⽯突变,战胜肺癌并不难!5种问世靶向药任选!间变性淋巴瘤激酶(ALK)融合基因,在肺癌中突变率为3%-8%,更多见于亚裔⾮吸烟的较年轻腺癌患者,常见的突变形式是EML4-ALK的融合。
ALK突变被称为“钻⽯突变”,原因是可选择的靶向药很多,且有些靶向药可逆转上个靶向药的耐药,因⽽可以获得更多的⽣存期。
今天Vicki就给⼤家汇总下⽬前常见的五种ALK激酶抑制剂。
如果基因检测报告有ALK融合突变,请记得必⾸选靶向治疗!ALK突变靶向药⼀代:克唑替尼⼀代:⼆代:⾊瑞替尼、阿来替尼、布加替尼⼆代:三代:三代:劳拉替尼研究中:ensartinib和repotrectinib(TPX-0005)研究中①药品名药品名:Crizotinib(Xalkori)中⽂名:克唑替尼(赛可瑞)中⽂名⽣产商:辉瑞(外)⽣产商其他靶点:ROS1和MET其他靶点中国上市:是,纳⼊医保中国上市②药品名:Alectinib(Alecensa)药品名中⽂名:阿来替尼(安圣莎)中⽂名⽣产商:罗⽒(外)⽣产商中国上市:是,未进医保中国上市③药品名药品名:ceritinib(Zykadia)中⽂名:⾊瑞替尼(赞可达)中⽂名⽣产商⽣产商:诺华(外)中国上市:是,未进医保中国上市④药品名药品名:Brigatinib(Alunbrig )中⽂名:布加替尼中⽂名⽣产商:武⽥(外)⽣产商中国上市:否中国上市⑤药品名药品名:Lorlatinib(Lorbrena )中⽂名:劳拉替尼中⽂名⽣产商⽣产商:辉瑞(外)中国上市:否中国上市⾃FDA批准克唑替尼以来,ALK阳性⾮⼩细胞肺癌患者的治疗有了很⼤的改善,⼤⼤延长了⽣存期。
近年来,⼜有多种ALK抑制剂获批,增加ALK阳性肺癌患者的治疗选择,同时,也正接受挑战,对于这些ALK靶向药,到底该⽤谁更获益!⼀分钟看全⽂!⽬前,对于ALK阳性的肺癌患者,⾸选治疗⽅案为克唑替尼,但⼊脑性不强。
如果出现耐药,再考虑⼆代ALK抑制剂阿来替尼或⾊瑞替尼或布加替尼。
肺腺癌的驱动基因及药物研发进展EGFR突变是NSCLC最常见的驱动基因,约10%的高加索NSCLC患者和30-40%的东亚NSCLC患者存在EGFR突变,EGFR突变在不吸烟肺腺癌患者中发生率较高。
大量临床研究已经证实EGFR-TKI一线治疗EGFR突变的晚期NSCLC患者的疗效优于化疗,NCCN指南推荐EGFR突变患者一线使用EGFR-TKI。
另一驱动基因ALK重排从2007年第一次发现它的第一个酪氨酸激酶抑制剂Crizotinib批准进入临床仅仅用了不到5年时间,目前,Crizotinib已被NCCN指南推荐作为ALK重排患者的一线治疗。
靶向药物在肺腺癌中的迅猛发展令人鼓舞,许多除EGFR 和ALK以外的驱动基因也不断地被发现并有可能成为下一个有效治疗靶点。
KRAS突变存在于15%~20%的NSCLC。
KRAS是RAS GTP酶家族的成员之一,可以通过Ras/Raf信号通路促进细胞的生长分化。
这些酶通过与GTP结合,发挥RAS家族的GTP酶活性,使GTP转化为GDP,从而使下游信号瀑布中的蛋白发生磷酸化。
当KRAS发生突变时(主要发生于外显子12[80%],13和61)降低了KRAS作为GTP酶的活性,使其具有致瘤的特性。
到目前为止KRAS被认为是预示化疗和靶向治疗疗效不佳的预测因子而非一个有效的药用靶点。
与结直肠癌不同的是,在NSCLC中KRAS突变与抗EGFR单克隆抗体耐药的相关性并不明确。
突变的KRAS与GTP的高亲和性限制了直接抑制KRAS的药物的研发和应用。
直到2013年,一种能与KRAS突变异构体结合的KRAS G12C抑制剂被报道,但这种药物的临床应用还有很长的路要走。
目前对于KRAS突变NSCLC患者的治疗策略主要集中于干扰其下游信号通路,如PI3K、MEK和FAK,都还处于临床研究阶段。
最具有临床应用前景的治疗策略是细胞毒性化疗药物与MEK抑制剂的联合应用。
多西他赛与口服MEK抑制剂Selumetinib联合治疗KRAS突变的NSCLC被证实在临床前模型中有效,并且在一项Ⅱ期临床研究中显示多西他赛联合Selumetinib疗效优于多西他赛单药,患者的有效率提高,PFS延长。
ALK 肺癌的靶向治疗药, 一代, 二代, 还是三代?Nov30先说一下ALK肺癌. ALK (anaplastic lymphoma kinase 间变型淋巴瘤激酶) 基因变异可能引发多种癌症, 当然, 顾名思义最先在ALCL (anaplastic large cell lymphoma 间变型大细胞淋巴瘤) 上发现. 约有六成ALCL病例都有NPM-ALK 基因融合 (第五染色体的NPM基因片段跳槽到第二染色体的ALK基因中间生成致癌融合激酶). 非小细胞肺癌大约有5%是源于EML4-ALK 基因融合 (同在第二染色体的EML4基因片段倒置后插入ALK基因导致致癌融合激酶的生成). 当然,也有其它染色体其它基因片段插入ALK 基因的致癌融合如KFG(Ch3), KIF5B(Ch10),KLC1(Ch14),但没有NPM-ALK.至于为何NPM-ALK不致肺癌,不得而知.EML4-ALK 基因融合也可致其它癌症,如肠癌,乳癌和肾癌.还有,ALK 基因点突变(大多是家族遗传型)可致儿科神经母细胞瘤.在肺癌中,ALK点突变可产生靶向药抗性,但还没有见原始致肺癌ALK点突变报道.这个致癌融合EML4-ALK激酶跟野生型ALK激酶区别在哪?简单说,野生型ALK激酶本无活性必须接受到信号譬如神经生长因子以后,才会自体磷酸化后激活下游促长信号,融合EML4-ALK激酶生来就有活性下游生长信号一直绿灯放行,日久天长癌症得生.那怎么办?水来土淹,我们可爱的医生药师化学家发明发现了不少的ALK-TKi,ALK激酶抑制剂.有那么几个抑制力强毒性相对小的进入了临床试验甚至已获批上市.下面重点介绍这些扑火救急的化合物.先严正申明,纯属我见毫无官方根据,千万不当医嘱.性命攸关啊!先从这个说起-TAE684,最早发现的高效ALK激酶抑制剂.TAE684 MW614.2诺华研究所2007年,于日本自治医科大学ALK肺癌发现报道几个月后,就发表了这个试验药的文章.文章显示了它IC50为13.3nM,尽管实验是用ALCL细胞和老鼠模型,诺华的目标非常明确,百亿千亿的肺癌用药市场,老诺公司当然不会让给任何一方.这么重要的分子还没临床就公开发表,肯定是它有问题.有效的分子啥问题-那我只能猜它就有毒.看看分子式,我就有点发毛.左边这个砜基(O=S=O)叫人担心啊.这可是有机磷农药的标准附件啊,也难怪,诺华前身不就汽巴嘉机CIBA-GEIGY农药巨头吗? 另外,这右边的一环又一环,有必要吗?分子量有点大啊!与此同时,辉瑞公司的顶尖化学家刻苦钻研,把手头的所有的受体Tyr 激酶对象都拿来在试管上来几遍,然后又老鼠上翻几翻,旨在拿下ALK 肺癌这块美肥市场.工夫不负天赋人,崔博士手中的PF-02341066原本设计是对付肝/肾癌的c-MET基因抑制剂,立马出头成了抗ALK肺癌明星. 虽然没有TAE684那么强大,鉴于它是双标靶药,毒性可忍受,08年中临床一期迅速展开,不久便有了奇迹般的病人肺癌全部消失的好运结果(好象是二号病人Kevin Brumett)和广又泛的激动人心的大批媒体报道.让末期肺癌病人的全身肿瘤消失,这可是全世界几千万肺癌病人第一次真正的听到了福音.三年后,FDA正式批准克药(crizotinib/ Xalkori)上市,创造了制药史上的速度奇迹.崔景荣博士现在回来看诺华,第一轮的竞争输给辉瑞了.急哪,可想而知R&D头儿们的压力.前面这么好的高效抑制剂那肯轻易放弃.毒性大我们整一整,弄个相对小的,分子量大我们尽量减一减,搞个小点.2011年他们的”二代”ALKi 粉墨登场,开始一期药试.我早就听说,它药力强大(IC50=15 nM),是与克药不同”代”的东西.可以想象,基本不会是crizotinib(IC50=300 nM)同路货.但我一直在找它的信息,看它与第”零”代的TAE684有何相关,直到2012年Alice Shaw不小心把分子量公布,我才明白LDK378是TAE684的同胞弟弟.我最大意见是,这个O=S=O原封不动啊,可见诺华有多么急功近利! 印象中Evan Spirito是一号试手-可敬勇士啊,Evan,安息吧,年轻的灵魂.不久以后,小公司ARIAD推出了AP26113,一样强大(IC50=11 nM)的”二代”ALKi药.跟TAE684,LDK378,还有其他公司的ALKi,GSK1838705A,CEP28122,都属于二氨基吡碇类,外表类似.但AP26113有没有改进?我说肯定是有的. O=S=O换成了P=O,这个值得赞扬,因为P=O是很”有机”的东西,SO2除了个别细菌喜欢,基本上是个无机有毒的玩艺,谁喜欢肚内出产硫酸亚硫酸物?这里我想带提一下不相干的EGFR-TKi, 凯美纳/icotinib.你别看它和特罗凯同样IC50,它半衰期才不到6小时,也就是说得分开吃六倍的量才有人家一倍的疗效,这就是为什么它试管内有特药的力人体内只有逊于易药的能,毒性相仿所以从科学角度它不代表任何进步.知识产权上也比较勉强甚至于暧昧.要是人类世界把钱废除了,我想次货凯美纳就不会存在,直接生产特罗凯不就得了.废话,把钱废除了你我还有可能得癌吗?最后一个有名有姓的抗ALK肺癌药是Alectinib,CH5424802. 这是日本人发明发现的一个完全新型的ALKi,结构骨架属BENZO(b)CARBAZOLE(AP和LDK,都是二氨基吡啶类DIAMINO PYRIMIDINE,克药是单氨基嘧啶 amino-pyridine骨架).初看这个分子式,吓人!那个”N≡-”可是氰基啊.不过,看清楚了,才明白,这个是直接挂在苯环上,是个很有机的氰基也就是说它得到释放变成无机剧毒氰离子的可能接近或等于零,所以不必担心.微量的氰食物中也是含有的.从我到目前听到的参试病人反馈信息中,这个是毒性最低的.日本情况不了解,美国一两年来,还没有听到有谁用出抗性的.也很怪,初看吓一跳,越细看越见好–它的分子中除了有机体必需的C/N/O碳氮氧之外没有任何其他可致毒的无机元素,譬如,氯,氟,硫等.好干净的分子,到底是小日本的产品. 这个分子看似很疏水,但代谢(还是排泄?)很快,半衰期较短.提起毒副作用,我得好好回顾一遍.这克药crizotinib我用了22个月,有点亲身体会啊.一开始上吐下泻幻影飘飘,闻这嗅那的口味怪怪,后来这些问题没了或我变习惯了.但我后期有两大问题,一是肾功能比较严重损伤,二是雄性物质Testosterone基本消失,最低达到98,接近女性体内雄激素的的高限.正常成年男性底限是240.好在我实质光棍一条,虽有骨转,也幸运没有太多骨损失.适合我的,从来就是给小孩们既当爹又当娘. 谈起crizotinib,少不了要加另外两条.一是1-2.5%病人的致命间质性肺炎.克药的第一号试药病人有可能是这个死的,但他上克时,病得太重,不好做结论.从后来报道看,致命ILD一直不断地在全球都有出现-我们存活谢完辉瑞和崔博士后,当多感谢造物主.另一条是克药的心脏副作用.有网上的病有告我,他心率从70 降到40 多.最近还有听说有中国病友瘁死于肺炎以外的因素,我怀疑可能是克药引发的心脏因素.感觉我好幸运啊. 最近的NY肺癌大会上,已有专家明确指出,crizotinib的官方建议剂量,250mg BID,对亚洲病人普遍太高,副作用太大,ILD等重大危险比较高.理论上讲,苯环上这一氟二氯确实叫人担心,连同苯环,它们的代谢物,伤肝伤肾伤内脏可能性挺大啊.说起LDK,我不得不说,从TAE684淘汰(=公开发表)到诺华推出LDK药试,三年多时间他们R&D干了啥?我敢肯定,他们团代没有中科大输送的才女才子,有的话也没有重用.上面提到的Evan Spirito,大约2011年七月开始试LDK378,一开始情况良好,数个月后(2011年11月初)突然去世.从来没有任何人提过他的死因,但去世前一个多月他抱怨有肺部感染.参试LDK人数不少了, 上反映有好有坏.最多的抱怨是肝毒性.750毫克的剂量,半数病人接受不了,需要减减量.问题是,它最佳药效剂量是750. LDK的另一先锋病人达芙女士(可能是二号),一米八几的高大身材,也叫苦不迭,数次减量休药,最终于己15个月后,退出药试返回化疗.有关LDK是读来听来的,AP26113我有自身体验(16个月了).副作用有吗? 有. 就一样,不小心会拉稀.小心以后,吃药时间和体内水分关系搞好了,很少很少机会拉稀. 其他副作用我没体会过. AP的第一病人也是瘁死,也是高度病重的垂危病人. 科州医生说法是它也会引发ILD,所以二期药试开初第一周剂量从180 降到90 了. 上面提到不少LDK试者要减量. AP相反,包括我在内,已有几位试者要求增量. 这就是副作用的区别.最后,也是最重要,谈谈正作用-药效. 前面提到克药虽然抑制ALK能力一般,但它可是双靶(ALK/MET)齐打. 一小部分病人用药不久就达到CR效果.在我身上,我的肿瘤从来没缩小,胸水也没消减,差不多有一年光景的SD(病情稳定)以后就开试看见病灶再度出现和长大.因为我在开始用克药之前被要求做全脑放射,所以比平均十来个月的受益时间要长.药试初期还期盼它能入脑,后来慢慢明朗了,克药基本没有控制脑转的能耐. 我停药时,最大脑瘤从放疗前的9mm已长到20mm. 前面的’奇迹’人物,Kevin Brumett,经历’奇迹’后不到一年,于09年5月因脑转失控去世. 总之,克药对脑以外ALK肺癌的控制能力还是令人满意的.对一小部分病人能迅速达到CR疗效,这个是不是与他们肿瘤的辅助/共同驱动基因(cMET)存在有关,不得而知,但我有这怀疑.因为控脑转能力微弱,克药和WBR全脑放射合用是很好的搭配.最新数据显示,CSF(脑脊液)中的克药浓度才是血液中的千分之三–可怜的低啊.LDK378 控制脑外和脑内ALK肺癌的能力都不错. 最初的报道总有效率达81%. 我认为这个数有水份.它MTD是750mg,剂量降至400mg以下有效率明显降低.由于毒性,它的总有效率,和平均有效期都有受影响. 今年初的报告中,总有效率降到了70%,平均有效期7.4个月.最新报告说有效率是57%.美国做研究有好多二流三流多流的,吹牛大家都是一流的.我好象没有看到过用LDK378达到CR的消息,有的话也是稀罕例子.声明一下,我是已知用AP26113达到CR至少三个病例的其中之一. 值得一提的是,AP26113 (LDK378理论上也是) 除了制约ALK以外还是一个胰岛素受体强效抑制剂.当然ALK本身也是属于类胰岛素生长因子受体.不知其他病人如何,在我身上,胰岛素受体被抑制的表现特别明显.我的血中胰岛素最高值,达到219(正常值范围是2-23),但我的血糖是正常的.这个是有目的的抑制(正作用),还是附带的结果(副作用)?我和医生提过.答曰,不是副作用.我臆想是,IGFR是我的ALK主导驱动肺腺癌的辅助促癌帮凶.我的肿瘤可能没有c-MET参与促长,所以吃克药没有CR/PR只有SD,但吃AP把主凶帮凶都打到了,CR自然就来了. 高胰岛素本来是一个非常危险的坏指标,在常人身上早已让人昏迷休克甚至灭亡,但我体内的胰岛素受体大多都给封口了,所以我’几乎’(没癌就可省去这两字了)就是个正常人. 胰岛素会催动有几个下游生化分子活性,譬如,淀粉酶,脂肪酶.我的消化能力好象是增强了,好事坏事? 但我至少没发胖啊. AP26113的控脑转能力被我的医生数次表扬,是否相对他们手中的LDK378药试而言,我没有细问. 赞扬LDK378脑转控制能力的评论稀有看到尽管它的试验开始得早,但抱怨LDK378服用半年左右脑转失控需要放疗的贴子在 上已有好几条.官方数据,目前为止,AP26113有效率是75%,平均有效期还有待统计. 我的脑转可能从第15个月开始有抗性产生,两周后再扫描时会重新评估.最新的来自欧文加大吴世康的报道,特别强调了CH5424802 (Alectinib) 的出色控脑转能力. 21个克药后脑转进展的病人,有17个得到了有效控制. 还有一点值得一提,以上其他三个药都有报道过有可能引发间质性肺炎ILD,CH5424802 试药两年来,日本和美国两地,都没有出过ILD. 有趣的是,日本推荐用量是300mg BID, 美国是600mg BID –这个可能因为美国参试大多数是用过克药后耐药的病人. 日本的二期有效率是93%,但参试的病人都是没有用过克药的. 目前为止,得不到日本病人反馈,还没有听说有抗性失效的个例. 美国这边,看到两个, 一个是用药4个月,发现肝转进展,暂时加用RFA 对付, 另一位是原肺病灶有活动,暂时加用放疗处理.这个药结构不同,与ALK结合时的挂钩方式也与CRIZOTINIB有较大区别,它的其他有效靶标包括LTK和GAK,但没有IGFR/ILGF-1R也基本没有c-MET. 我猜,AP/LDK后,CH5424802会对部分病人有效,它有望成第三代接班药.除了以上四个,还有这些在药试ASP-3026,TSR-011,CEP-37440, x-396. 好象没有特别值得一提的. 辉瑞的下一代抗ALK 药,PF-06463922,据说也是超级能主动进脑的设计,不久将开始一期临床. 打先锋的吹牛文章已把它预先捧上第三代宝座. 期待吧,病友们.。
印度靶向药名称和医治领域及不良反响常识肿瘤靶向药物是运用肿瘤细胞与正常细胞之间分子生物学上的区别(包含基因、酶、信号转导等不一样特性),按捺肿瘤细胞的成长增殖,最终使其逝世。
以下为多见肿瘤的靶向抗体药和注意事项:非小细胞肺癌靶向药1. 吉非替尼(gefitinib tablet)国内已上市靶点:EGFR医治:EGFR 骤变阳性或既往化疗的 NSCLC•不良反响:结膜炎、间质性肺病2. 厄洛替尼(Erlotinib)国内已上市靶点:EGFR、PDGFR、c-Kit医治:既往化疗失利的非小细胞肺癌、晚期胰腺癌(我国未获批)不良反响:间质性肺病、转氨酶增加、睫毛成长反常3. 埃克替尼(凯美纳 Icotinib )国内已上市靶点:EGFR医治:化疗失利的非小细胞肺癌不良反响:较轻4. 克唑替尼(塞克瑞 Crizotinib)国内已上市靶点:ALK、cMET、RON医治:ALK 阳性非小细胞肺癌•不良反响:视觉反常、肝毒性、外周神经病变、肺炎、QT 间期延伸5. AZD9291通用名即是叫Tagrisso 国内未上市靶点:T790M基因骤变医治:AZD9291首要用于医治晚期非小细胞肺癌,是对于T790M基因骤变的TKI类靶向药物。
不良反响:AZD9291 的副效果较细微,首要是肌肤红疹、指甲变色及拉肚子等。
6. 雷莫芦单抗(Ramucirumab)国内未上市靶点:VEGFR-2•医治:IV期非小细胞肺癌铂类化疗后的二线医治,晚期胃癌注意事项:中性粒细胞缺少性发热、出血、高血压、肝硬化、肠梗阻,创伤不愈合。
7.PD-1按捺剂(靶点PD-1):包含施贵宝的Opdivo(nivolumab),默沙东的Keytruda,百济神州PD-1按捺剂单克隆抗体BGB-A317。
对非小细胞肺癌病人均有极好的效果。
据调查,国内运用PD-1最多的是肺癌;其次是肝癌,以后是黑色素瘤,肾癌,肠癌。
(国内未上市)FDA已同意Cyramza联合多西他赛,用于既往经含铂化疗医治后病情恶化的搬运性非小细胞肺癌(NSCLC)病人的医治,临床效果较好。
过去十年,许多酪氨酸激酶抑制剂(TKI )药物已经在肿瘤领域应用,根据一篇最近的综述,看看截止到2013 年 8 月份,由FDA 和 EMA 批准的所有TKI 药物都有那些。
1、阿西替尼 (axitinib,Inlyta)在 2012 年 1 月 27 日获 FDA 批准治疗对其它药物没有应答的晚期肾癌(肾细胞癌),由辉瑞( Pfizer )公司开发。
阿西替尼是多靶点酪氨酸激酶抑制剂,具体用法为5mg空腹口服2/日。
2、克唑替尼(crizotinib,XALKORI)用于治疗 ALK 阳性的局部晚期或转移的非小细胞肺癌,推荐剂量和方案是 250 mg 口服每天 2 次。
3、达沙替尼(Dasatinib,施达赛Sprycel)治疗对包括甲磺酸伊马替尼在内的治疗方案耐药或不能耐受的慢性髓细胞样白血病。
FDA 也经正常程序批准达沙替尼治疗对其他疗法耐药或不能耐受的费城染色体阳性的急性淋巴细胞性白血病成人患者。
4、厄洛替尼(Erlotinib,特罗凯Tarceva )既往接受过至少一个化疗方案失败后的局部晚期或转移的非小细胞肺癌。
厄洛替尼单药用于非小细胞肺癌的推荐剂量为 150mg/ 日,至少在进食前 1 小时或进食后 2 小时服用。
5、吉非替尼(Gefitinib,易瑞沙Iressa )适用于治疗既往接受过化学治疗或不适于化疗的局部晚期或转移性非小细胞肺癌。
推荐剂量为250mg(1片)每日1次,空腹或与食物同服。
6、伊马替尼(Imatinib,格列卫)用于治疗慢性粒细胞性白血病( CML ),胃肠道间质瘤(胃肠道间质瘤)和其他一些疾病。
到 2011 年,该药已被 FDA 批准用于治疗 10 个不同的癌症。
7、拉帕替尼(Lapatinib;泰立沙Tykerb )联合卡培他滨治疗ErbB-2 过度表达的 ,既往接受过包括蒽环类, 紫杉醇 ,曲妥珠单抗(赫赛汀 )治疗的晚期或转移性乳腺癌。
推荐剂量为1250mg ,每日 1 次,第 1~ 21 天服用,与卡培他宾2000mg/d ,第 1~14 天分 2 次服联用。
从确认靶点到获批上市肺癌药crizotinib诞生记
酪氨酸激酶的一种——间变性淋巴瘤激酶(ALK)第一次被认定为潜在的癌症治疗靶点还是约在20年前。
那时,它作为与核仁磷酸蛋白(nucleophosmin)所组成的融合蛋白的一部分,被发现于间变性大细胞淋巴瘤(ALCL)的细胞中。
如今我们已知,这一融合蛋白的形成其实是染色体重排突变导致的,其导致的结果为ALK的异常激活,进而引发癌变。
然而,在肺癌领域,ALK直到2007年才被认为是潜在的治疗靶点。
那时,来自日本自治医科大学的间野博行(Hiroyuki Mano)教授发现,在6.7%的非小细胞肺癌(NSCLC)患者体内,ALK的胞内激酶结构域与EML4蛋白形成了融合蛋白。
在体外实验中,他的研究团队进一步表明,ALK的抑制剂WHI-P154能显着抑制表达有EML4-ALK融合蛋白的BA/F3细胞的生长。
基于这样的结果,间野教授认为,ALK是ALK阳性NSCLC的潜在治疗靶点。
这一成果最终发表在《Nature》期刊上。
形成ALK-EML4融合蛋白的基因重排
巧合的是,就在前一年,另一个ALK的小分子抑制剂刚刚进入临床试验。
这就是PF-02341066,也就是如今的上市药物crizotinib。
不过,crizotinib那时是作为受体酪氨酸激酶c-MET的抑制剂进入临床试验的,尽管人们那时也已知它同样可抑制ALK。
基于上述研究成果,有人认为,ALK在历经基因重排后对于crizotinib的敏感性可显着提高,因此可作为NSCLC的治疗靶点。
当
然,要想证明这一点并不容易,因为我们需要首先能够知道这些患者体内的ALK基因是否发生了重排突变,然后再去测试crizotinib等药物能否对他们起到疗效。
John Iafrate教授
可幸的是,来自麻省总医院(MGH)的John Iafrate教授很快找到了解决方案。
他的研究团队利用荧光原位杂交探针技术,开发出了SNaPshot检测法,能够迅速确定患者的肿瘤中是否存在ALK基因重排突变。
就这样,研究者们对NSCLC肿瘤进行了大规模分析,发现了多个可致癌的重排特征,并筛选出了携带相关突变的患者群体。
终于,在2007年12月,第一个ALK阳性的晚期NSCLC患者在临床试验中服用了crizotinib。
奇迹出现了——这位患者的症状很快就出现了明显缓解!
然而,这还不是此次试验唯一令人称奇的地方。
要知道,这距离间野教授那篇《Nature》论文的发表仅仅才过去四个月!
间野博行教授
就这样,在上述试验结果的激励下,大规模针对ALK阳性NSCLC
患者的筛选和招募工作在全球范围内展开。
他们将陆续进入crizotinib 的1期临床试验,以期获得一次重生的机会。
Crizotinib的有效性和安全性:获得FDA加速批准的基础
果不其然,在接下来的1期和2期临床试验中,crizotinib表现出了显着的疗效。
在一项161名ALK突变阳性NSCLC患者的1期临床试验中,crizotinib的客观响应率达到了61%。
从开始服药到显现疗效的中位数时间仅为8周,给试验者们留下了深刻的印象。
当试验进行到了2007年6月时,患者的中位无进展生存期达到10个月,这与EGFR抑制剂在治疗EGFR突变阳性晚期NSCLC的过程中所取得的数据相近。
紧接着,crizotinib初步的2期临床试验结果被公布于7月的底14届世界肺癌大会(WCLC)上。
在133名ALK阳性晚期NSCLC患者中,crizotinib的客观响应率达51%,12周时的疾病控制率达到74%。
Crizotinib结构
51%和61%,这样的客观响应率数据是十分令人鼓舞的。
要知道,参与上述1期试验中的大部分以及2期中的全部人员均为经治患者,而对于晚期NSCLC患者而言,标准的二线或三线化疗的客观响应率仅为10%。
不仅如此,crizotinib的安全性也是经得起考验的,大多数患者都能够承受它的副作用。
基于这样的结果,美国FDA于2011年8月加速批准了crizotinib 的上市,用于ALK阳性的晚期NSCLC的治疗,而这距离间野教授最初发现NSCLC中的ALK基因重排仅仅才过去四年!相信么?这就是从最初的靶点确认到药物最终上市所需的时间。
在这之后的2013年11月,crizotinib终于获得了FDA的正式批
准,商品名为Xalkori。
更为锦上添花的是,crizotinib的适应症在这之后还得到了进一步拓展。
今年三月,FDA批准该药物用于ROS-1基因突变阳性的晚期NSCLC的治疗,并授予其突破性疗法认定。
与ALK 一样,ROS-1基因同样编码着一种酪氨酸激酶。
Crizotinib带给患者的生存收益如何?
总生存率无疑是显示药物临床收益的最佳指标,同时也是最能反映其疗效的临床终点,crizotinib在这一点上也毫不逊色。
分析显示,1期临床试验中患者的总生存率得到了显着提高。
将crizotinib作为其二线或三线疗法的患者的一年期和二年期的总生存率分别达到了74%和54%。
相比之下,只接受了标准二线疗法的患者的这两项指标分别只有44%和12%,风险比为0.36。
当然你可能会说,也许ALK基因重排突变本身减轻了癌症的严重
性,从而有着更好的预后,而未必是crizotinib。
为了检验这样的可能性,研究者们专门比较了ALK和EGFR基因野生型以及两基因均发生突变的患者,在未服用crizotinib情况下的总生存率。
结果显示,二者之间没有显着区别。
值得注意的是,在NSCLC患者中,这两种基因未发生突变是较为普遍的情形,而这样的患者由于得不到靶向治疗通常预后较差。
我们该如何筛查和治疗ALK阳性的晚期NSCLC患者?
从crizotinib诞生的故事中我们可以看出,该疗法的关键在于能够筛查出ALK基因重排突变阳性的患者,让他们能够接受到高效且安全的治疗。
在很多的大型研究中心,很多晚期NSCLC患者都会接受这样的基因检测,从而为研究者积累了大量的患者数据。
通过对这些数据的分析,我们发现,ALK基因重排突变在某些特定群体中有着较高的发生率,尤其是那些未患有腺癌以及没有/少有吸烟习惯的年轻患者。
当然,ALK基因重排突变阳性在有着吸烟积习的患者群体中也是存在的,而这些患者同样获益于crizotinib。
可导致NSCLC的基因突变的概率分布
因此,我们显然应该尽可能多地为NSCLC患者进行基因检测。
如果实在做不到覆盖所有的患者,那么也应把有限的机会更多地留给不
吸烟或者少有吸烟的患者,除非已知他们携带有可被靶向治疗的EGFR 或KRAS基因的突变。
当被确定为ALK基因重排突变阳性后,这些患者便应当得到crizotinib的治疗。
值得注意的是,FDA并没有指定任何先期治疗作为使用crizotinib的前提条件,这说明任何新确诊的ALK阳性晚期NSCLC患者均可服用该药。
酪氨酸激酶抑制剂的作用机制
不过,像很多其他成功的靶向疗法一样,crizotinib也存在复发的问题,后者通常在开始服用一年后出现。
确实,获得性酪氨酸激酶抑制剂(TKI)抗性给crizotinib等靶向疗法带来了困扰。
如今,数种可导致抗性的机理都已被发现,包括ALK的酪氨酸激酶(TK)结构域上发生了某些新的突变。
要想应对这一问题,我们显然首先要弄清楚究竟发生了什么样的抗性突变,这就要求医生能够持续性地对复发患者进行取样分析。
这些分析结果对于后crizotinib阶段的治疗是至关重要的。
从最初的靶点确认到上市批准,靶向抗癌药物crizotinib只用了四
年,在制药史上留下光辉的一页。
我们希望crizotinib能够更多地造福于全球的癌症患者,继续为精准医疗的发展和推广做出贡献!
参考资料
[1] Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer.
[2] The Crizotinib Story: From Target to FDA Approval and Beyond
[3] FDA expands use of Xalkori to treat rare form of advanced non-small cell lung cancer
[4] FDA Approves Crizotinib。