有机化学 周环反应
- 格式:ppt
- 大小:2.08 MB
- 文档页数:62

第九章周环反应(协同反应)协同反应——(1)此类反应中无产生离子或自由基等中间活性体(2)不受催化剂或溶剂的影响(3)键的生成和断裂在一步中完成(4)可在热和光照下反应(5)立体专一性反应由于反应的过渡态是一环状结构,所以也称为周环反应。
周环反应是以轨道对称守恒原理为基础的,由Woodward提出。
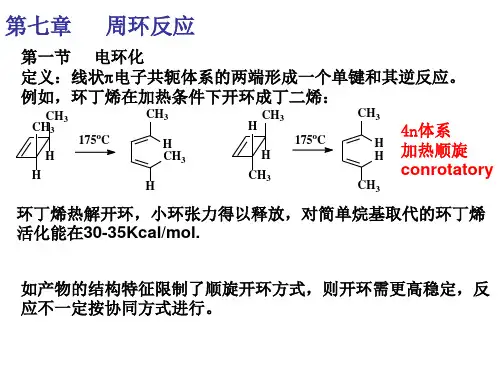
第一节分子轨道对称守恒定律1、术语:以乙烯分子为例:21反键轨道成键轨道分子轨道用波函数来表示:对乙烯分子π轨道来说,它有一个对称因素:为面对称(成键轨道S),而对反键轨道来说是反对称(A)C1对称:Symmetry波函数的数学符号相同,S 面:对映关系轴:转180°反对称:Antisymmetry波函数的数学符号相反,A轴C1:二个碳原子的连线轴C2:两个平面乙烯面与m平面的交线节点:将符号相同的波函数相连与C1轴的交点乙烯的π型分子轨道、节点数和对称性总结为:反键轨道成键轨道轨道节点数对称性21m C2A SS A 节面节点的物理意义:(1)节点越多,说明该轨道的能级越高不安定因素(2)节点处的电子密度等于零对Ψ1来说:是π电子的最高占有分子轨道(HOMO)high occupied molecule orbit *不是说满轨道,只要有一个也是占有最高占有轨道的电子束缚得最松弛,具有给电子的性质,最易激发到最低空轨道,因此这二个轨道为Ψ2是最低的空分子轨道(LUMO)low unoccupied molecule orbit 前线轨道(前沿轨道)对电子的亲和力较强,具有接受电子的性质丁二烯的分子轨道及其对称性:节点数 对称性 m C 23210A S S A A S S A21己三烯的分子轨道及其对称性321节点数 对称性 m C 2543210A S S A A S S A A S S A当最高轨道HOMO 的电子受到光的吸收光子的能量发生跃迁,到最低空轨道时,那时该轨道就变成HOMO 了基态:未激发的HOMO激发态:激发的HOMO ,相当于LUMO第二节 电子反应中的轨道对称守恒原理电环反应中的两种反应形式:1、热化学:是反应物分子处于基态所发生的反应 HOMO2、光化学: 激发态所发生的反应 LUMO 一、丁二烯和环丁烯的电环反应hγγLUMOHOMOCH3CH3H H 175。









♦轨道对称性守恒原理和前线轨道理论;♦电环化反应的规律;♦环加成反应的规律;♦σ迁移反应,氢迁移和碳迁移。
♦用前线轨道理论解释反应规律;♦用三个反应的规律解决实际问题。
从反应机理上看,有机反应的类型:离子型反应自由基型反应周环反应:不形成离子或自由基中间体,而是由电子重新组织,经过环状的过渡态而进行的。
分析周环反应和离子反应、自由基反应不同,要使用分子轨道理论。
1周环反应②反应不受溶剂极性影响,不被酸碱所催化,也不受自由基引发剂和抑制剂的影响。
①反应过程中没有自由基或离子等活性中间体产生,为多中心的一步完成的协同反应。
周环反应的特征:+CHO CHOΔCHO③反应进行的动力是加热或光照。
④反应具有高度的立体专一性,加热和光照下分别生成不同的立体异构体。
R R R RΔh νRR周环反应的过程,要用轨道来分析和说明。
φ1φ2ψψ*分析周环反应常用到π分子轨道。
图形是表示轨道的简单直观的方法。
2分子轨道对称守恒原理分子轨道对称守恒原理的中心内容:化学反应是分子轨道重新组合的过程,分子轨道的对称性控制化学反应的进程,在一个协同反应中,分子轨道对称性守恒。
三种理论解释:前线轨道理论;能量相关理论;Hückel-Möbius芳香过渡态理论。
3前线轨道理论前线轨道和前线电子}最高占有轨道HOMO前线轨道FMO最低空轨道LUMO前线轨道理论的中心思想分子中的前线电子类似于单个原子的价电子,因此在化学反应过程中,最先作用的分子轨道是前线轨道,起关键作用的电子是前线电子。
4直链共轭多烯的π分子轨道2ψ3ψ4ψ1ψ2ψ3ψ4ψ丁二烯的π分子轨道图形电子分布基态激发态1ψHOMO LUMO HOMO LUMO直链共轭多烯的π分子轨道的一些特点:①π分子轨道的数目与参与共轭体系的碳原子数相同。
②对镜面按对称-反对称-对称交替变化;对二重对称轴按反对称-对称-反对称交替变化。
③结(节)面数由0→1→2……逐渐增多。
周环反应主要内容 一、引言二、周环反应的分类及理论解释 分类:1.电环化反应(electrocyclic reactions)2.环加成反应(cycloaddition reactions)3.σ-键迁移反应(sigmatropic rearrangement)理论解释:1.前线轨道理论2.分子轨道对称性守恒3.芳香过渡态理论三、总结 引言在本科学习过两类反应:离子反应:通过键的异裂而产生的C +、C -为中间体 自由基反应:通过键的均裂而产生的C .为中间体 但是,有没有其它类型的反应呢?1912年 Claisen 重排等1928年 Diels-Alder 反应,研究相当深入,应用广泛+OOH但这类反应没有检测到反应中间体,不服从上述两种反应机理,不受溶剂极性影响,不被酸碱催化,也不受自由基引发剂或淬灭剂的影响,是一类很特殊的有机反应,一度认为是没有机理的反应,困惑化学界50多年(从1912年Claisen 反应起)。
1958年Vogel 报道了一个有趣的反应:而得不到更稳定的:或者不稳定的:1961年荷兰Leiden 大学Prof.Haringa 研究己三烯关环时,得到的是CH 3—、H —反式的关环产物。
该校Oosterhoff 教授认为,加热和光照所引起的化学反应的立体化学不同可能是由于受到其他因素(如共轭己三烯的轨道对称性)的影响,并进一步提出是受最高占据轨道和节点数控制的。
这一见解Haringa 作为脚注发表在四面体上。
这已经接近了分子轨道对称性守恒大门,可以说已经踏入了一只脚。
CO 2Me2Metrans-tranH CO 2MeHCO 2Me△120℃CO 2MeCO 2Mecis-trans与此同时,美国Woodward和Eschenmoser正领导全世界来自19个国家的100位科学家进行V12全合成工作,历时12年,于1972年宣告完成,轰动一时,是B有机合成的杰作,传为佳话。