有机化学 第十七章周环反应
- 格式:ppt
- 大小:1.06 MB
- 文档页数:52




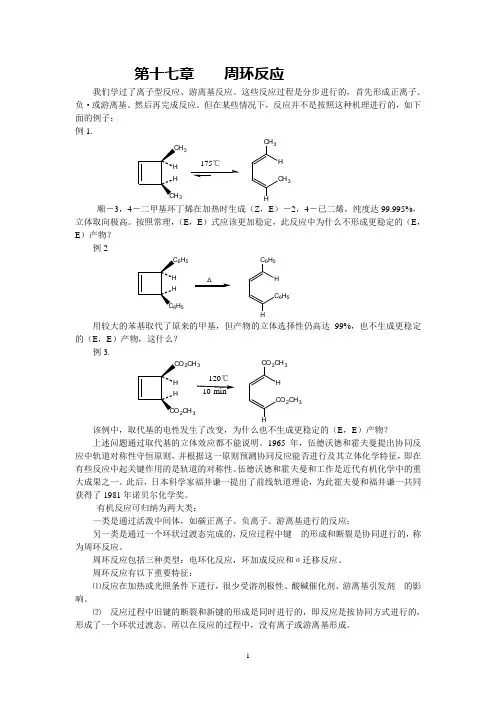
第十七章 周环反应我们学过了离子型反应、游离基反应。
这些反应过程是分步进行的,首先形成正离子、负·或游离基。
然后再完成反应。
但在某些情况下,反应并不是按照这种机理进行的,如下面的例子: 例1.33175℃CH 3H CH 3H顺-3,4-二甲基环丁烯在加热时生成(Z ,E )-2,4-已二烯,纯度达99.995%,立体取向极高。
按照常理,(E ,E )式应该更加稳定,此反应中为什么不形成更稳定的(E ,E )产物?例2△C 6H 5H C 6H 5H 6H 5H 5用较大的苯基取代了原来的甲基,但产物的立体选择性仍高达99%,也不生成更稳定的(E ,E )产物,这什么?例3.2CH 32CH 3CO 2CH 3H CO 2CH 3H 120℃10min该例中,取代基的电性发生了改变,为什么也不生成更稳定的(E ,E )产物?上述问题通过取代基的立体效应都不能说明。
1965年,伍德沃德和霍夫曼提出协同反应中轨道对称性守恒原则,并根据这一原则预测协同反应能否进行及其立体化学特征,即在有些反应中起关键作用的是轨道的对称性。
伍德沃德和霍夫曼和工作是近代有机化学中的重大成果之一。
此后,日本科学家福井谦一提出了前线轨道理论,为此霍夫曼和福井谦一共同获得了1981年诺贝尔化学奖。
有机反应可归纳为两大类:一类是通过活泼中间体,如碳正离子、负离子、游离基进行的反应; 另一类是通过一个环状过渡态完成的,反应过程中键 的形成和断裂是协同进行的,称为周环反应。
周环反应包括三种类型:电环化反应,环加成反应和σ迁移反应。
周环反应有以下重要特征:⑴反应在加热或光照条件下进行,很少受溶剂极性、酸碱催化剂、游离基引发剂 的影响。
⑵ 反应过程中旧键的断裂和新键的形成是同时进行的,即反应是按协同方式进行的,形成了一个环状过渡态。
所以在反应的过程中,没有离子或游离基形成。
⑶ 反应常 具有高度的立体选择性。
第一节 电环化反应在线形共轭体系的两端,由两个π电子生成一个新的σ键 其逆反应都称为电环化反应。





《有机化学反应类型》周环反应特点在有机化学的广袤领域中,周环反应是一类独特而重要的反应类型。
与常见的离子型反应和自由基反应不同,周环反应具有一系列鲜明的特点,使其在有机合成和理论研究中都占据着重要的地位。
周环反应的一个显著特点是反应过程中没有活性中间体生成。
这意味着整个反应是协同进行的,旧键的断裂和新键的形成在同一时间、以协同的方式完成。
这种协同性使得周环反应在反应速率和选择性方面表现出独特的性质。
周环反应具有高度的立体专一性。
这意味着在特定的反应条件下,反应只会生成一种特定的立体异构体。
例如,在狄尔斯阿尔德反应中,双烯体和亲双烯体的相对构型会直接决定产物的立体结构。
这种立体专一性为合成具有特定立体结构的有机化合物提供了有力的工具。
周环反应的另一个重要特点是反应的条件通常比较温和。
与一些需要强酸、强碱或高温高压等苛刻条件的反应相比,周环反应往往在常温常压下就能顺利进行。
这不仅降低了反应的能耗和成本,还有利于对反应的控制和操作。
周环反应在能量上是高度有利的。
反应的过渡态具有较低的能量,使得反应能够较为容易地发生。
这是因为周环反应遵循轨道对称性守恒原理,只有在反应过程中轨道对称性匹配的情况下,反应才能顺利进行。
周环反应的选择性也非常突出。
包括区域选择性和化学选择性。
区域选择性指的是反应在分子内不同位置发生的倾向性。
而化学选择性则是指在存在多个可能反应的情况下,反应优先选择其中的某一种进行。
以电环化反应为例,它是周环反应的一种重要类型。
当一个共轭多烯分子在加热或光照条件下发生闭环反应时,反应的方式和产物的结构取决于分子中π电子的数目以及反应条件。
在加热条件下,4n 个π电子的体系采取顺旋方式进行反应,而 4n + 2 个π电子的体系则采取对旋方式反应。
在光照条件下,情况则相反。
再来看环加成反应,比如前面提到的狄尔斯阿尔德反应。
它是一个4 + 2环加成反应,双烯体的电子云密度以及亲双烯体的缺电子程度都会影响反应的速率和选择性。

第十七章周环反应第一节周环反应的理论一周环反应1.定义:在最近的五十年里,有机化学家研究有机化学机理,主要有两种。
一种是游离基型反应,一种是离子型反应,它们都生成稳定或不稳定的中间体。
离子型或游离基型反应:反应物→中间体→产物另一种机理是,在反应中不形成离子或游离基的中间体,而认为是有电子重新组织经过四或六中心环的过渡态而进行的。
这类反应不受溶剂极性的影响,不被碱或酸所催化,没有发现任何引发剂对反应有什么关系。
这类反应似乎表明化学键的断裂和生成是同时发生的。
这种一步完成的多种心反应叫周环反应。
周环反应:反应物→产物2.周环反应的特征:①反应进行的动力,是加热或光照。
②反应进行时,有两个以上的键同时断裂或形成,是多中心一步反应。
③反应时作用物的变化有突出的立体选择性。
④在反应过渡态中原子排列是高度有序的。
二. 分子轨道理论几个原子轨道线性组合,形成几个分子轨道,比原子轨道能量低的为成键轨道,比原子轨道能量高的为反键轨道。
其电子填充符合Pauli原理和Hund规则。
σ轨道:Л轨道:丁二烯的分子轨道:镜面节面直链共轭多烯烃分子轨道特点:①节面数:若共轭多烯烃有几个原子,它的n个轨道就有n-1个节面。
②轨道的节面越多,能量越高。
③高一能级的轨道和低一能级的轨道的对称性是相反的。
④图中的共轭多烯烃的对称性都是指类顺型(像顺型)的。
三.前线轨道.福井认为最高的已占分子轨道(HOMO)上的电子被束缚得最松弛,最容易激发到能量最低的空轨道(LUMO)中去。
这些轨道是处于前线轨道(FMO),前线轨道理论认为:化学键的形成主要是由FMO的相互作用决定的。
分子的HOMO与LUMO 能量接近,容易组成新轨道。
第二节电环化反应1.定义:在n个Л电子的线型共轭体系中,在其两端点之间生成一个单键的反应及其逆过程称为电环化反应。
电环化反应中,多烯烃的一个Л键变成环烯烃里的一个σ键。
如:(Z,E)2,4-己二烯根据微观可逆性原则,正反应和逆反应所经过的途径是相同的。
第17章 周环反应简答题1.下列化合物之一进行分子内环化得一三环酮,(Me 3Si)2NNa 作为缩合剂,另一则不能。
试写出产物的结构。
解释这一差别。
答:活性的差别主要是由于在环化时,原菠酮B 的3位不容易受到亲电试剂的进攻,因此不能环化。
2.答:3.指出下列周环反应过程中的机理名称。
答:(1)[1,5]氢原子的同面迁移(2)[1,3]碳原子的同面迁移(3)[1,5]碳原子的同面迁移(4)[5,5]σ迁移4.下列化合物在100℃时,其谱中只有一个信号,δ=4.22ppm(s ,10H ),给出合理解释。
答:在瞬烯分子中,由于三元环张力较大,分子有通过相邻π键经[3,3]σ迁移反应打开三元环释放张力的趋势。
但由于分子结构的特殊性,一旦[3,3]σ迁移反应完成,在分子的另一端恰巧又产生一个三元环,重新回到起点,使得分子始终不停地进行[3,3]σ迁移:在此过程中,由于所有氢原子都在轮流扮演顶角氢、烯键氢和三元环氢原子的角色,使得它们的信号平均化,因此谱中只在δ=4.22ppm 处出现单峰。
5.解释下列实验事实:答:首先是原料中环丁烯部分发生4π顺旋开环反应,得到己三烯衍生物。
然后发生6π体系对旋成环反应,生成环己二烯衍生物。
具体反应如下:6.解释下列实验事实:答:首先是两个原料之间发生光照条件下的[2+2]环加成反应,生成氧杂环丁烯衍生物,然后该衍生物再发生光照条件下的4π对旋开环反应,生成最终产物。
7.解释下列实验事实:答:原料首先发生逆第尔斯-阿尔德反应,生成邻苯二甲酸二甲酯和环丁烯衍生物,环丁烯衍生物再发生4π顺旋开环反应得到产物。
具体反应如下:8.按题意要求选择正确答案。
(1)下列分子轨道中,哪个是丁二烯的HOMO?(2)下列分子轨道中.哪个是己三烯的LUMO?(3)烯丙基自由基的非键轨道是(4)烯丙基负离子的LUMO是(5)下列四个分子轨道中,能级最高的是(6)戊二烯正离子的HOMO是答:(1)(c)(2)(d)(3)(d)(4)(b)(5)(b)轨道中节面越多,能级越高。