高等有机化学周环反应
- 格式:ppt
- 大小:1019.50 KB
- 文档页数:29

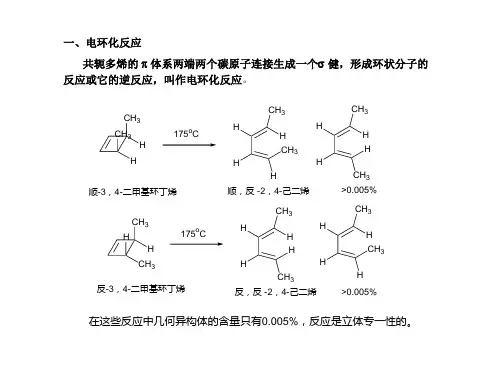
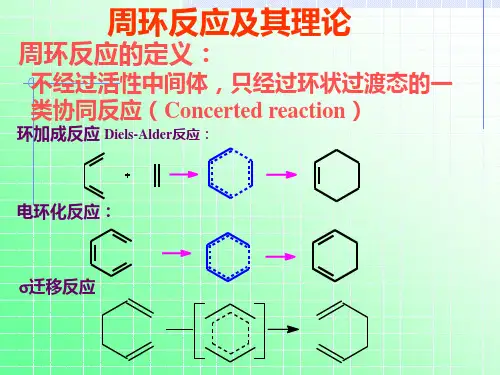
第九章周环反应(协同反应)协同反应——(1)此类反应中无产生离子或自由基等中间活性体(2)不受催化剂或溶剂的影响(3)键的生成和断裂在一步中完成(4)可在热和光照下反应(5)立体专一性反应由于反应的过渡态是一环状结构,所以也称为周环反应。
周环反应是以轨道对称守恒原理为基础的,由Woodward提出。
第一节分子轨道对称守恒定律1、术语:以乙烯分子为例:21反键轨道成键轨道分子轨道用波函数来表示:对乙烯分子π轨道来说,它有一个对称因素:为面对称(成键轨道S),而对反键轨道来说是反对称(A)C1对称:Symmetry波函数的数学符号相同,S 面:对映关系轴:转180°反对称:Antisymmetry波函数的数学符号相反,A轴C1:二个碳原子的连线轴C2:两个平面乙烯面与m平面的交线节点:将符号相同的波函数相连与C1轴的交点乙烯的π型分子轨道、节点数和对称性总结为:反键轨道成键轨道轨道节点数对称性21m C2A SS A 节面节点的物理意义:(1)节点越多,说明该轨道的能级越高不安定因素(2)节点处的电子密度等于零对Ψ1来说:是π电子的最高占有分子轨道(HOMO)high occupied molecule orbit *不是说满轨道,只要有一个也是占有最高占有轨道的电子束缚得最松弛,具有给电子的性质,最易激发到最低空轨道,因此这二个轨道为Ψ2是最低的空分子轨道(LUMO)low unoccupied molecule orbit 前线轨道(前沿轨道)对电子的亲和力较强,具有接受电子的性质丁二烯的分子轨道及其对称性:节点数 对称性 m C 23210A S S A A S S A21己三烯的分子轨道及其对称性321节点数 对称性 m C 2543210A S S A A S S A A S S A当最高轨道HOMO 的电子受到光的吸收光子的能量发生跃迁,到最低空轨道时,那时该轨道就变成HOMO 了基态:未激发的HOMO激发态:激发的HOMO ,相当于LUMO第二节 电子反应中的轨道对称守恒原理电环反应中的两种反应形式:1、热化学:是反应物分子处于基态所发生的反应 HOMO2、光化学: 激发态所发生的反应 LUMO 一、丁二烯和环丁烯的电环反应hγγLUMOHOMOCH3CH3H H 175。