2018ESCEACTS 心肌血运重建指南解读
- 格式:pptx
- 大小:13.48 MB
- 文档页数:46
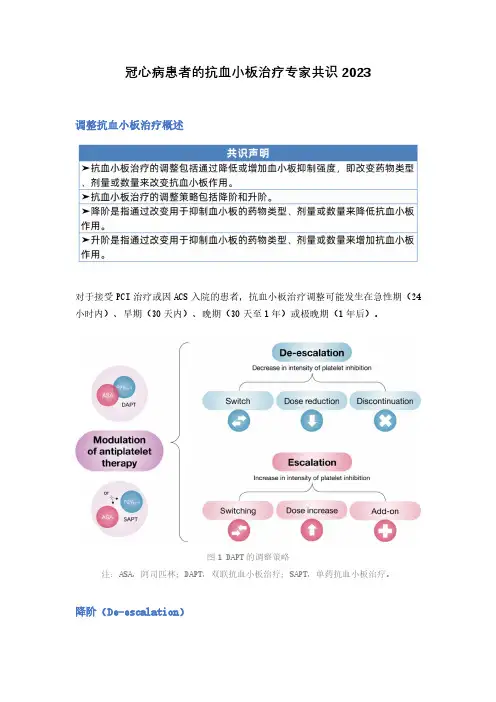
冠心病患者的抗血小板治疗专家共识2023调整抗血小板治疗概述对于接受PCI治疗或因ACS入院的患者,抗血小板治疗调整可能发生在急性期(24小时内)、早期(30天内)、晚期(30天至1年)或极晚期(1年后)。
图1 DAPT的调整策略注:ASA,阿司匹林;DAPT,双联抗血小板治疗;SAPT,单药抗血小板治疗。
降阶(De-escalation)➤当认为抗血小板治疗的出血并发症风险大于血栓并发症风险时,可采用降阶治疗以减少患者出血并发症。
➤降低出血风险可以通过更换为预期抗血小板作用相对较弱的药物、减少剂量或停用抗血小板药物(图2)。
√对于DAPT,转换药物和减少剂量通常仅限于P2Y₁₂抑制剂,尽管理论上阿司匹林也可改变。
√P2Y₁₂抑制剂单药治疗时也可进行转换药物和减少剂量。
√停药通常在DAPT的情况下进行,需要根据医生指示停药,不包括因手术、出血或患者依从性差中断治疗的停药情况。
图2 抗血小板治疗降阶策略注:ASA,阿司匹林;PRA,普拉格雷;CLO,氯吡格雷;TIC,替格瑞洛。
1.转换药物(1)相关定义➤通过转换药物降阶通常是指将强效P2Y₁₂抑制剂(如普拉格雷或替格瑞洛)更换为预期血小板抑制作用相对较弱的P2Y₁₂抑制剂(如氯吡格雷)。
这种情况最有可能发生在最初接受指南推荐DAPT方案(普拉格雷或替格瑞洛)治疗的ACS患者中。
➤可通过检查或根据临床判断来评估或预测换药降阶效果。
√指导换药降阶的检查包括血小板功能检测和基因分型。
√ACS患者DAPT换药研究包括单纯根据临床判断(“非指导”)进行换药或血小板功能检测和基因分型指导的换药。
➤转换药物的最佳时间尚无标准。
√但在非指导换药研究中,P2Y₁₂抑制剂的变化多发生在1个月时(即认为出血风险超过血栓并发症风险)。
√相反,在血小板功能检测和基因分型指导下的换药研究中,这种变化通常发生在更早的时间点,包括PCI后立即换药。
值得注意的是,在PCI围术期换药降阶与血栓相关并发症的增加有关。

稳定性冠心病的风险评估一、根据临床特征,应用验前概率评价稳定性冠心病患病概率关于心绞痛的严重程度,除了继续沿用加拿大心血管病学会(CCS)将心绞痛严重程度分为4 级外,推荐根据患者胸痛特征、性别和年龄3个简单因素,推断稳定性冠心病的PTP,评价罹患稳定性冠心病的临床可能性。
对于左心室射血分数(LVEF)≥50% 的患者,推荐PTP 用于疑似稳定性冠心病的诊断流程和决策过程。
PTP65%~85% (中高概率)者建议行负荷影像学检查以确诊稳定性冠心病。
PTP>85%(高概率)者,可确诊稳定性冠心病,应启动药物治疗,症状明显者直接冠状动脉造影决定是否血运重建治疗。
对LVEFF<50% 有典型胸痛者,推荐直接行冠状动脉造影检查,必要时血运重建治疗。
根据年龄、性别、典型心绞痛3 个简单参数估算PTP,然后选择不同的诊断方法,简单易行,对稳定性冠心病的诊治策略有重要价值。
二、实验室检查是评估心血管危险因素及判断预后的重要方法对于稳定性冠心病患者,所有患者均应进行全血细胞计数(包括血红蛋白水平和白细胞计数)、2型糖尿病筛查、测定血清肌酐评测肾功能(肌酐清除率)、空腹血脂水平、肝功能情况。
如果怀疑甲状腺疾病,建议行甲状腺功能检查;对于服用他汀类药物患者自诉症状提示肌病的患者行肌酸激酶检查;对于怀疑心力衰竭患者应考虑查B 型利钠肽/N 末端B 型利钠肽原(BNP/NT-proBNP)检查。
此后每年均建议检查血脂、葡萄糖代谢和血清肌酐。
三、评价心肌缺血的各种负荷试验对评估稳定性冠心病仍有重要价值目前临床上应用的心肌缺血负荷试验包括心电图、超声心动图、磁共振及核素心肌灌注显像运动负荷试验或药物负荷试验(多巴酚丁胺负荷、潘生丁或腺苷负荷试验)。
临床常用的负荷试验包括心电图、超声心动图和单光子发射CT(single photon emission computed tomography,SPECT)。
具体采用何种负荷试验方法,应根据患者的整体状态和各医疗卫生机构的实际情况进行合理选择。

抗栓治疗有了新规范!大咖手把手教你读指南丨2018长城会已经落下帷幕的第二十九届长城国际心脏病学会议(GW-ICC 2018)为金秋十月送上了一场丰富多彩的学术盛宴。
在会议期间召开的“抗栓全程管理论坛”中,北京协和医院的张抒扬教授、河南省人民医院的高传玉教授、中国医学科学院阜外医院的颜红兵教授、浙江大学医学院附属第一医院的朱建华教授联袂主持了本次论坛。
图1:从左到右依次为张抒扬教授、高传玉教授、颜红兵教授、朱建华教授适逢不久前召开的2018年欧洲心脏病学会年会(ESC 2018)公布了《2018 ESC/欧洲心胸外科学会(EACTS)心肌血运重建指南》[1](以下简称《指南》),对抗栓治疗的优化进行梳理,并做出了进一步的规范。
西安交通大学第一附属医院的袁祖贻教授结合该《指南》,在论坛现场就《指南》在抗栓治疗方面的更新进行了题为《ESC血运重建指南抗栓治疗常见问题解析》的学术汇报。
图2:袁祖贻教授现场演讲《指南》关于P2Y12受体抑制剂的选择推荐袁祖贻教授指出,抗栓治疗作为心肌血运重建围术期的基本治疗策略,不仅对于急性冠脉综合征(ACS)患者减少心血管事件风险、改善近远期预后具有重要意义,也是《指南》的重点更新内容。
据袁祖贻教授介绍,在P2Y12受体抑制剂的选择与转换方面,《指南》在采纳了近些年来的大型随机对照试验(RCT)后,基本维持了《2014 ESC/EACTS心肌血运重建指南》的结论。
但是,在2014版指南的基础上将新型P2Y12受体抑制剂替格瑞洛(倍林达)的地位上升为了I类推荐、A级证据,提示了该推荐的必要性,意味着在为ACS患者选择P2Y12受体抑制剂时,应优选更强效、更准确、更可靠且无需监测血小板功能的新型P2Y12受体抑制剂替格瑞洛。
对于非ST段抬高急性冠脉综合征(NSTE-ACS)患者接受PCI术前抗栓治疗时,《指南》推荐替格瑞洛(180mg负荷剂量,90 mg bid),无论之前使用各种P2Y12受体抑制剂(I,B)。

冠状动脉慢性完全闭塞性病变CTO病变治疗策略进展冠状动脉慢性完全闭塞性病变(chronic total occlusion,CTO)被定义为冠状动脉粥样硬化管腔狭窄致前向血流完全阻断,病程超过3个月(常根据病史、临床或既往造影结果判断);而根据冠脉血流TIMI分级又可分为“真性完全性闭塞”和“功能性闭塞”(TIMI血流0级和1级)。
尽管介入治疗器械、技术和术者的不断更新进步,CTO病变仍是冠心病介入治疗领域最大的挑战之一。
1.CTO患者特点及流行病学与非CTO冠心病相比,CTO患者往往年龄更大,更多合并糖尿病,高血压,高脂血症,周围血管疾病及心梗病史。
未诊断或治疗的急性血栓事件常是CTO病变发展的起始,大约?患者心电图相应供血区域存在病理性Q波。
然而大多数(60%)CTO患者,闭塞为管腔狭窄病变慢性进展所致,这一过程中形成的良好的侧支循环,为闭塞血管远端缺血心肌提供血流供应,减少了急性缺血事件的发生。
此外,PCI/CABG术后,支架内及桥血管病变,也可表现为CTO。
近1/4患者无任何症状;有症状的CTO 患者,对中重度缺血耐受性良好,症状亦往往发生较晚,更多的表现为呼吸困难、活动耐量减低、疲乏无力、心悸等,而非典型的心绞痛。
经冠脉造影确诊为冠心病的患者中,16%-52%存在CTO病变;STEMI 患者中约10%合并非梗死相关血管(IRA)的CTO;既往有CABG手术史的患者,CTO的比例更是高达54%-89%。
然而,美国国家心血管病PCI注册中心(NCDR CathPCI registry)2015年的报告显示,CTO人群中仅有12.4%患者行PCI,CTO PCI仅占稳定型冠心病PCI总量的3.8%。
加拿大单中心注册数据显示:CTO患者中仅9%接受了PCI,而34%和57%的患者分别接受了CABG和单纯药物治疗。
2.CTO患者预后不良。
大量研究证明合并CTO的冠心病患者预后不良,CTO是ACS包括STEMI、NSTEMI患者及稳定性冠心病预后不良的独立预测因素。


冠心病患者心肌血运重建的策略选择(全文)冠心病(coronary artery disease,CAD)是严重威胁人类健康的一种疾病,是全球导致中老年人死亡的首要病因。
心肌血运重建是冠心病的重要治疗手段,通过血运重建,可以缓解患者的症状,改善患者的生活质量及延长其寿命。
目前常见的血运重建方法有经皮冠状动脉介入治疗(PCI)和冠状动脉旁路移植术(CABG)。
今年,欧洲心脏病学年会发布了2018年的《心肌血运重建指南》,文中对冠心病患者的血运重建策略进行了详细的阐述,本文将结合最新的指南共识进行述评,以期为冠心病患者的临床诊治提供启示。
一、心肌血运重建的适宜性在临床实践中,对于何种冠心病患者需要进行心肌血运重建是值得广大临床医生注意的问题。
总的治疗原则是要充分考虑血运重建对于患者临床结局(如死亡、症状、功能状态或生活质量)的影响,如果预期的临床获益超过手术的预期风险及负面影响即为适宜[1]。
下面我们将对常见的冠心病患者进行详细介绍。
1.急性冠脉综合征(ACS)患者ACS是冠心病的高危人群,大量临床研究均已证实,与单纯药物治疗相比,血运重建不仅能够改善ACS患者的临床症状,而且还能够降低患者的近期及远期心血管病事件风险,对于高危亚组人群则更为显著[2-4]。
因此,在2018年ESC心肌血运重建指南中推荐[5]:1)对于ASC合并急性心衰或心源性休克的患者,需要紧急进行侵入性评估,如果冠脉解剖适宜,进行紧急PCI是指征,如果解剖结构不适宜,可推荐行紧急CABG,不推荐常规使用主动脉球囊反搏术(IABP);2)对于ST段抬高型心肌梗死(STEMI)患者,在症状发生2 h内实现再灌注,可使STEMI患者显著获益,而对缺血症状<12 h且ST段持续抬高的患者均推荐进行再灌注治疗,如果症状>12 h且持续存在症状或提示缺血的体征、血流动力学不稳定或危及生命的心律失常,也可以推荐PCI治疗;3)对于非ST段抬高型急性冠脉综合征(NSTE-ACS)患者,需要根据患者的状况进行危险程度分级,对于极高危患者(如血流动力学不稳定或心源性休克、危及生命的心律失常或心脏骤停、MI机械并发症、急性心衰、ST-T反复动态改变),可立即行侵入性检查(<2h)。

ESCEACTS血运重建指南解读及第4版心肌梗死全球通用定义解读ESC/EACTS血运重建指南解读及第4版心肌梗死全球通用定义解读从1812年第一次描述心绞痛症状至今的200余年中,人类对冠心病的认识经历了从大体解剖层次到细胞和分子生物学水平的飞跃,但如何准确诊断和进行最佳治疗一直是临床实践所面临的挑战1。
2018年8月ESC 年会发布的《2018年ESC/EACTS血运重建指南》和《第4版心肌梗死全球通用定义》全面总结梳理了目前血运重建和心肌梗死主要循证医学证据,对临床实践具有非常高的指导价值。
一.《2018年ESC/EACTS血运重建指南》在最佳药物治疗基础上依据循证医学证据进行血运重建治疗能够改善冠心病的预后。
1969年Favalo ro首次描述了冠状动脉旁路手术(CABG),8年后A n dreas Grüntzig进行了首例冠状动脉介入术(PCI),50年后的今天CABG和PCI仍是冠心病血运重建的主要方式,但医学技术的进步使得我们可以达到更好的治疗终点。
冠心病患者的预后取决于心肌缺血的存在和程度,血运重建以减少心肌缺血为首要目标,其基础在于准确识别心肌缺血。
近年来冠脉生理学和腔内影像学检查技术在血运重建的决策中扮演了越来越重要的角色,新指南的相关推荐也反映了这一趋势。
基于DEFER2、FAME3、FAMEII4等里程碑式的研究证据,新指南推荐在临界病变(IA)和多支病变(IIa B)中进行冠脉血流储备分数(FFR)检查。
非血管扩张剂依赖的瞬时无波形曲线比值(iFR)理论基础与FFR相似,DEFINE-FLAIR5和iFR-SWEDEHEART6研究1年随访结果表明iFR指导血运重建不劣于FFR,因此在临界病变的评估中也获得了IA级别的推荐。
但是目前静息Pd/Pa、CT-FFR等其他冠脉功能学检测手段循证医学证据仍不充分,新指南中未予明确推荐。
血管内超声(IVUS)和光学相干成像(OCT)等腔内影像学检查手段可以提供管腔面积、斑块负荷、斑块成分等诸多信息。

干货丨开卷有益,重温2018ESC心肌血运重建指南精华欧洲心脏病学会(ESC)和欧洲心胸外科协会(EACTS)于2018年8月联合发布了心肌血运重建指南。
该指南引入了最新的临床研究结果,本文主要对该指南更新的要点进行介绍。
一. 指南推荐升级和降级指南更新后的降级和升级,如下图所示。
二. 指南新增推荐1. 稳定性心绞痛或无症状心肌缺血患者中血运重建适应证,如下图所示。
2. 冠状动脉解剖适宜且预期手术死亡风险低的稳定性冠心病(SCAD)患者,血运重建类型(CABG或PCI)的选择,如下图所示。
3. 根据初始危险分层,非ST段抬高型急性冠状动脉综合征(NSTE-ACS)患者治疗策略和时机的选择,如下图所示。
① 极高危:即刻有创策略(<2小时)(I C)·血流动力学不稳定或心源性休克;·药物难以控制的反复发作或持续性胸痛;·致命性心律失常或心脏骤停;·心肌梗死合并机械性并发症;·急性心力衰竭;·反复ST段或T波动态改变。
② 高危:早期有创策略(<24小时)(I A)·基于肌钙蛋白水平诊断为非ST段抬高型心梗;· ST段或T波动态改变(有或无症状);· GRACE评分>140。
③ 中危:有创策略(<72小时)(I A)·糖尿病或肾功能不全;·左室射血分数<40%或充血性心力衰竭;·早期心肌梗死后心绞痛或既往接受PCI/CABG;· GRACE评分>90且<140;·无创检查提示缺血症状反复发作。
4. ST段抬高型心肌梗死(STEMI)患者行直接PCI(PPCI)进行心肌再灌注,指南推荐如下图所示。
5. 慢性心衰和左室收缩功能不全(LVEF<35%)患者的血运重建,指南推荐如下图所示。
6. 合并心源性休克患者的血运重建,指南推荐如下图所示。
7. 预防造影剂肾病,指南推荐如下图所示。



ESC/EACTS心肌血运重建管理指南要点
ACS =急性冠脉综合征; AF =心房颤动; AMI = 急性心肌梗死; BMS = 金属裸支架; CABG = 冠脉旁路移植术; CAD = 冠心病; CKD =慢性肾病; DAPT = 双联抗血小板治疗; DES = 药物洗脱支架; DUS = 双功超声; ECG = 心电图; EF = 射击血分数; FFR =冠脉血流储备分数; GP = 糖蛋白; IABP =主动脉内球囊反搏; iwFR =瞬时无波无线电;IMA =内乳动脉; IRA =梗死相关动脉; i.v. =静脉内; LAD = 左前降支; LM =左主干; LMWH =低分子肝素; LV = 左心室; LVEF = 左室射血分数; NSTE-ACS = 非ST段抬高的急性冠脉综合征; PCI =经皮冠脉介入治疗; PRECISE-DAPT = 在拟行支架植入和随后双联抗血小板治疗的患者中预测出血并发症; s.c. =皮下注射; SCAD = 稳定性冠心病; STEMI = ST-抬高的心肌梗死; STS = 胸外科学会; SYNTAX = 用紫杉醇支架经皮冠脉介入治疗与心脏外科的协同作用;TIA = 短暂性脑缺血发作; UFH =非组分肝素。
A推荐类别
B证据水平
C有证实的心肌缺血,一种血流动力学相关的病变,定义为FFR ≤0.80 或iwFR≤0.89, 或一支主要冠脉狭窄>90%。
D根据FFR <0.75,表明一种预后相关的病变。
E如果心脏团队担心手术风险或者经心脏团队充分咨询后,患者拒绝CABG,应当考虑PCI。
F这些推荐指的是得到大规模随机试验支持、有临床终点评估获得无条件欧盟质量标志的支架。
【ESC2018指南】第四版心梗全球统一定义,核心要点抢先看北京时间8月25日,2018年欧洲心脏病学会(ESC)在德国慕尼黑盛大开幕。
会议第一天,发布了第四版心肌梗死全球统一定义,并同期发表在《欧洲心脏杂志》(EHJ)。
本次新定义的核心要点主要为新概念的添加、心肌梗死不同分型和热点问题的更新,以及新增疾病板块。
一、新概念1.心肌梗死和心肌损伤的区别◆心肌损伤:至少一个心肌肌钙蛋白(cTn)高于正常参考值上限(URL)第99个百分位数时,诊断为心肌损伤。
如果cTn值有上升和(或)下降,考虑为急性心肌损伤。
◆心肌梗死:在心肌损伤的基础上,伴有心肌缺血的临床表现。
图12.心脏手术和非心脏手术围术期,心肌损伤与心肌梗死的区别(1)心脏手术◆心肌损伤:基线cTn正常的患者,术后URL>第99个百分位数,或术前值超上限但处于稳定或下降趋势者,术后值较术前值增加> 20%。
◆心肌梗死:诊断需在心肌损伤基础上具有心肌缺血临床症状。
(2)非心脏手术◆心肌梗死:由于麻醉、镇静或止痛药,大多数患者的围手术期心肌梗死不会出现缺血性症状;基线的cTn值有助于确定手术前有慢性疾病的患者,以及在术中和术后高风险的患者(基线cTn升高);患者术后cTn值升高越多,心肌损伤风险越大,因此,建议对高风险患者进行cTn检测,并结合术前结果确定急、慢性病因。
除cTn升高之外,因无临床缺血症状,诊断心肌梗死需结合术后相关检查(如心电图ST段动态监测、反复发作的缺氧、低血压、心动过速或影像学证据)。
◆心肌损伤:在缺乏急性心肌缺血的证据时,急性心肌损伤的诊断更合理。
3.考虑电重塑(心脏记忆)在心肌梗死评估中的意义心房颤动、快速心室率或阵发性室速等快速性心律失常患者,可在无冠心病的情况下出现ST段压低或T波倒置。
目前,这种现象出现的确切机制未明,但心脏记忆的观点可部分解释(心脏记忆现象:在一段时间的激动顺序改变后恢复窦性节律时,所出现的持续性T波改变)。
2018年欧洲心脏协会和欧洲心胸外科协会血运重建指南解读周玉杰;刘巍【期刊名称】《中国介入心脏病学杂志》【年(卷),期】2018(26)9【摘要】2018年8月欧洲心脏病学会(European Society of Cardiology,ESC)及欧洲心胸外科协会(European Association for Cardio-thoracicSurgery,EACTS)联合发布《2018年血运重建指南》[1](以下简称《2018年指南》),于2018年ESC年会上公布,并同步发表于《European Heart Journal》。
【总页数】4页(P497-500)【作者】周玉杰;刘巍【作者单位】100029 北京,首都医科大学附属北京安贞医院心内科;100029 北京,首都医科大学附属北京安贞医院心内科【正文语种】中文【中图分类】R54【相关文献】1.《2014欧洲心脏病学会和欧洲心胸外科协会心肌血运重建指南》解读 [J], 陈良龙2.欧洲心脏病学会/欧洲糖尿病研究协会2013年糖尿病、糖尿病前期与心血管疾病指南解读与启示 [J], 刘靖;胡大一3.2010欧洲心脏病协会年会心脏起搏和再同步治疗指南更新——2007欧洲心脏病协会年会心脏再同步化治疗指南疗指南和2008欧洲心脏病协会年会急性和慢性心力衰竭诊断和治疗指南的更新 [J], 周晗;刘鹏4.欧洲心脏病学会/欧洲糖尿病研究协会2013年糖尿病、糖尿病前期与心血管疾病指南解读与启示 [J], 刘靖;胡大一5.心肌血运重建治疗中的抗血小板治疗——解读2018年欧洲心脏病学会和欧洲心胸外科协会血运重建指南 [J], 孙艺红因版权原因,仅展示原文概要,查看原文内容请购买。