四川省绵阳市高中2014级二诊考试化学试题
- 格式:doc
- 大小:322.00 KB
- 文档页数:6

2014学年第二学期学习能力诊断卷高三年级化学学科(满分150分,时间120分钟)说明:本卷分试题卷与答题卷两部分,请将正确答案写在答题卷上,写在试题卷上一律不给分。
本卷可能用到的相对原子量:H-1 C-12 O-16 Na-23 Al-27 S-32 Cl-35.5 K-39 Ca-40 Mn-55 Fe-56 Cu-64第I卷(共66分)一、选择题(本题共10分,每小题2分,只有一个正确选项)。
1.将CO2转化成有机物可有效实现碳循环。
下列反应中,最节能的是A.CO2 + 3H2催化剂△CH3OH +H2O B.6CO2 + 6H2O光合作用C6H12O6 + 6O2C.CO2 + CH4催化剂△CH3COOH D.2CO2 + 6H2催化剂△CH2=CH2 + 4H2O2.吸进人体内的氧有2%转化为加速人体衰老的氧化性极强的活性氧,若Na2SeO3能清除人体内活性氧,则Na2SeO3的作用是A.还原剂B.氧化剂C.既是氧化剂又是还原剂D.既不是氧化剂又不是还原剂3.下列元素的单质,工业上不需要用电解法制取的是A.钠B.铝C.溴D.氯4.下列有机物系统命名正确的是A.2-甲基-氯丙烷B.2-甲基-3-丁烯C.2,4,4-三甲基戊烷D.2,3-二甲基-4-乙基己烷5.除去密封食品包装盒内的氧气可延长食品的保质期,下列措施不能延长食品保质期的是A.适当添加含酚类结构单元的天然化合物B.对食物充氮包装C.放入装有铁粉的透气的小纸袋D.放入装有生石灰透气的小纸袋二、选择题(本题共36分,每小题3分,只有一个正确选项。
)6.右图是一种有机物的分子模型,图中的“棍”代表单键或双键,该模型代表的有机物可能是A.饱和一元醇B.羟基酸C.羧酸D.饱和一元醛7.下列微粒的存在最能说明碘可能呈现金属性的是A.IBr B.I2O5C.I3+D.I3-8.在试管中注入某红色溶液,给试管加热,溶液颜色逐渐变浅,则原溶液可能是A.滴有酚酞的Na2CO3溶液 B.溶有SO2的品红溶液C.滴有石蕊的AlCl3溶液D.滴有酚酞的饱和Ca(OH)2溶液9.下列物质都具有较强的吸水性。

高三二摸化学模拟测试可能用到的原子量: H:1 C :12 O:8 S:32 Cu:64 Fe:56 Zn:65第Ⅰ卷(选择题共42分)1.十八大报告中提出“大力推进生态文明建设,提高生态文明水平,建设美丽中国”。
化学已渗透到人类生活的各个方面。
下列说法正确的是A.PM2.5是指大气中直径≤2.5微米的颗粒物,只要戴普通口罩就对人体健康无影响B.垃圾是放错地方的资源,应分类回收利用C.高纯度的硅单质广泛用于制作光导纤维,光导纤维是新型高分子非金属结构材料D.地沟油的主要成分是高级脂肪酸甘油酯,可用于制肥皂和加工食用油2.下列说法正确的是A.电解质溶液能导电,是因为在通电时电解质电离产生了自由移动的离子B.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH值不变C.将AlCl3溶液和Na2SO3溶液分别蒸干并灼烧,得到Al2O3和Na2SO3D.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液,则溶液浓度大小关系:c(CH3COONa)> c(Na2CO3)> c(C6H5ONa)>c(NaOH)【答案】B【解析】试题分析:电离与通电无关,当电解质溶液通入直流电时,溶液中的阴阳离子分别向阳极和阴极移动,参加有电子得失的电解反应,在阳极上失去电子,在阴极上得到电子,形成了电子的定向移动,因此电解质溶液能够导电。
而不是产生了自由移动的离子,A选项不正确,饱和石灰水中加入少量CaO ,恢复至室温后,有沉淀析出,因此还是饱和溶液,饱和溶液浓度不变,所以pH 不变,B 选项正确,因为Na 2SO 3容易氧化,所以Na 2SO 3溶液蒸干并灼烧,得到Na 2SO 4,C 选项不正确,酸越弱,相应的钠盐越容易水解,酸性是醋酸>碳酸>苯酚>碳酸氢钠,所以碳酸钠的水解程度最大,碱性最强。
由于氢氧化钠是强碱,因此在pH 相同的条件下,氢氧化钠的浓度最小,p H 相同的CH 3COONa溶液、C 6H 5ONa 溶液、Na 2CO 3溶液、NaOH 溶液浓度大小关系为:c(CH 3COONa)>c(C 6H 5ONa )>c(Na 2CO 3)>c(NaOH ),D 选项不正确。

2014年高中阶段学校招生模拟考试(二)化学说明:1.全卷共6页。
满分100分,考试用时80分钟。
2.答案均填写在答题卡内3.可能用到的相对原子质量:H—l C—12 O—16 Ca—40一、选择题(本大题共14小题,每小题2分,共28分。
在每小题列出的四个选项中,只有一个是正确的。
请将所选的选项写在答题卡对应题目上)1.下列物质的性质属于化学性质的是A.颜色、状态B.溶解性C.密度、硬度D.可燃性2.下图所示的变化中,属于化学变化的是A.石油分馏 B.净化水 C.蒸发食盐水 D.高炉炼铁3.党的十八大报告中把“生态文明建设”首次提升到更高的战略层面,要求加大自然生态系统和环境保护力度。
下列做法不符合...这一要求的是A.合理开发洁净能源B.全面关停化工企业C.改进汽车尾气净化技术D.研发易降解的生物农药和塑料4.身边处处有化学,学习化学能帮助我们解决生活中遇到的一些问题。
下列做法可行的是A.家中盛开水的玻璃瓶内壁有水垢可用纯碱清洗B.鉴别硬水和软水可以用肥皂水C.用甲醛浸泡海产品可以保鲜D.内壁有植物油的玻璃杯可用食醋清洗5.物质的性质决定物质的用途,下列描述的物质性质与其对应用途不相符...的是A.浓硫酸有吸水性,可用作干燥剂B.石墨有导电性,可用作电池的电极C.氧气有助燃性,可用于登山和潜水D.一氧化碳有还原性,可用于冶炼金属6.在元素周期表中汞元素的某些信息如图所示,下列有关汞的说法正确的是A.元素符号为HgB.属于非金属元素C.原子核内中子数为80D.相对原子质量是200.6g7.下列各组物质中,按氯元素的化合价由低到高的顺序排列的是A.HCl、Cl2、Ca(ClO)2、KClO3 B.Ca(ClO)2、HCl、Cl2、KClO3C.Cl2、HCl、Ca(ClO)2、KClO3 D.KClO3、Ca(ClO)2、Cl2、HCl8.进行化学实验必须注意安全,下列实验操作中正确的是A.不慎将浓硫酸沾到皮肤上,应立即用稀氨水冲洗,再涂上硼酸溶液B.氢氧化钠有强烈的腐蚀性,实验使用时,最好戴上防护眼镜C. 酒精灯失火应立刻用灭火器扑灭D.为了便于观察,给试管里的液体加热时试管口应对着自己9.通过下列类型的反应:①化合反应,②分解反应,③置换反应,④复分解反应,能得到二氧化碳的是 A.只有① B.只有①② C.只有①②③ D.四种反应都可以 10.把等质量的X 、Y 、Z 、M 四种金属分别加入到同体积、同浓度的足量稀盐酸中,再把X 加入到Z (NO 3)2溶液中,M 加入到YNO 3溶液中。

高三第二次诊断性考试理科综合化学部分可能用到的相对原子质量H 1 C 12 O 16 Mg 24 Al 27 Fe 56第Ⅰ卷(选择题共42分)选择题(共7小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的)1. 某些食品包装盒中有一个小袋,袋上注明“双吸剂,不可食用”,通过上网查询得知其主要成分是铁粉、活性炭和氯化钠”。
关于这种双吸剂的分析判断错误的是A.具有抗氧化作用B.可吸收食品盒内的O2和N2C.发挥作用时利用了原电池原理D.变为红褐色后失效2. 类推是一种重要的学习方法,但如果不具体问题具体分析就会得出错误结论。
下列类推结论正确的是A.SiH4的熔沸点比CH4高,则PH3的熔沸点比NH3高B.钠在空气中燃烧生成过氧化钠,则锂在空气中燃烧生成过氧化锂C.Al(OH)3能溶于NaOH溶液,则Be(OH)2能溶于NaOH溶液D.甲酸甲酯能发生银镜反应,则乙酸甲酯能发生银镜反应【答案】C【解析】试题分析:A、CH4和SiH4比较,相对分子质量越大,范德华力越大,故沸点高,而NH3和PH3比较前者分子间存在氢键沸点高,故A错误;B、钠和锂是同族元素,性质具有递变性,Na比Li要活泼更易失电子,故B错误;C、Be和Al是同族元素,性质具有递变性,都是两性氢氧化物,既能和强酸反应,又能和强碱反应,故C正确;D、银镜反应是醛基的特有反应,甲酸乙酯中,酯键中羰基碳上连着一个氢,可以看作是一个醛基,所以能发生银镜反应,而乙酸甲酯中,酯键中羰基所在碳上没有氢,就不具备醛基的性质。
故D错误。
考点:同族元素的化学性质3. 某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4==2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是A.乙烧杯中发生还原反应B.甲烧杯中溶液的pH逐渐减小C.电池工作时,盐桥中的SO2-4移向甲烧杯D.外电路的电流方向是从a到b4.下列实验操作能达到目的的是A.除去苯中混有的少量苯酚:加入适量NaOH溶液,振荡、静置后分液B.除去乙酸乙酯中混有的少量乙酸:加入NaOH溶液并加热,振荡、静置后分液C.检验卤代烃中的卤原子:取少量液体与NaOH溶液共热后滴加AgNO3溶液D.检验FeCl3溶液中是否含有Fe2+:取少量溶液先滴加氯水,再滴加KSCN溶液5. 25℃时,水溶液中c(H+)与c(OH-)的变化关系如图中曲线a c所示,下列判断错误的是A.a c曲线上的任意一点都有c(H+)·c(OH-)=10-14B.b d线段上任意一点对应的溶液都呈中性C.d点对应溶液的温度高于25℃,pH<7D.CH3COONa溶液不可能位于c点6.汽车上的催化转化器可将尾气中的主要污染物转化成无毒物质,反应为:2NO(g)+2CO(g)N 2(g)+2CO2(g) H=-a kJ/mol(a>0)在某温度时,用气体传感器测得不同时间的NO和CO浓度如下表:经分析,得出结论不正确的是A.2~3 s间的平均反应速率v(NO)=9×10-5mol/(L·s)B.催化转化器对废气的转化速率在夏季时比冬季时高C.若该催化转化器气舱容积为2 L,则达到平衡时反应放出热量1.8a JD.该温度下,此反应的平衡常数K=50007.将11.9 g Mg、Al、Fe组成的合金溶于足量NaOH溶液中,产生的气体在标准状况下体积为3.36 L。

四川省绵阳市中考化学二诊试卷一、选择题(本大题包括9个小题,共27分.每小题只有一个选项是最符合题意的)1.下列变化或用途主要体现物质的物理性质的是()A.将石油分馏得到95号汽油B.从海水中提取金属镁C.用肥皂液检验硬水D.浓硫酸滴在白纸上,白纸变黑2.下列图示正确的是()A.钠原子结构示意图B.物质分类C.地壳中元素含量D.燃烧条件3.下列说法正确的是()A.铁、锌、钙、硒、碘都是人体必需的微量元素B.厨房内煤气泄漏后应该立即开启排气扇通风,以免发生中毒事故C.若“”表示氧原子,则“”和“”都表示的是化合物,且都是氧化物D.用氯化钠固体配制50g 20%的氯化钠溶液时,量水时俯视或称量的氯化钠药品不纯,均使所配溶液中溶质的质量分数减小4.根据下图所示的四个实验,得出的结论正确的是()A.乙试管中产生气泡速率大于甲试管中产生气泡速率,说明金属活动性:镁>铁B.蜡烛由低到高依次熄灭,说明通常状况下CO2不能燃烧,不支持燃烧,密度大于空气C.甲试管中的铁钉生锈,乙试管中的铁钉不生锈,说明只需与水接触铁钉就会生锈D.向盛有NaOH固体的试管中滴加稀硫酸,烧杯中饱和的澄清石灰水变浑浊,说明H2SO4与NaOH发生中和反应放出热量5.下列实验中,能够达到实验目的是()A.检验某未知溶液是否是碱溶液:测量溶液的pHB.鉴别CaCO3、NaCl和NH4NO3固体:分别加入适量水观察现象C.除去CO2 中的少量HCl:先通过足量的氢氧化钠溶液,再通过浓硫酸D.分离MnO2和KCl固体混合物:加入足量的水溶解,过滤、洗涤、干燥6.在密闭容器中加入a、b、c、d四种物质,测得反应前后各物质的质量如下表。
下列说法正确的是()物质a b c d反应前的质量/g4*******反应后的质量/g12x100A.x等于60B.b可能是单质C.c一定是催化剂D.参加反应的a与d的质量比为7:87.M是硝酸钾或氯化铵中的一种。
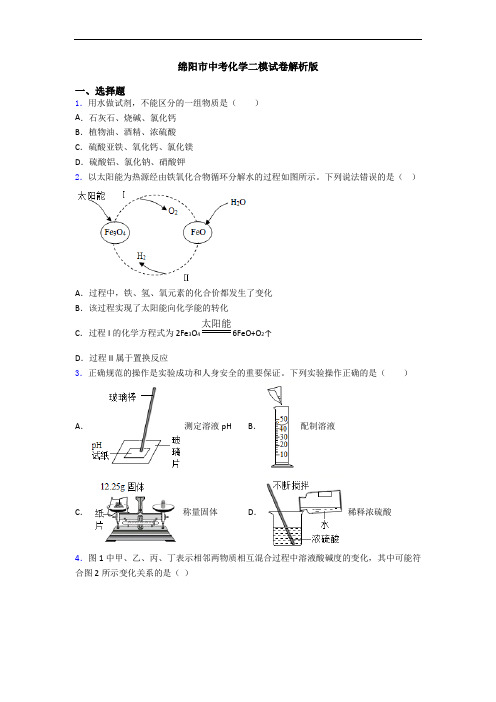
绵阳市中考化学二模试卷解析版一、选择题1.用水做试剂,不能区分的一组物质是()A.石灰石、烧碱、氯化钙B.植物油、酒精、浓硫酸C.硫酸亚铁、氧化钙、氯化镁D.硫酸铝、氯化钠、硝酸钾2.以太阳能为热源经由铁氧化合物循环分解水的过程如图所示。
下列说法错误的是()A.过程中,铁、氢、氧元素的化合价都发生了变化B.该过程实现了太阳能向化学能的转化C.过程I的化学方程式为 2Fe3O4太阳能6FeO+O2↑D.过程II属于置换反应3.正确规范的操作是实验成功和人身安全的重要保证。
下列实验操作正确的是()A.测定溶液pH B.配制溶液C.称量固体D.稀释浓硫酸4.图1中甲、乙、丙、丁表示相邻两物质相互混合过程中溶液酸碱度的变化,其中可能符合图2所示变化关系的是()A.甲B.乙C.丙D.丁5.除去下列物质中含有的少量杂质,所选用的试剂不正确的是A.A B.B C.C D.D6.下列有关物质的鉴别、检验、除杂所用的试剂或方法正确的是()A.A B.B C.C D.D 7.图示的四个图像分别对应四个变化过程的一种趋势,下列分析正确的是A.甲图:可能是双氧水溶液制氧气,a未使用催化剂,b使用了催化剂B.乙图:可能是加热一定质量的氯酸钾和二氧化锰固体混合物制取氧气过程C.丙图:可能是硫酸铜溶液中滴加氢氧化钠溶液D.丁图:可能是向一定量的氢氧化钠溶液中加水稀释,溶液的pH变化8.归纳总结能使知识系统化,有利于提高素质和能力,下面是一同学对部分化学知识的归纳,其中都正确的一项是A.A B.B C.C D.D9.实验室有碳酸钠和碳酸钙的固体混合物75g,使之与500g质量分数为14.6%的盐酸充分反应,将反应后的溶液蒸干得到82.7g固体。
则原混合物中金属元素的质量分数为()A.44% B.46% C.50% D.55%10.下列四个图像反映了对应实验过程中相关量的变化,其中错误的是A.部分变质的NaOH溶液中滴加稀盐酸B.HCl气体的溶解度受温度影响的变化曲线C.等质量的Mg粉和Fe粉A.A B.B C.C D.D11.下列图像能正确反映其对应操作中各量变化关系的是A.图①是给氯酸钾和二氧化锰的混合物加热B.图②是向一定温度下的饱和氢氧化钙溶液中不断加入氧化钙固体C.图③是向pH=1的酸溶液中不断加水D.图④是向一定质量的稀硫酸中加入锌粒12.相同质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如图所示.下列有关叙述正确的是A.金属活动性:N>M B.生成H2的质量相等C.相对原子质量:N>M D.消耗盐酸的质量相等13.A~G都是初中化学常见的物质,它们的部分反应及转化关系如图所示。
秘密★启用前【考试时间*2017年1月6日上牛9: 0C〜11: 30】绵阳市高中2014级第二次诊断性考试理科综合能力测试注意事项:1・本试卷分第I卷(选择题)和第II卷(非选择题)两部分。
答卷的,考生务必将自己的班级、姓名.考号填写在答题卡上。
2・回答第I卷时,选出每小題答案后,用铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其它答案标号。
写在本试卷上无效。
3・回答第II卷时,将答案写在答题卡上。
写在本试卷上无效。
4.考试结束后,将答题卡交回。
可能用到的相对原子质量:Hl C 12 O 16 S32 Cu64 Zn65 Ba 137第I卷一、选择题*本题共13小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7•化学与生产、生活和科研密切相关,下列说法错误的是A.用菜籽油浸泡花椒制得花椒油的过程未发生化学变化B.河水中有许多杂质和有害细菌,加入明矶消祷杀菌后可以饮用C・把浸泡过KMnO4溶液的硅藻土放在水果箱里可延长水果的保鲜期D・对医疗器械高溫消毒时,病毒蛋白质受热变性&下列关于常见有机物的说法正确的是A.乙醛和乙醇互为同分异构体B・糖类、油脂、蛋白质均能发生水解反应C.聚氯乙烯可用作生产食品包装材料的原料D・分子式为C3H B O的有机物,只有2种能发生酯化反应;•9•利用右下图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象选项a b c c试管中现象A浓盐酸KMnO^FeCb溶液溶液变棕黄色B稀硫酸N82S26谟水产生浅黄色沉淀C硼酸Na2COj Na2SiO s溶液析出白色沉淀D浓硝酸铁片KI •淀粉溶液溶液变蓝色正确的是10•从薄荷中提取的薄荷醇可制成医药。
薄荷醇的结构简式如下图,下列说法正确的是A.薄荷醇分子式为C10H2dO,它是环己醇的同系物B.薄荷醇的分子中至少有12个原子处于同一平面上C.薄荷醇在Cu或Ag做催化剂、加热条件下能被02氧化为醛D.在一定条件下,薄荷醇能发生取代反应、消去反应和聚合反应11 •用FeS?纳米材料制成的高容绘锂电池,电极分别是二硫化亚铁和金属锂,电解液是含锂盐的有机溶剂。
绵阳市高2011级第二次诊断性考试理科综合能力测试 物理参考答案及评分意见选择题(本题共7小题。
每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得6分,选对但不全的得3分,有选错的得0分)1. D2.C3.C4.A5.B6.BD7.AD非选择题(共68分)8.(1)①B (2分);②22575f s s - (2分),f s s s 102345-+(2分) (2)①D (2分)②从左至右(2分)③如右图(2分),变大(2分)④5.0Ω(3分)9. 解:(1)飞机在水平滑行过程中,根据动能定理 2021υm fx Pt =- ………………………(2分) 解得f =1.6×105N ………………………(2分)(2)该飞机升空后水平方向做匀速运动,竖直方向做初速度为零的匀加速运动,设运动时间为t ,竖直方向加速度为a ,升力为F ,则L = v o t ………………………(2分)h = 12at 2 ………………………(2分) 解得 t = 20s ,a =2m/s 2F – mg = ma ………………………(2分)F – mg = ma ………………………(2分)解得 F=1.2×105N设飞机机械能的改变量为Fh E =∆ ………………………(3分)解得=∆E 4.8×107J ………………………(2分)10.解:(1)设撤去外力,线拉力为T ,两金属棒的加速度大小相等,设为是a ,则 m 1g sin θ–T=m 1a ………………………(2分)T –m 2g sin θ=m 2a ………………………(2分)解得 a = 2 m/s 2 ………………………(2分)(2)a 、b 达到速度最大时,速度相等,设为v ,此时线拉力为T 1,a 中感应电动势为E 1,电流为I 1,b 中感应电动势为E 2,电流为I 2,则E 1=B 1L v ………………………(1分)I 1=E 1/R 1 ………………………(1分)E 2=B 2L v ………………………(1分)I 2=E 2/R 2 ………………………(1分)m 1g sin θ–T 1–B 1I 1L=0 ……………………(1分)T 1– m 2g sin θ–B 2I 2L =0 ………………………(1分)解得v =10m/s设两金属棒产生的焦耳热之和为Q ,由能量守恆22121)(21sin sin υθθm m gs m gs m Q +--=………………………(3分) 解得Q = 90 J ………………………(2分)11.解:(1) 小球在向下摆动过程中,设合力与竖直方向的夹角为θ,当速度方向与合力方向垂直时,即细线与竖直方向的夹角为θ时,速度最大,设为v m ,则mg qE 2tan =θ …………………(2分) 解得43tan =θ,θ=37°由动能定理有,有 2221)sin 1(cos m m L qE mgL υθθ=-- ………………………(2分) 解得 gL m =υ ………………………(1分) (2)设小球运动到P点正下方时速度为v 1,由动能定理有,有21221υm L qE mgL =- ………………………(2分) 解得 21gL =υ 小球运动到最低点时,细线被钉子挡住,做圆周运动的半径为r ,则根据牛顿第二定律,有h L r -= ………………………(1分) r mmg F 210υ=- ………………………(1分) 解得L h 43= ………………………(1分) (3)绳被拉断,小球进入第一象限,由于qE 1=mg ,所以小球沿水平方向做匀速直线运动。
绵阳市高中2014级第二次诊断性考试绵阳二诊化27题评分细则27题共15分,平均分6.16,难度系数0.411(1)p1<p2<p3或p3>p2>p1得1分。
升高温度(或加热)得1分、降低压强(或增大容器的体积)得1分。
有学生答成加 CO2或是把 CO移出不得分。
K a=K b<K c或者是a=b<c给1分,有学生答成其他字母如Kw没得分(2)66.7% 67% 66.6% 或是2/3都得(2分)163V或5.3/v(或用K p计算:(0.8p)20.2p=3.2×1.013 MPa=3.2416 MPa) 3.2也给了分,没有强调单位,这空是2分,学生失分很大,对平衡常数计算情况掌握不好。
(3)正反应和逆反应速率均减小得1分,答成“均减小”或“都减小”都得分,有些同学分开答只要说法正确都得分。
v(正)<v(逆)得(1分)答成正反应的速率减少比逆反应速率减少多,也得分。
(4)① CO2(g)+4H2(g)CH4(g)+2H2O(g) ∆H=-165.0 kJ/mol(2分)要求方程式系数和物质状态及的∆H正负和单位必须都对才得全分,对165可以不保留小数位数,对可逆符号也不作要求。
②-198 kJ/mol(2分)必须负号及数字单位全对得分。
反应温度、压强不同,键能数据不准确(1分)答到温度不同,或压强不同,或条件不同,都得分。
有同学达成水的状态不同,或该反应为可逆反应,或有热量散失都不得分。
从改卷情况,可以看出学生存在以下几方面的问题:1、审题能力有待提高,不仔细看题,如最后一空的,题上有一定条件下和298K来提示。
2、识图能力有待提高,如温度——压强——体积分数的基本图像不会分析。
3、计算能力有待提高,如用三段式计算转化率,和求平衡常数错误率太高。
4、答题不规范,如答反应热是不带负号和单位,热化学方程式忘写状态等。
理科综合能力测试·化学答案第1页(共1页)。
绵阳市高中2014级第二次诊断性考试理科综合能力测试·化学试题7、化学与生产、生活和科研密切相关,下列说法错误的是A.用菜籽油浸泡花椒制得花椒油的过程未发生化学变化B.河水中有许多杂质和有害细菌,加入明矾消毒杀菌后可以饮用C.把浸泡过KMnO4溶液的硅藻土放在水果箱里可延长水果的保鲜期D.对医疗器械高温消毒时,病毒蛋白质受热变性8、下列关于常见有机物的说法正确的是A.乙醚和乙醇互为同分异构体B.糖类、油脂、蛋白质均能发生水解反应C.聚氯乙烯可用作生产食品包装材料的原料D.分子式为C3H8O的有机物,只有2种能发生酯化反应9、利用右下图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象正确的是选项 a b c C试管中现象A.浓盐酸KMnO4FeCl2溶液溶液变棕黄色B.稀硫酸Na2S2O3溴水产生浅黄色沉淀C.硼酸Na2CO3Na2SO3溶液析出白色沉淀D.浓硝酸铁片KI-淀粉溶液溶液变蓝色10、从薄荷中提取的薄荷醇可制成医药。
薄荷醇的结构简式如下图,下列说法正确的是A.薄荷醇分子式为C10H20O,它是环己醇的同系物B.薄荷醇的分子中至少有12个原子处于同一平面上C.薄荷醇在Cu或Ag做催化剂、加热条件下能被O2氧化为醛D.在一定条件下,薄荷醇能发生取代反应、消去反应和聚合反应11、用FeS2纳米材料制成的高容量锂电池,电极分别是二硫化亚铁和金属锂,电解液是含锂盐的有机溶剂。
下列说法错误的是A.金属锂作电池的负极B.电池正极反应为FeS2+4Li++4e—=Fe+2Li2SC.放电时,Li+向负极迁移D.电池总反应为FeS2+4Li= Fe+2Li2S12、采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、A12O3,不考虑其他杂质)制取绿矾(FeSO4· 7H2O),某学习小组设计了如下流程:下列说法错误的是A.酸浸时选用足量硫酸,试剂X为铁粉B.滤渣a主要含SiO2,滤渣b主要含Al(OH)3C.从滤液B得到绿矾产品的过程中,必须控制条件防止其氧化和分解D.试剂X若为过量NaOH溶液,得到的沉淀用硫酸溶解,再结晶分离也可得绿矾13、常温下,用0.1000mol/L的盐酸滴定20.00mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示。
下列有关叙述正确的是A.a点溶液呈碱性的原因用离子方程式表示为:CO32—+2H2O H2CO3+2OH—B.c点处的溶液中c(Na+)—c(Cl—)=c(HCO3—)+2c(CO32—)C.滴定过程中使用甲基橙作为指示剂比酚酞更准确D.d点处溶液中水电离出的c(H+)大于b点处26. (14分)碱式碳酸铜可用于有机催化剂、杀虫剂及饲料中铜的添加剂,还可用于烟火和颜料制造。
CuSO4溶液与Na2CO3溶液反应能否得到碱式碳酸铜?某班同学进行相关探究。
【沉淀制备】称取12.5g胆矾溶于87.4 mL蒸馏水中,滴4滴稀硫酸,充分搅拌后得到CuSO4溶液。
向其中加入适量Na2CO3溶液,将所得蓝绿色悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
(1)滴加稀硫酸的作用是。
所得硫酸铜溶液的溶质质量分数为。
(2)用无水乙醇洗涤的目的是。
【实验探究】同学们设计了如下装置,用制得的蓝绿色固体进行实验:(3)D装置加热前,需要首先打开活塞K,用A装置制取适量N2,然后关闭Κ,点燃D处酒精灯。
A中产生N2的作用是,C中盛装的试剂应是。
(4)装置A中发生反应的离子方程式为。
(5)若蓝绿色固体的组成为xCuCO3· yCuOH)2,实验能观察到的现象是。
(6)同学们查阅文献知:Κsp[CaCO3]=2.8× 10—9,Κsp[BaCO3]=5.1×10—9,经讨论认为需要用Ba(OH)2代替Ca(OH)2来定量测定蓝绿色固体的化学式,其原因是。
a.Ba(OH)2的碱性比Ca(OH)2强b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2c.相同条件下,CaCO3的溶解度明显大于BaCO3d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小待D中反应完全后,打开活塞Κ,再次滴加NaNO3溶液产生N2,其目的是。
若定量分析所取蓝绿色固体质量为27.1g,装置F中使用Ba(OH)2溶液,实验结束后,装置E 的质量增加2.7g,F中产生沉淀19.7g。
则该蓝绿色固体的化学式为。
27.(15分)合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化。
为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+ CO2 (g)2CO(g)△H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:回答下列问题:(1)p l、p2、p3的大小关系是,欲提高C与CO2反应中CO2的平衡转化率,应采取的措施为。
图中a、b、c三点对应的平衡常数大小关系是。
(2)900℃、1.013MPa时,1mol CO2与足量碳反应达平衡后容器的体积为V,CO2的转化率为___ ,该反应的平衡常数Κ=。
(3)将(2)中平衡体系温度降至640℃,压强降至0.1013MPa,重新达到平衡后CO2的体积分数为50%。
条件改变时,正反应和逆反应速率如何变化? ,二者之间有何关系? 。
(4)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:CO(g) +3H2(g)CH4(g) +H2O(g)△H =-206.2kJ/molCO(g) +H2O (g)CO2(g) +H2(g)△H =-41.2kJ/mol①则二氧化碳与氢气反应转化为甲烷和水蒸气的热化学方程式是;②已知298Κ 时相关化学键键能数据为:化学键H-H O-H C-H C≡OE/kJ· mol—1436 465 413 1076则根据键能计算,△H 1= ,它与上述实测值差异较大的原因可能是。
28.(14分)电石广泛用于生产PVC、维尼纶等,电石与水反应所得残渣——电石渣,主要含Ca(OH)2、CaCO3及少量其他杂质。
某工业电石渣的几种回收利用流程如下:几种物质在水中的溶解度曲线见右图。
回答下列问题:(1)常温氯化①反应的化学方程式是;②提高Cl2转化为Ca(ClO)2的转化率可行的措施有(填序号)。
A.加热升高温度B.适当减缓通入Cl2速率C.充分搅拌浆料D.加水使Ca(OH)2完全溶解③电石渣中的有害杂质CN—与ClO—反应转化为两种无害的气体,每转化1mol CN—至少需要消耗氧化剂ClO—mol。
(2)75℃氯化①生成氯酸钙中氯的化合价为,氯化完成后过滤,滤渣的主要成分为(填化学式)。
②氯酸钙能与KCl反应转化为氯酸钾的原因是。
(3)有机反应首先生成氯代乙醇,其结构简式为,氯代乙醇再与Ca(OH)2反应生产环氧乙烷。
总反应的化学方程式是。
35.[化学一选修⒊物质结构与性质](15分)A、B、C、D、E代表前四周期原子序数依次增大的五种元素。
A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。
回答下列问题:(DB、C中第一电离能较大的是,基态D原子价电子的轨道表达式为。
(2)DA2分子的VSEPR模型是。
H2A比H2D熔沸点高得多的原因是。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。
已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
①C2Cl6属于晶体(填晶体类型),其中C原子的杂化轨道类型为杂化。
②[C(OH)4]—中存在的化学键有。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,其原因是。
(5)B、C的氟化物晶格能分别是2957 kJ· mol—1、5492 kJ· mol—1,二者相差很大的原因是。
(6)D与E所形成化合物晶体的晶胞如图所示。
①在该晶胞中,E的配位数为。
②原子坐标参数可表示晶胞内部各原子的相对位置。
右图晶胞中,原子坐标参数a为(0,0,0);b为(1/2,0,1/2);c为(1/2, 1/2,0)。
则d原子的坐标参数为。
③已知该晶胞的密度为ρg· cm—3,则其中两个D原子之间的距离为pm(列出计算式即可)。
36.[化学一选修5:有机化学基础](15分)缩醛在有机合成中常用于保护羰基或作为合成中间体,同时还是一类重要的香料,广泛应用于化妆品、食物、饮料等行业。
G是一种常用的缩醛,分子中含有一个六元环和一个五元环结构。
下面是G的一种合成路线:已知:①芳香烃A含氢元素的质量分数为8.7%,A的质谱图中,分子离子峰对应的最大质荷比为92;D的产量可以用来衡量一个国家的石油化工发展水平。
②③同一个碳原子连接两个羟基不稳定,易脱水形成羰基。
回答下列问题:(1)A的结构简式是,E的名称是。
(2)由D生成E的反应类型是,E→F的反应条件是。
(3)由B生成N的化学方程式为。
(4)有研究发现,维生素C可以作为合成G物质的催化剂,具有价廉、效率高、污染物少的优点。
维生素C的结构如图,则维生素C分子中含氧官能团名称为。
(5)缩醛G的结构简式为。
G有多种同分异构体,写出其中能同时满足以下条件的所有同分异构体的结构简式:。
①既能发生银镜反应,又能与FeCl3发生显色反应;②核磁共振氢谱为4组峰。
(6)写出用2-丁烯为原料(其他无机试剂任选)制备顺丁橡胶(顺式聚1,3-丁二烯)的含成路线:。
绵阳市高中2014级第二次诊断性考试理科综合能力测试·化学参考答案和评分标准第Ⅰ卷7. B 8. D 9. A 10. A 11. C 12. D 13. B第Ⅱ卷(一)必考题26.(14分)(1)抑制Cu2+水解,防止溶液变浑浊(1分)8.0%(1分)(2)利用乙醇易挥发的性质带走沉淀上面的水(1分)(3)排除装置中的空气,避免干扰(1分)浓硫酸(1分)(4)NO-2+NH+4△===N2↑+2H2O(2分)(5)硬质玻璃管中蓝绿色固体变黑色,E中白色固体变蓝,F中溶液变浑浊(2分)(6)b d(2分)让停留在装置中的气体被充分吸收,减小实验误差(1分)2CuCO3•3Cu(OH)2或3Cu(OH)2•2CuCO3或Cu5(OH)6(CO3)2(2分)27.(15分)(1)p1<p2<p3(1分)升高温度、降低压强(2分)K a=K b<K c(1分)(2)66.7%(2分)163V(或用K p计算:(0.8p)20.2p=3.2×1.013 MPa=3.2416 MPa)(2分)(3)正反应和逆反应速率均减小(1分) v (正)<v (逆)(1分)(4)① CO 2(g)+4H 2(g)CH 4(g)+2H 2O(g) ∆H =-165.0 kJ/mol (2分)② -198 kJ/mol (2分) 反应温度、压强不同,键能数据不准确(1分)28.(14分)(1)① 2Cl 2+2Ca(OH)2==CaCl 2+Ca(ClO)2+2H 2O (2分) ② BC (2分) ③ 2.5(2分)(2)① +5价(1分) CaCO 3、Ca(OH)2(2分) ② 75 ℃,氯酸钾的溶解度比氯酸钙、氯化钾、氯化钙都小得多(2分)(3)ClCH 2CH 2OH (1分) CH 2=CH 2+Cl 2+Ca(OH)2—→H 2C CH 2O+CaCl 2+H 2O (2分)(二)选考题35. [化学—选修3:物质结构与性质](15分)(1)镁(或Mg )(1分) (1分)(2)平面三角形(1分) H 2O 分子间存在氢键(1分)(3)①分子(1分) sp 3(1分) ②极性共价键、配位键(或共价键、配位键)(1分) (4)熔融MgCl 2能导电,可电解;MgO 熔沸点高,电解熔融MgO 能耗大(2分)(5)Al 3+比Mg 2+电荷高、半径小,AlF 3的晶格能比MgCl 2大得多(2分)(6)① 4(1分) ②(0, 1 2, 12)(1分) ③ 2 2 ×34×97 ρN A×1010(2分) 36. [化学—选修5:有机化学基础](15分) (1)CH 3(1分) 1, 2-二氯乙烷(1分) (2)加成反应(1分) NaOH 水溶液,加热(2分)(3)CHCl 22NaOH +H OCHO+2NaCl +H 2O (2分)(4)羟基、酯基(2分)(5)CHO CH 2CH 2或O CHO OH CH 3H 3CCHO OH CH 3H 3C (3分) (6)CH 3CH CHCH 2催化剂CH 3CH CHCH Cl Cl CH 2CH CH CH 2C CCH 2C H H H 2n(3分)。