沉淀溶解平衡
- 格式:pdf
- 大小:151.58 KB
- 文档页数:4




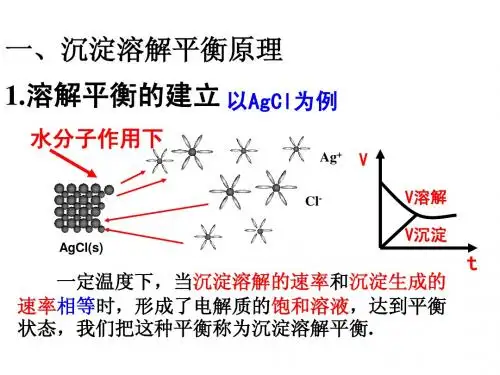
沉淀溶解平衡1概念:在一定条件下,当难溶电解质的溶解速率与溶液中的有关离子重新生成沉淀的速率相等时,此时溶液中存在的溶解和沉淀间的动态平衡,称为沉淀溶解平衡.溶解平衡时的溶液是饱和溶液。
2表达式:MmAn (s) mM n+(aq)+nA m—(aq)3特征:沉淀溶解平衡和化学平衡、电离平衡一样,符合平衡的基本特征、满足平衡的变化基本规律逆、动、等、定、变4影响溶解平衡的因素:①内因:电解质本身的性质②外因:AgCl(s) Ag+(aq) + Cl-(aq)a)浓度:①加水②增大相同离子浓度b)温度:升温多数平衡向溶解方向移动通常我们讲的外因包括浓度、温度、压强等。
对于溶解平衡来说,在溶液中进行,可忽略压强的影响。
思考:对于平衡AgCl Ag++Cl-?二、溶度积常数(Ksp ):概念:难溶固体在溶液中达到沉淀溶解平衡状态时,离子浓度保持不变(或一定)。
其离子浓度的计量系数次幂的乘积为一个常数这个常数称之为溶度积常数简称为溶度积,用Ksp表示。
表达式如Mg(OH)2(s) Mg2 + (aq) +2OH- (aq)25℃时,2+ )c 2(OH-) = 5.6×10-12mol3∙L-3练:请写出BaSO4、Al(OH)3、CuS的沉淀溶解平衡与溶度积KSP表达式。
BaSO4 (s) Ba2++ SO42- K SP=c(Ba2+)c(SO42-②Ksp相同类型(如AB型)的难溶电解质的Ksp越小,溶解度越小,越难溶。
如: Ksp (AgCl) > Ksp (AgBr) > Ksp (AgI)溶解度:AgCl > AgBr > AgI三、溶度积规则及沉淀溶解平衡的应用通过比较溶度积Ksp与溶液中有关离子Qc的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解。
①Qc=Ksp时,饱和溶液,沉淀溶解平衡状态②Qc > Ksp时, 过饱和溶液,沉淀生成。

沉淀溶解平衡:1、定义:在一定条件下,当难容电解质的溶解速率与溶液中的有关离子重新生成沉淀的速率相等,此时溶液中存在的溶解和沉淀间的动态平衡,称为沉淀溶解平衡。
例如:2、沉淀溶解平衡的特征:(1)逆:沉淀溶解平衡是可逆过程。
(2)等:(3)动:动态平衡,溶解的速率和沉淀的速率相等且不为零。
(4)定:达到平衡时,溶液中各离子的浓度保持不变,(5)变:当外界条件改变时,溶解平衡将发生移动,达到新的平衡。
3、沉淀溶解平衡的影响因素(1)内因:难溶电解质本身的性质。
(2)外因a.浓度:加水稀释,沉淀溶解平衡向溶解的方向移动,但不变。
b.温度:多数难溶电解质溶于水是吸热的,所以升高温度,沉淀溶解平衡向溶解的方向移动,同时变大。
c.同离子效应:向沉淀溶解平衡体系中,加入含原体系中某离子的物质,平衡向沉淀生成的方向移动,但不变。
d.其他:向沉淀溶解平衡体系中,加入可与体系巾某些离子反应生成更难溶的物质或气体的物质,平衡向溶解的方向移动,不变。
沉淀溶解平衡的应用:1.沉淀的生成(1)意义:在涉及无机制备、提纯工艺的生产、科研、废水处理等领域中,常利用生成沉淀来达到分离或除去某些离子的目的。
(2)方法a.调节pH法:如工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7~8,可使转变为沉淀而除去。
b.加沉淀剂法:如以等作沉淀剂,使某些金属离子如等生成极难溶的硫化物等沉淀,也是分离、除杂常用的方法。
说明:化学上通常认为残留在溶液中的离子浓度小于时即沉淀完全。
2.沉淀的溶解(1)意义:在实际工作中,常常会遇到需要使难溶物质溶解的问题、根据平衡移动原理,对于在水中难溶的电解质,如果能设法不断地移去沉淀溶解平衡体系中的相应离子,使平衡就会向沉淀溶解的方向移动,使沉淀溶解。
(2)方法a.生成弱电解质:加入适当的物质,使其与沉淀溶解平衡体系中的某离子反应生成弱电解质。
如向沉淀中加入溶液,结合生成使的溶解平衡向右移动。

未知驱动探索,专注成就专业
沉淀溶解平衡
沉淀溶解平衡是指在溶液中存在着溶解物质与沉淀物质之间的平衡。
当溶解物质和沉淀物质之间的反应达到动态平衡时,称为沉淀溶解平衡。
在沉淀溶解平衡中,溶解物质会溶解为离子,在溶液中以溶解度的形式存在。
而沉淀物质则会以固态的形式存在,在溶液中无法溶解。
溶解物质和沉淀物质之间的平衡是受溶液中各种离子浓度和溶液温度等因素的影响的。
当溶液中的离子浓度超过了溶解度时,溶解物质就会发生沉淀,反之,当溶液中的离子浓度低于溶解度时,沉淀物质就会溶解。
沉淀溶解平衡在实际应用中有广泛的应用。
例如,在水处理过程中,我们常常需要控制水中的溶解物质(如钙、镁等)和沉淀物质(如碳酸钙、硫酸钙等)之间的平衡,以防止沉淀物质堆积在管道和设备上,造成堵塞和损坏。
1。



沉淀溶解平衡一.沉淀溶解平衡沉淀溶解过程—速率v1AgCl(s)Ag+(aq) + Cl—(aq)沉淀生成过程—速率v2v1 >v2——沉淀溶解——溶液不饱和v1 = v2——溶解的沉淀= 生成的沉淀——溶液饱和——处于平衡状态v1 ﹤v2 ——沉淀生成——溶液过饱和1.概念1)溶解度:在一定温度下,某物质在100g溶剂里达到饱和状态所溶解的克数,叫做这种物质在这种溶剂里的溶解度。
2)不饱和溶液:在一定温度下,溶液的浓度小于在该温度下的饱和溶液的浓度。
3)过饱和溶液:在一定温度和压强下,溶剂中所溶解的溶质超过最大量的溶液,叫做这种溶质的过饱和溶液。
有些物质的溶解度随温度的升高而增大。
在较高温度下配制成它的饱和溶液,并细心滤去过剩的未溶固体,然后使溶液慢慢降到室温,但尚未析出晶体,这时得到的溶液就是过饱和溶液。
硫酸钠、醋酸钠、硼砂、硫代硫酸钠、蔗糖等物质都容易形成过饱和溶液。
过饱和溶液存在的原因是,有些溶质在饱和溶液中不容易形成结晶中心(即晶核)。
每种晶体都有一定的排列顺序(即晶格),使原来无秩序运动的溶质质点按照这种晶体的晶格次序排列起来。
有些物质要经过相当长的时间才能自行产生结晶中心,因此这些物质的过饱和溶液还是比较稳定的。
从本质上看,过饱和溶液是处于不平衡状态或称介稳定状态。
在过饱和溶液中投入一小颗溶质的晶体(或投入晶形相同的其他物质),能使过量的溶质在短时间内结晶出来,得到饱和溶液。
用力振荡或充分搅动过饱和溶液,或者摩擦容器的器壁,也能使过量的溶质迅速结晶出来。
4)沉淀溶解平衡:一定温度下,当沉淀溶解的速率和沉淀生成的速率相等时,形成溶质的饱和溶液,达到平衡状态,人们将这种平衡称为沉淀溶解平衡。
2.特点:将一块形状不规则的NaCl固体放入NaCl饱和溶液中,一昼夜后观察发现,固体变为规则的立方体,而质量却未发生变化逆:是一个可逆的过程等:v1 = v2动:v1 = v2≠0——动态平衡定:溶液中溶质的分子或离子的浓度不再变化。
沉淀溶解平衡知识点沉淀溶解平衡是化学平衡的一种,涉及到溶解度的概念和沉淀生成与转化等知识点。
下面将对沉淀溶解平衡知识点进行详细的介绍。
一、沉淀溶解平衡的定义沉淀溶解平衡是指在一定温度下,当溶液中的离子浓度达到平衡状态时,沉淀溶解反应停止,形成的固体和溶液中各离子的浓度保持不变的状态。
此时,溶液中的阴阳离子浓度满足溶度积常数,并且溶液中的沉淀和溶解反应速率相等。
二、沉淀溶解平衡的特点1、动态平衡:沉淀溶解平衡是一个动态平衡,即沉淀和溶解反应不断进行,但速率相等,因此溶液中的离子浓度保持不变。
2、溶解度与温度有关:物质的溶解度随温度变化而变化。
一般来说,温度越高,溶解度越大。
3、溶度积常数:在一定温度下,沉淀溶解平衡时,溶液中的阴阳离子浓度满足溶度积常数。
这个常数只与温度有关,与溶液的浓度无关。
4、沉淀的生成与转化:当溶液中某离子的浓度超过其溶度积常数时,会形成沉淀。
然而,形成的沉淀可以转化为更难溶的物质,或者转化为可溶性的化合物。
三、沉淀溶解平衡的应用1、判断沉淀的生成与转化:通过比较溶液中的离子浓度和溶度积常数,可以判断是否会形成沉淀以及沉淀的生成与转化。
2、计算溶解度:已知某物质的溶度积常数和溶液中的离子浓度,可以计算该物质的溶解度。
3、处理工业废水:在处理含有重金属离子的工业废水时,可以利用沉淀溶解平衡的原理,将重金属离子转化为难溶性的化合物,从而降低对环境的危害。
4、药物制备:在药物制备过程中,可以利用沉淀溶解平衡的原理,将药物中的有效成分转化为难溶性的化合物,以提高药物的疗效和稳定性。
总之,沉淀溶解平衡是化学平衡的一种重要类型,涉及到溶解度的概念和沉淀生成与转化等知识点。
理解并掌握沉淀溶解平衡的概念和特点对于解决相关问题具有重要意义。
“沉淀溶解平衡”的单元整体教学设计一、教学内容与目标本单元将带领学生探究沉淀溶解平衡的原理及其在日常生活中的应用。
通过实验和实践,学生将了解沉淀溶解平衡的基本概念,掌握沉淀溶解平衡的规律,了解影响沉淀溶解平衡的因素,并能够解释这些因素对沉淀溶解平衡的影响。
第五章沉淀的形成与沉淀平衡5.1填空题1.CaF2的溶度积常数表达式为_______,Bi2S3的溶度积常数表达式为_______。
2.Mn(OH)2的K spΘ为1.9×10-13,在纯水中其溶解度为_______mol·L-1;0.050molMn(OH)2(s)刚好在浓度为_______mol·L-1,体积为0.5L的NH4Cl溶液中溶解。
3.PbSO4的K spΘ为2.53×10-8,在纯水中其溶解度为________mol·L-1;在浓度为1.0×10-2mol·L-1的Na2SO4溶液中达到饱和时其溶解度为________mol·L-1。
4.在AgCl,CaCO3,Fe(OH)3,MgF2,ZnS这些物质中,溶解度不随pH变化的是____________________。
5.在CaCO3(K spΘ=3.36×10-9),CaF2(K spΘ=3.45×10-11),Ca3(PO4)2(K spΘ=2.07×10-33)这些物质的饱和溶液中,Ca2+浓度由大到小的顺序为_________。
6.Mg(OH)2与MnCO3的K spΘ分别为5.61×10-12和2.2×10-11,在它们的饱和溶液中[Mn2+]比[Mg2+]___________。
7.已知Sn(OH)2,Al(OH)3,Ce(OH)4的K spΘ分别为5.45×10-27,1.3×10-33,2.0×10-28,则它们饱和溶液的pH大小由小到大的顺序为_________。
8.已知K spΘ(Ag2CrO4)=1.12×10-12,K spΘ(PbCrO4)=2.8×10-13,K spΘ(PbI2)=9.8×10-9,K spΘ(CaCrO4)=7.1×10-4,向Ag+,Pb2+,Ca2+的混合溶液中滴加K2CrO4溶液,Ag+,Pb2+,Ca2+的的浓度均为0.10mol·L-1,则出现沉淀的次序为_________;若将沉淀转化为PbI2沉淀,转化反应方程式为__________,其转化的平衡常数为____________。
9.同离子效应使难溶电解质的溶解度__________;盐效应使难溶电解质的溶解度_______。
5.2选择题1.已知在Ca3(PO4)2的饱和溶液中,[Ca2+]=2.0×10-6mol·L-1,[PO43-]=1.58×10-6mol·L-1,则Ca3(PO4)2的K spΘ为()(A).2.0×10-29;(B).3.2×10-12;(C).6.3×10-18;(D).5.1×10-27。
2.已知K spΘ(CaF2)=3.45×10-11,在0.250L0.10mol·L-1的Ca(NO3)2溶液中能溶解CaF2()(A).1.0×10-5g;(B).1.8×10-4g;(C).2.0×10-5g;(D).9.0×10-4g。
3.已知K spΘ(Ag2SO4)=1.20×10-5,K spΘ(AgCl)=1.77×10-10,K spΘ(BaSO4)=1.08×10-10,将等体积的0.0020mol·L-1的Ag2SO4与2.0×10-6mol·L-1的BaCl2溶液混合,将会出现()(A).BaSO4沉淀;(B).AgCl沉淀;(C).BaSO4与AgCl共沉淀;(D).无沉淀。
4.下列有关分步沉淀的叙述中正确的是()(A).溶度积小者一定先沉淀出来;(B).沉淀时所需沉淀剂浓度小者先沉淀出来;(C).溶解度小的物质先沉淀;(D).被沉淀离子浓度大的先沉淀。
5.SrCO3在下列试剂中溶解度最大的是()(A).0.10mol·L-1HAc;(B).0.10mol·L-1SrCO3;(C).纯水;(D).1.0mol·L-1Na2CO3。
6.欲使CaCO3在水溶液中溶解度增大,可以采用的办法是()(A).加入1.0mol·L-1Na2CO3;(B).加入2.0mol·L-1NaOH;(C).加入0.10mol·L-1CaCl2;(D).降低溶液的pH。
7.向饱和AgCl溶液中加水,下列叙述正确的是()(A).AgCl的溶解度增大;(B).AgCl的溶解度、K spΘ均不变;(C).AgCl的K spΘ增大;(D).AgCl的溶解度、K spΘ增大。
8.已知K spΘ(ZnS)=2.5×10-22。
在某溶液中Zn2+的浓度为0.10mol·L-1,通入H2S气体,达到饱和(c(H2S)=0.10mol·L-1),则ZnS开始析出时,溶液的[H+]为()(A).0.51;(B).0.15;(C).0.21;(D).0.45。
9.将等体积的0.20mol·L-1的MgCl2溶液与浓度为4.0mol·L-1的氨水混合,混合后溶液中[Mg2+]为混合前溶液中c(Mg2+)的多少倍?()(A).1.54×10-3;(B).1.1×10-3;(C).1.54×10-4;(D).1.1×10-4。
10.为除去PbCrO4中的SO42-杂质,每次用100mL去离子水洗涤,一次和三次后的损失分别是()(A).1.7mg,5.1mg;(B).0.017mg,0.051mg;(C).0.17mg,3.4mg;(D).0.17mg,5.1mg。
11.在浓度均为0.10mol·L-1的Zn2+、Cd2+、Hg2+的混合溶液中,[H+]=2.0mol·L-1,向溶液中通入H2S至饱和,不生成沉淀的离子是()(A).Zn2+、Cd2+;(B).Cd2+、Hg2+;(C).Zn2+;(D).Zn2+、Hg2+。
12.欲使Ag2CO3转化为Ag2C2O4(K spΘ=5.3×10-12),必须使()(A).[C2O42-]>0.63[CO32-];(B).[C2O42-]>1.6[CO32-];(C).[C2O42-]<1.6[CO32-];(D).[C2O42-]<0.63[CO32-]。
13.In order to remove90%of the Ag+from a solution originally0.10mol·L-1in Ag+,the [CrO42-]must be()(A).1.12×10-12;(B).1.12×10-11;(C).1.12×10-10;(D).1.12×10-8.14.The addition of AgNO3to a saturated solution of AgCl would()(A).cause more AgCl to precipitate;(B)..increase the solubility of AgCl due to the interionic attraction of NO3-and Ag+;(C).lower the value of Kθsp for AgCl;(D)..shift to the right the equilibrium AgCl(s)Ag+(aq)+Cl-(aq).15.To separate and identify the ions in a mixture that may contain Pb2+,Cu2+and Mg2+,one might add the reagents H2S,HCl and NaOH,they should be added in the order.()(A).HCl,H2S,NaOH;(B).H2S,HCl,NaOH;(C).HCl,NaOH,H2S;(D).NaOH,H2S,HCl.16.CrO42-is used as an indicator in the titration of Cl-with Ag+because()(A).it is yellow,whereas Cl-is colorless;(B).Ag2CrO4,unlike AgCl is soluble in water;(C).Ag2CrO4precipitates before AgCl;(D).Ag2CrO4precipitates only when virtually all the Cl-has reacted.5.3简答题1.根据溶度积规则说明下列事实。
(1)CaCO3沉淀能溶解于HAc溶液中;(2)Fe(OH)3沉淀溶解于稀硫酸溶液中;(3)BaSO4难溶于稀盐酸中;(4)MnS溶于醋酸溶液,而ZnS不溶于醋酸溶液,但能溶于稀盐酸中;(5)AgCl不溶于稀盐酸(2.0mol·L-1),但可适当溶解于浓盐酸中。
2.何谓定向速率?聚集速率?它们各主要由什么因素所决定?3.如何得到纯净、粗大的晶形沉淀?4.非晶形沉淀的沉淀条件是什么?5.影响沉淀纯度的主要因素有哪些?如何减免?5.4计算题1.根据AgIO3和Ag2CrO4的溶度积,通过计算说明:(1)哪一种化合物的溶解度大;(2)在0.01mol·L-1AgNO3溶液中,哪一种化合物的溶解度大。
2.根据Mg(OH)2的溶度积计算以下情况下其溶解度:(1)在水中;(2)在0.010mol·L-1NaOH溶液中;(3)在0.010mol·L-1MgCl2溶液中。
3.计算CaC2O4沉淀在pH=3.0,c(C2O42-)=0.010mol·L-1的溶液中的溶解度。
4.CaCO3能溶于HAc溶液中。
若沉淀达到溶解平衡时溶液中的[HAc]为1.0mol·L-1,且室温下反应产物H2CO3在水溶液中的饱和浓度为0.040mol·L-1,试求1.0L溶液中能溶解多少CaCO3?共需多大浓度的HAc?5.于100mL含0.1500g Ba2+的溶液中,加入50mL0.010mol·L-1H2SO4溶液,问溶液中会析出多少克BaSO4?如沉淀用100mL纯水或100mL0.01mol·L-1H2SO4洗涤,假设洗涤时达到了沉淀-溶解平衡,问损失多少克BaSO4?6.某溶液中含有Pb2+和Zn2+,两者的浓度均为0.10mol·L-1,在室温下通入H2S(g)使之成为饱和溶液,并加HCl控制S2-浓度。