8范德瓦尔斯方程
- 格式:ppt
- 大小:1.86 MB
- 文档页数:9



理想液体状态方程理想气体状态方程是描述气体的压力、体积和温度之间关系的数学公式。
而理想液体状态方程描述的是理想液体的压力、体积和温度之间的关系。
尽管理想液体的状态方程不像理想气体那样普适,但从分子的角度来看,液体也是由分子组成,它们之间存在着相互作用力。
因此,通过分子动理论以及温度、压力、体积的变化,我们可以得到理想液体的状态方程。
理想液体状态方程的一个经验公式是范德瓦尔斯方程,其可以用来近似描述各类液体的状态。
范德瓦尔斯方程如下:(P + a/V^2)(V - b) = RT其中,P是液体的压强,V是液体的摩尔体积,T是液体的温度,R是气体常量。
在范德瓦尔斯方程中,a和b分别表示范德瓦尔斯常数,可以通过实验数据拟合得到。
范德瓦尔斯方程是一种修正的理想状态方程,它引入了分子之间的吸引和斥力,可以更好地描述液体的行为。
其中,a/V^2的作用是修正液体分子之间的吸引力,V - b的作用是修正分子之间的排斥力。
需要注意的是,范德瓦尔斯方程只是一种近似公式,并不能精确描述液体的状态。
因为液体的分子之间的相互作用力较为复杂,范德瓦尔斯方程无法完全考虑其中的所有因素。
因此,在实际计算中,我们可能需要根据具体的实验数据以及液体的性质来选择适合的修正参数,以得到更准确的结果。
除了范德瓦尔斯方程,还有许多其他的状态方程可以用来描述液体的特性,比如改进的范德瓦尔斯方程、纯液体状态方程等。
这些方程的形式都是类似的,都是通过引入修正因子来考虑分子之间的相互作用,以更好地描述液体的状态。
综上所述,理想液体状态方程可以用范德瓦尔斯方程来近似描述。
通过引入范德瓦尔斯常数和修正因子,可以修正液体分子之间的相互作用力,使得方程更为准确。
但需要注意的是,液体的状态方程因涉及到复杂的分子相互作用,所以理想液体状态方程只是一种近似形式,实际计算中可能需要根据具体情况选择适用的修正参数。

范德华方程范德华方程范德华方程是范德瓦耳斯方程的另一种翻译,简称范氏方程,是荷兰物理学家范德瓦耳斯(van der Waals,又译“范德华”、“凡德瓦耳”)于1873年提出的一种实际气体状态方程。
1范德华方程范德华方程是范德瓦耳斯方程的另一种翻译,简称范氏方程,是荷兰物理学家范德瓦耳斯(van der Waals,又译“范德华”、“凡德瓦耳”)于1873年提出的一种实际气体状态方程。
范氏方程是对理想气体状态方程的一种改进,特点在于将被理想气体模型所忽略的的气体分子自身大小和分子之间的相互作用力考虑进来,以便更好地描述气体的宏观物理性质。
2适用范围范氏方程对气-液临界温度以上流体性质的描写优于理想气体方程。
对温度稍低于临界温度的液体和低压气体也有较合理的描述。
但是,当描述对象处于状态参量空间(P,V,T)中气液相变区(即正在发生气液转变)时,对于固定的温度,气相的压强恒为所在温度下的饱和蒸气压,即不再随体积V(严格地说应该是单位质量气体占用的体积,即比容)变化而变化,所以这种情况下范氏方程不再适用。
3与理想气体方程模拟结果的比较3.1低压状况在气体压强不太高的情况下,以下事实成立:排斥体积b 的影响相对V 而言极小,可以忽略;以二氧化碳(CO2)为例,在标准状况(0°C,1标准大气压)下,一摩尔CO2体积V 为22414 cm³,而相应的b= 43 cm³,比V 小3个数量级;分子间的距离足够大,a/V² 项完全可以视为0;譬如在一大气压下二氧化碳气体的a/V² 值只有7‰。
所以此时理想气体方程是范氏方程(也是对实际气体行为的)的一个良好近似。
分别用理想气体方程和范德瓦耳斯方程模拟的二氧化碳气体70°C时的p-V等温线3.2中高压状况随着气体压力的增加,范氏方程和理想气体方程结果的差别会变得十分明显(左图为CO2分别用理想气体方程和范德瓦耳斯方程模拟的p-V等温线,温度70°C):在压强为5000~15000kPa(50~150标准大气压)的中压区,由于体积被“压小”导致分子间距靠近,分子间的引力(表现为a/V² 项)变得不可忽略。

范德瓦尔斯状态方程改正量b范德瓦尔斯方程是一个热力学方程,用于描述气体的状态和性质。
当然不是每个气体都满足这个方程,因为气体的状态和性质受许多因素影响,如温度,压力和组成。
因此,范德瓦尔斯方程需要一些改正,以使其能够在更广泛的条件下适用。
其中一个改正就是范德瓦尔斯状态方程的改正量b。
在范德瓦尔斯方程中,我们假设气体分子是一个点,这样就忽略了它们的体积。
然而,实际上分子占据一定的空间,这对于高压下的气体尤其重要。
因此,我们需要一个改正来考虑气体分子的体积占据,这个改正即范德瓦尔斯状态方程的改正量b。
改正量b的具体定义是气体分子体积和压缩系数的乘积,可以表示为b = Vm - nB / V,其中Vm是摩尔体积,n 是气体摩尔数,B是已知常数。
常数B代表气体分子之间的相互作用力,因此它可以用来描述气体的相互作用性质。
改正量b的引入使得范德瓦尔斯方程考虑到了气体分子的体积占据,并因此更准确地描述了气体的状态和性质。
在低压下,气体的分子间距较大,其相互作用相对较小,因此b对范德瓦尔斯方程的影响也相对较小。
但是在高压下,气体的分子之间距离变得极短,相互作用力增强,因此b变得非常重要,需要被考虑进入范德瓦尔斯方程中。
由于b的引入,范德瓦尔斯方程可以更准确地描述气体的状态和性质,特别是在高压下的情况下,范德瓦尔斯方程的改正量b的引入可以进一步扩展气体的可适用范围,提高相应的计算准确度。
虽然b的引入就范德瓦尔斯方程的改正有了重要的影响,但是它是一个经验性改正,只能考虑部分气体的相互作用。
然而,它对气体的状态和性质的描述还是有很重要的作用。
范德瓦尔斯方程需要进一步改正以考虑其他性质和状态,以使该方程成为更适用于各种气体的普遍性方程。
在研究过程中,气体的状态、性质、相互作用等影响因素应该进一步明确,以帮助改进范德瓦尔斯方程,推进气体理论及实际应用的研究。

范德瓦尔方程常用于描述气体的状态方程,通过引入修正参数a和b,更准确地描述了实际气体与理想气体之间的差异。
本文将从范德瓦尔方程的历史背景、基本原理、常用气体以及参数a和b的物理意义等方面展开阐述。
一、范德瓦尔方程的历史背景1. 范德瓦尔方程的提出荷兰物理学家约翰内斯·范德瓦尔(Johannes Diderik van der Waals)于1873年提出了范德瓦尔方程,用以修正理想气体状态方程的不足之处。
范德瓦尔发现,在高压和低温条件下,实际气体与理想气体之间存在较大差异,因此他引入了修正参数a和b,使得范德瓦尔方程更适用于描述实际气体的状态。
2. 范德瓦尔方程的意义范德瓦尔方程的提出填补了理想气体状态方程在描述实际气体时的不足,为研究气体的物理性质和化学反应提供了重要的理论基础。
范德瓦尔方程的成功应用也为后来状态方程的修正和发展奠定了基础。
二、范德瓦尔方程的基本原理1. 理想气体状态方程理想气体状态方程描述了理想气体的状态与压力、体积、温度之间的关系,通常表示为PV = nRT,其中P为压力,V为体积,n为物质的量,R为气体常数,T为温度。
2. 范德瓦尔方程的修正范德瓦尔方程对理想气体状态方程进行了修正,引入了修正参数a 和b。
修正参数a反映了气体分子间由于吸引力而形成的分子间作用力,修正了理想气体方程在描述分子间相互作用时的不足;而修正参数b则反映了气体分子的实际体积,修正了理想气体方程忽略分子体积的缺陷。
三、范德瓦尔方程中常用气体1. 氢气氢气是范德瓦尔方程中常用的气体之一,其分子间随距离变化的作用力很小,因此修正参数a较小。
2. 氧气氧气的分子间作用力较大,因此修正参数a较大。
氧气分子较大,占据一定体积,因此修正参数b也较大。
3. 氮气氮气与氧气同属于常用气体,其修正参数a和b介于氢气和氧气之间,反映了分子间作用力和分子体积对气体性质的影响。
四、范德瓦尔方程中参数a和b的物理意义1. 参数a的物理意义参数a反映了气体分子间由于吸引力而形成的分子间作用力,即分子之间由于范德瓦尔斯力而产生的吸引力。

范德霍夫方程范德霍夫方程(Van der Waals equation)是19世纪末荷兰物理学家约翰内斯·迪德里克·范德华尔斯(Johannes Diderik van der Waals)提出的一种修正理想气体状态方程,用于描述实际气体的状态。
范德华尔斯方程的形式为:(P + a/V^2)(V - b) = RT其中,P为气体的压强,V为气体的体积,T为气体的温度,R为理想气体常量。
方程中的a和b分别是常数,代表分子间相互作用力和分子体积对气体状态的修正。
在范德华尔斯方程中,第一项(P + a/V^2)修正了分子间吸引力,第二项(V - b)修正了分子体积的影响。
这样,相较于理想气体方程PV = RT,范德华尔斯方程考虑了真实气体分子间相互作用力和分子体积,更接近实际。
范德华尔斯方程可以从分子角度来理解。
分子之间存在排斥力和吸引力。
排斥力导致分子不能无限靠近,进而增加气体体积;吸引力使气体分子聚集在一起,进而增加气体的压强。
范德华尔斯方程中的参数a和b正是为了考虑这两个因素的影响。
参数a主要用于修正气体的吸引力。
在范德华尔斯方程中,气体分子间的吸引力会减小气体压强,所以要将实际压强加上一个修正项a/V^2。
参数a的大小与气体分子间的相互作用强度有关,一般情况下,极性分子作用力较强,所以a的值较大。
参数b主要用于修正气体的体积。
气体分子占据一定的体积,会减小气体的实际体积。
所以要将实际体积减去一个修正项b。
参数b的大小与气体分子体积有关,分子体积较大的气体b的值会较大。
范德华尔斯方程的好处在于适用范围较广,可以描述气体在较宽压强和温度范围内的状态。
对于低压强和高温度下,范德华尔斯方程可以退化为理想气体状态方程。
对于高压强和低温度下,范德华尔斯方程可以更准确地描述气体的状态。
然而,范德华尔斯方程仍然存在一些局限性。
首先,参数a和b是针对特定气体确定的,不同气体的分子间相互作用情况不同,所以参数a和b需要针对不同的气体进行调整。

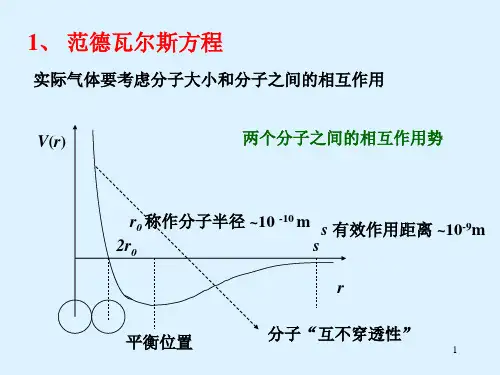
论述范德瓦尔斯状态方程的物理意义
任何情况下都严格遵守气体实验定律的气体可以看成理想气体。
同时,气体实验定律是在压强不太大(与大气压相比)、温度不太低(与室温相比)的条件下获得的,因此只要在此条件下一般气体都可以近似视作理想气体。
以理想气体模型为基础,范德瓦尔斯气体模型考虑分子间吸引和排斥力后所做的修正在一定程度上可以体现真实气体的部分性质,如临界现象等。
但范德瓦尔斯等温线与真实气体等温线还有明显的区别,尤其在温度较低时,因此它只能作为研究真实气体的参考模型,还有不完善和有待改进之处。


范德瓦尔斯方程中有关分子吸引力引起的修正问题专业:电子信息与物理系姓名:郑凯学号:08405142指导教师:张栓柱摘要:本文用统计的方法导出范德瓦尔斯方程及修正值的具体表达式, 并讨论修正量与状态量的关系,对范德瓦尔斯方程的提出背景及其内涵作一系统介绍关键词:范德瓦尔斯方程统计解释历史分子力1873年以前, 人们一直沿用理想气体的状态方程PV=νRT, 此方程适用于低压、高温的条件下; 可是由实际气体的等温线可知, 在低温高压下, 实际气体与理想气体有很大不同。
因此, 需要对理想气体的状态方程作一定的修正, 1873年范德瓦尔斯对理想气体的两条假设作改进, 得出了能描述真实气体行为的范德瓦尔斯方程。
这一方程的建立, 对气体动理论与实际气体的状态更加的接近了, 范德瓦尔斯的贡献及历史沿革可以由以下几个方面论述。
1、气体动理论的发展范德瓦尔斯方程是1873年提出的,它是分气体动理论中最重要的一叶。
在此之前,气体动理论经历了大致三个阶段。
第一阶段是在17世纪。
意大利托里拆利研究大气压强,获得了托里拆利真空。
法国的帕斯卡研究了流体压强,建立了液体压强的有关定律。
在这基础上形成了朴素的热动力学概念。
1658年,波意耳通过实验,取得空气体积和压强成反比的定量关系。
波意耳认为:空气是由大量的小颗粒组成的,浮游在涡旋运动的宇宙物质中,所以这些粒子不停地杂乱无章地云顶。
这是最初的气体动理论,用它能解释压强是如何形成的。
第二阶段是187世纪到19世纪上半叶。
1738年,伯努利提出“弹子球”模型:把空气看成是“弹性流体”,一颗颗的“弹子球”与器壁碰撞, 由此可导出气体定律。
这个观点是气体动理论的基础, 也正是后来被称之为“理想气体”的模型。
第三阶段是在19世纪中叶后。
焦耳热功当量实验和空气自由膨胀实验, 推动了热动力学的发展, 使气体动理论的研究进入了一个新阶段。
作为热动力学奠基人之一的德国物理学家克劳休修, 第一个发表论文, 阐述了分子运动理论, 他还提出了气体分子平均自由程的概念, 创立了作为后来导出气体状态方程基础的“维里理论”。
2van der Waals 状态方程及其对科学的贡献19世纪初,在Boyle(玻义耳)、Gay -Lussac(盖-吕萨克)和Avogadro(阿伏伽德罗)等学者的努力下,一个能够描述低密度气体pVT 行为的经验方程pV m =RT (2-1)已被确立,式中R 是一个普适的常数,称为摩尔气体常数,V m 为气体的摩尔体积。
但是,要说发展成一个理论,应当归功于德国物理学家R J E Clausius(克劳修斯),他在1857年首先用气体分子运动论导得了这个方程。
在推导中,他为低密度气体设想了如下微观模型:①气体是大量分子的集合体。
②分子在容器中作无规则运动,它们的运动遵守牛顿运动定律。
③分子本身的大小可以忽略不计。
④除了碰撞外,分子间没有相互作用。
⑤分子间和分子与器壁间的碰撞是弹性碰撞。
显而易见,这是一个十分粗放的理想模型。
完全符合这种模型的气体称为理想气体。
故式(2-1)称为理想气体状态方程。
理想气体状态方程的一个显著特征是:它的等温线总是一些双曲线。
无论温度多么低,压力多么高,都不可能使其液化,故理想气体是一种永久气体。
显然,这与人们的经验很不相符。
经验表明,任何物质都能够气液相变,在一定的温度下都有确定的饱和蒸气压,温度愈高,饱和蒸气压愈大。
然而,这种平衡关系是否会随温度的升高而无限地保持下去呢?这个看似简单的问题,却让不少著名物理学家困惑了近50年,直到1869年才得出了明确的结论。
这归功于英国物理学家T Andrews(安德鲁斯),他用了将近十年的时间,对气体的压缩性做了一系列实验,特别是二氧化碳。
他发现随着温度的升高,平衡的气液两相密度差逐渐缩小,到了31℃时,两者差别消失,蒸发焓变为零,即气液平衡到此终止。
Andrews 称此为“临界点”,意即以此为界,当温度超过31℃时,无论压力多高,都不可能使气体液化。
当Andrews 将这些实验结果在英国皇家学会作了题为“论物质液态和气态的连续性”报告后,立即引起了世界各国学者的关注。
气体状态方程与摩尔体积气体状态方程是描述气体性质以及其与其他物理量之间关系的方程。
其中,摩尔体积是指单位摩尔物质的气体所占据的体积。
本文将介绍常见的气体状态方程以及摩尔体积的概念和计算方法。
一、理想气体状态方程理想气体状态方程是描述理想气体性质的方程,它由德国物理学家斯蒂芬·博尔兹曼于19世纪末提出。
理想气体状态方程可以表示为以下形式:PV = nRT其中,P表示气体的压力,V表示气体的体积,n表示气体的摩尔数,R为气体常数,T表示气体的温度。
该方程表明,在一定温度和压力下,理想气体的体积与摩尔数成正比。
当压力和摩尔数不变时,体积与温度呈正比关系。
二、摩尔体积的计算方法摩尔体积是指单位摩尔物质的气体所占据的体积,可以通过理想气体状态方程计算得出。
摩尔体积的计算公式为:V = V/n其中,V为气体的体积,n为气体的摩尔数。
通过计算摩尔体积,可以更好地理解气体之间的性质和行为。
摩尔体积的计算结果可以用于比较不同气体的物理特性,也可以用于分析和预测气体的行为。
三、气体状态方程的变种除了理想气体状态方程外,还存在其他一些气体状态方程的变种,根据不同的实验条件和气体性质,可以选择适合的方程来描述气体的状态。
1. 维尔斯特拉斯方程维尔斯特拉斯方程是理想气体状态方程的改进形式,将气体分子间的吸引力和排斥力考虑在内,适用于高压和低温条件。
维尔斯特拉斯方程可以表示为:[P + a(n/V)^2] (V - nb) = nRT其中,a和b为气体的常数,代表分子间相互作用的强度和分子体积。
2. 范德瓦尔斯方程范德瓦尔斯方程是对维尔斯特拉斯方程的进一步修正,引入了修正因子b,考虑了分子体积的修正。
范德瓦尔斯方程可以表示为:P (V - nb) = nRT3. 格拉斯哥方程格拉斯哥方程是适用于低压和高温条件的气体状态方程,通过对分子间碰撞频率和平均自由程进行修正,可以更好地描述气体的行为。
格拉斯哥方程可以表示为:PV = (1 + nB/V)RT其中,B为分子间反应引起的修正因子。
气体状态方程公式
气体状态方程公式是描述气体状态的基本公式,它包括了压力、体积和温度这三个变量。
根据经典物理学,气体状态方程公式可以用以下几种形式表示:
1. 通用气体状态方程:PV = nRT,其中P表示气体压力,V表示气体体积,n表示气体摩尔数量,R为气体常数,T表示气体温度。
2. 理想气体状态方程:PV = NkT,其中P、V、T和n的含义同上,N为气体分子数量,k为玻尔兹曼常数。
3. 范德瓦尔斯方程:(P + a/V)(V - b) = nRT,其中a和b是范德瓦尔斯常数,用于修正理想气体状态方程中的偏差,使其更符合实际情况。
以上三种方程都是描述气体状态的基本公式,它们在不同的气体状态下有不同的适用范围和精度。
在实际应用中,需要根据具体情况选择适合的方程,并考虑各项参数的误差和测量精度。
- 1 -。
实验七范德瓦尔斯方程与真实气体状态研究一、实验目的1. 测定等温线2. 范德瓦尔斯方程曲线的描绘3. 观察物质汽液态相变过程二、实验原理一般气体,在密度不太高,压力不太大(与大气压比较)和温度不太低(与室温比较)的实验范围内,遵守玻意耳定律、盖·吕赛克定律和查理定律。
我们把在任何情况下都遵守上述三条实验定律的气体称为理想气体。
对于质量为m ,摩尔质量为M 的理想气体的物态方程为m PV RT M= (1) 其中,P 为气体的压强,V 为气体的体积,R 为普适气体衡量,T 为热力学温标,单位是开尔文。
但真实气体只是在温度不太低,压力不太高的条件下,才能遵守理想气体的状态方程。
理想气体的等温线是等轴双曲线,而真实气体的等温线,并非都是等轴双曲线。
研究真实气体的等温线,就可了解真实气体偏离理想气体定律的情况,从而对真实气体的性质得到进一步的认识。
因此,理想气体方程应用到真实气体,必须考虑到真实气体的特征,予以必要的修正。
上世纪以来,许多物理学家先后提出了各种不同的修正意见,建立了各种不同形式的气体状态,其中形式较为简单,物理意义比较清楚的就是范德瓦尔斯方程:()22v a P V vb vRT V ⎛⎫+-= ⎪⎝⎭ (2) 式中的b 是考虑到气体分子本身体积的修正量,对于给定的气体,b 是一个恒量,可由实验来测定,一般约等于1摩尔气体分子本身体积的四倍。
另一常数a 是由气体分子间的引力引起,决定于气体的性质,可由实验来测定。
对于一定量的气体,其摩尔数M mv =。
范德瓦尔斯方程等温线与真实气体的实验等温线作比较(见图1),二者都有一条临界等温线。
在临界等温线以上,二者比较接近;在温度很高时,二者之间没有区别。
在临界等温线以下,二者却有显著的区别。
范德瓦尔斯等温线的ABCDE 是一个三次曲线,如图2,曲线中BCD 段的斜率为正,意味着体积愈膨胀,压强越大,因而无法平衡。
而AB 和DE 段是亚稳态,只可在谨慎的实验条件下才能实现,但极易失图1 CO 2实验等温线 图2 范德瓦尔斯三次方程稳。
范德华(J.D.vanderwaals1837—1923)荷兰物理学家。
青年时代家境贫寒,无力入学读书。
在工作之余,刻若钻研,自学成才,1874年他的论文“论液态和气态的连续性”引起了学术界的关注。
并获得了莱顿大学的博士学位。
经过研究,他认识到如果假定气体分子不占有体积,而且分子之间不存在引力,则可从气体分子运动论得出理想气体的状态方程,但是,这两项假定不符合事实。
1881年,他给这个方程引入两个参量,分别表示分子的大小和引力,得出一个更准确的方程即范德华方程。
他还研究了毛细作用,对附着力进行了计算。
他在研究物质三态(气、液、固)相互转化的条件时,推导出临界点的计算公式,计算结果与实验结果相符。
1877—1910年任阿姆斯特丹大学教授。
1910年因研究气态和液态方程获诺贝尔物理学奖。
原子间和分子间的吸引力被命名为范德华力。
1873年他最先假设了这种力,以研究关于真实气体的理论范德华方程范德华方程是范德瓦耳斯方程的另一种翻译,简称范氏方程,是荷兰物理学家范德瓦耳斯(van der Waals,又译“范德华”、“凡德瓦耳”)于1873年提出的一种实际气体状态方程。
范氏方程是对理想气体状态方程的一种改进,特点在于将被理想气体模型所忽略的的气体分子自身大小和分子之间的相互作用力考虑进来,以便更好地描述气体的宏观物理性质。
范德华方程式具体形式为更常用的形式为(N=摩尔数)式中p为气体的压强a'为度量分子间重力的唯象参数b'为单个分子本身包含的体积v为每个分子平均占有的空间大小(即气体的体积除以总分子数量); k为波兹曼常数T绝对温度在第二个方程式里V为总体积a为度量分子间重力的参数b为1摩尔分子本身包含的体积之和b= NAb', R为普适气体常数NA为阿伏加德罗常数. 下表列出了部分气体的a,b的值范德华方程常用的形式(N=摩尔数)在一般形式的范氏方程中,常数a和b 因气体/流体种类而异,但我们可以通过改变方程的形式,得到一种适用于所有气体/流体的普适形式。