PIWI-piRNA“机器”与雄性生殖细胞发育
- 格式:pdf
- 大小:639.17 KB
- 文档页数:10


piRNA通路在生精过程中的作用李雪瑶;杨菁;李洁;徐玲【期刊名称】《生殖医学杂志》【年(卷),期】2018(027)001【摘要】piRNA是一类特异性与Argonuat蛋白家族中的PIWI蛋白相互结合形成piRNA沉默复合体(piRNA-induced silencing complex,piRISC)而在生物体内发挥重要作用的非编码小RNA,主要作用于生殖系统.piRNA通路不仅通过抑制转座子,还通过泛素化降解、调控mRNA表达、基因甲基化修饰等方式来发挥在生精过程中的特定作用.本文拟对piRNA通路在生精过程中的作用进行综述.%piRNA is a class of small non-coding RNA,which specifically interacts with PIWI proteins,a subfamily of Argonuat protein,playing an important role as a piRNA-induced silencing complex (piRISC)in the reproductive system.It mostly functions by silencing genetic elements calledtransposons,degradating ubiquitination,regulating the expression of mRNA,modifying gene methylation,etc.in spermatogenesis.This review summarizes the functions of piRNA pathway in spermatogenesis.【总页数】5页(P95-99)【作者】李雪瑶;杨菁;李洁;徐玲【作者单位】武汉大学人民医院生殖医学中心,武汉430060;武汉大学人民医院生殖医学中心,武汉430060;武汉大学人民医院生殖医学中心,武汉430060;武汉大学人民医院生殖医学中心,武汉430060【正文语种】中文【相关文献】1.睾丸间质细胞在小鼠生精恢复过程中的作用 [J], 袁丽芳;安娜;王善林;关淑鸾;王峰;李宗悦;朱宝长2.MAPK信号通路在炔雌醚诱导大鼠生精细胞凋亡中的作用研究 [J], 李健;陈耀星;陈福宁;王子旭;曹静;董玉兰3.三个阶段牦牛睾丸发育过程中piRNA的鉴定及分析研究 [J], 殷实; 秦文昌; 王斌; 周婧雯; 杨柳青; 李键4.亚精胺调控糖酵解通路改善糖尿病小鼠生精障碍的作用 [J], 王晋元;马朵;罗敏;雷小灿5.Rho/ROCK信号通路调控生精小管样结构重构的作用及机制研究 [J], 孙梦迪;李春阳;刘松坡;张继东因版权原因,仅展示原文概要,查看原文内容请购买。
PiRNA 研究进展非编码小RNA在正常的生物学过程和人类疾病中均有重要作用(Esteller, M et al., 2011),主要包括microRNAs(miRNA)、short-interfering RNAs (siRNA)和PIWI-interacting RNAs(piRNA)。
piRNA的发现得益于PIWI蛋白家族的研究,这种蛋白是动物繁衍后代所必须的。
目前,保守估计真核生物基因组上大约具有20,000个piRNA(Moyano, M et al., 2015)。
piRNA首次在果蝇的睾丸中被鉴定为一种新的长的siRNA( long siRNA),可以沉默位于果蝇X染色体上的多拷贝基因Stellate (Arvain et al, 2001)。
后因与Argonaute蛋白家族亚族PIWI相结合发挥作用而得名,由Arvain等采用层析柱法从小鼠睾丸细胞中分离得到(Arvain et al, 2006)。
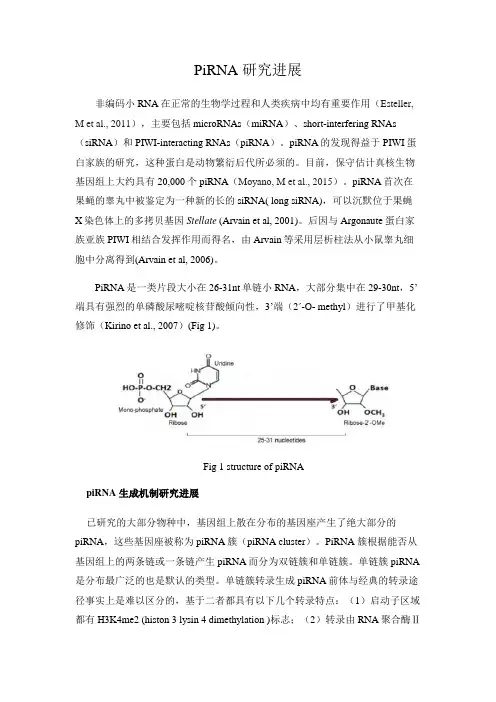
PiRNA是一类片段大小在26-31nt单链小RNA,大部分集中在29-30nt,5’端具有强烈的单磷酸尿嘧啶核苷酸倾向性,3’端(2ʹ-O- methyl)进行了甲基化修饰(Kirino et al., 2007)(Fig 1)。
Fig 1 structure of piRNApiRNA 生成机制研究进展已研究的大部分物种中,基因组上散在分布的基因座产生了绝大部分的piRNA,这些基因座被称为piRNA簇(piRNA cluster)。
PiRNA 簇根据能否从基因组上的两条链或一条链产生piRNA而分为双链簇和单链簇。
单链簇piRNA 是分布最广泛的也是默认的类型。
单链簇转录生成piRNA前体与经典的转录途径事实上是难以区分的,基于二者都具有以下几个转录特点:(1)启动子区域都有H3K4me2 (histon 3 lysin 4 dimethylation )标志;(2)转录由RNA聚合酶Ⅱ(pol Ⅱ)负责;(3)经典的RNA转录后加工(5’端帽子修饰、剪切、多聚腺苷酸修饰)(Goriaux C et al., 2014)。

果蝇生殖生物学研究果蝇生殖细胞分化机制果蝇是一种常见的研究模式生物。
果蝇生殖生物学作为其研究领域之一,吸引了许多科学家的关注。
本文将从果蝇生殖细胞分化机制入手,探究果蝇生殖生物学的研究进展。
一、果蝇生殖细胞的分化过程果蝇生殖细胞分化是指由一种细胞类型转变为另一种不同的细胞类型的过程。
在果蝇的生殖系统中,雄性和雌性的生殖细胞均来源于同一种类型的祖细胞——生殖干细胞(germ cell)。
在果蝇幼虫期间,生殖干细胞分裂时并不产生分化细胞,而是自我更新,保持一定数量的干细胞群。
随着生长的进行,这些生殖干细胞经过一系列分裂和分化,最终分化为成熟的雄性或雌性生殖细胞。
生殖细胞分化过程中,需要借助许多重要的分子机制。
下文将重点介绍其中的两个:piRNA 途径和可逆蛋白磷酸化。
二、piRNA 途径在果蝇生殖细胞分化中的作用piRNA (PIWI-interacting RNA) 是成熟的生殖细胞中的一种小RNA,与某些PIWI 蛋白相结合,形成复合物,并参与干细胞自我更新和生殖细胞分化。
在果蝇中,piRNA 路径的调控被证明是生殖细胞分化中至关重要的一环。
piRNA 复合物中的 PIWI 蛋白可以识别和结合到具有互补序列的小RNA 分子中,从而调节基因表达并抑制移动基因元件的活性。
这种抑制作用对生殖细胞的正常分化至关重要。
长期以来,科学家们通过对果蝇的研究,发现了许多与 piRNA 路径相关的基因,如 aubergine(aub)、piwi 和 argonaute3(ago3)。
这些基因在控制 piRNA 路径中发挥着重要作用。
三、可逆蛋白磷酸化与果蝇生殖细胞分化可逆蛋白磷酸化是目前生物学研究的热点之一,是磷酸化和去磷酸化反应的动态平衡,受多种调控机制控制,涉及到许多细胞生命周期中的重要过程。
生殖细胞的分化过程中,也需要可逆蛋白磷酸化的帮助。
在果蝇的生殖细胞中,蛋白磷酸酶 PP1 帮助调节了 PIWI 蛋白的活性,进而对piRNA 途径的调控产生影响。


Science细述基因组卫士piRNA的故事与绝大多数动物一样,人类基因组不少都来自于一种自私的DNA链——转座子。
这类遗传物质能够在染色体不同位点间跳跃,导致基因失活甚至引发癌症。
在生殖细胞系中,转座子的跳跃还可能导致不孕。
“对于绝大多数动物来说,无法控制转座子都会最终导致物种灭绝,”麻省大学医学院的生化遗传学家Phillip Zamore说。
正因如此,一类特殊的RNA分子(piRNA)就成了动物基因组的大英雄。
piRNA发现于2006年,在动物生殖细胞系中它与特定蛋白一同束缚转座子。
这种蛋白- RNA的组合形成了一个分子防御系统,科学家们将其比作基因组的免疫系统。
与免疫系统相似,piRNA系统能够区分敌我,启动应答,并且去适应新出现的入侵者。
这些基因组卫士们还能够记住曾经入侵的转座子。
在进化过程中piRNA的复杂性曾经历了爆炸式增长,科学家们认为人体内的piRNA 总共可能有数百万种。
近年来,研究人员开始慢慢理解piRNA约束转座子的机制,但人们依然不了解细胞制造piRNA的过程,也不清楚这些RNA在生殖细胞系以外还有何功能。
Zamore指出,在哺乳动物中piRNA沉默转座子只是其功能的一小部分,尽管这也是人们目前唯一了解的部分。
2012年前后piRNA研究领域开启了令人兴奋的新时代,该领域的重要成果纷纷登上Science、Nature、Cell等顶尖杂志。
本期Science杂志就对近来的piRNA研究进行了系统性总结和展望。
piRNA的发现piRNA的发现始于Piwi蛋白研究,该蛋白是一些动物繁衍后代所必需的。
2006年Alexei Aravin和Gregory Hannon两个研究小组几乎同时在Nature和Science杂志发表文章,他们在小鼠体内发现了数千种与Piwi蛋白合作的小RNA。
人们将这类RNA称为Piwi-互作RNA或piRNA。
piRNA与microRNAs、siRNA有许多不同之处,Dicer酶是microRNAs 和siRNA成熟所必需的酶,但piRNA生成并不需要这种酶。


小RNA的生物学功能和分子调节机制小RNA是一类长度在20-30个核苷酸左右的非编码RNA,包括miRNA、siRNA、piRNA、snRNA等几十种类型。
它们广泛参与各种生物过程,从基因表达调控到细胞增殖和死亡,甚至支配着一些生物发育和遗传变异的方向。
这篇文章将分析小RNA的生物学功能和分子调节机制。
一、miRNAmiRNA是最广泛研究的小RNA类型,其主要作用是通过RNA诱导靶向后割裂(mRNA cleavage)、翻译抑制或酶活性调节等机制降低靶向基因表达水平。
miRNA首先在细胞核内的pri-miRNA上由Drosha核酸酶和其配体DGCR8剪断成长度为70nt左右的前体miRNA(pre-miRNA),然后由转运至胞质的Exportin-5和RanGTP复合物负责转运。
在胞质中,Dicer核酸酶和TRBP与Exportin5-RanGTP复合体共同作用将pre-miRNA加工为长度为20-24nt左右的成熟miRNA。
成熟的miRNA通过与Argonaute蛋白结合形成RNA 径,然后与靶向基因上的mRNA配对,引发后者的减少、抑制或调控。
除此之外,有些研究发现miRNA还可以通过胚胎发育和疾病等途径影响DNA的甲基化和组蛋白修饰,从而进一步调制基因表达和表观遗传学特征。
例如,miR-29家族广泛参与了一个称为“初级DNA甲基化”的过程,在干细胞和早期胚胎发育中稳定维持着基因组的甲基化水平。
二、siRNAsiRNA是一种由物理或化学方法合成的小分子RNA,与miRNA的产生和代谢过程略有不同。
siRNA主要作用是在非特异性的RNA干扰(RNA interference,RNAi)中,在离核的体外或细胞内通过RNA诱导寄生抑制(RNA-induced silencing complex )与靶mRNA的相互作用,从而降低靶基因表达。
siRNA的合成分为两个步骤:首先合成长为50-75nt的dsRNA,然后利用Dicer剪切成长度为20-22nt的小siRNA。

pirna在昆虫中的功能
pirna是PIWI介导的小RNA,是一种长度约为24-30个核苷酸的非编码RNA,主要在生殖细胞中表达。
在昆虫中,pirna的功能主要与基因组稳定性和转录后基因沉默有关。
首先,pirna在昆虫中起着抑制转座子活性的作用。
转座子是基因组中可移动的DNA片段,它们的活性可能会导致基因组不稳定和突变。
pirna通过与PIWI蛋白结合,形成RNA诱导沉默复合物,能够识别和切割转座子RNA,从而抑制转座子的活性,维持基因组的稳定性。
其次,pirna也参与到对外源DNA的沉默。
在昆虫中,外源DNA (如病毒、外源转座子等)的侵入会触发机体的防御反应,pirna 可以与外源DNA的RNA互作,通过RNA诱导沉默机制来抑制外源DNA的转录和翻译,从而保护宿主免受外源DNA的侵害。
此外,pirna还可能参与到调控基因表达的过程。
在一些昆虫中,pirna能够与靶基因的mRNA结合,从而影响靶基因的翻译和稳定性,进而影响基因表达调控。
总的来说,pirna在昆虫中扮演着维持基因组稳定性、抑制转座子活性、抵御外源DNA侵入以及调控基因表达等重要功能。
这些功能的发挥对于昆虫的生存、繁殖和适应环境具有重要意义。

piRNA在生殖系统中的研究进展赵鸿娟;王亚楠;高树军;张媛媛;李光鹏;王煜【期刊名称】《国际妇产科学杂志》【年(卷),期】2016(043)005【摘要】Piwi蛋白相互作用RNA(piRNA)是一类长度约为30个核苷酸的非编码RNA。
目前研究提示piRNA通过与PIWI蛋白家族成员结合后,参与异染色质形成、生殖细胞的发育和维持DNA的完整性。
piRNA与小干扰RNA (siRNA)及微小RNA(miRNA)均是近些年发现的非编码小RNA,在功能、分布和分子特征等方面存在着显著不同。
piRNA在精子的发生过程中起着重要的生理调节作用,目前对于piRNA的研究逐渐深入,认识也进一步提高。
例如, piRNA的结构特点,发挥功能相关作用蛋白,在体内的分布与表达,在生物体内与PIWI发挥作用的方式以及功能。
piRNA数据库的建立将对此类小分子RNA的研究有很大的促进作用。
%Piwi-interacting RNA (piRNA) is a group of small RNAs about 30 nucleotides length that isolated from mammalian reproductive cells, which could bind to the Piwi proteins and regulate its corresponding function. piRNA mainly participates in the process of development of germ cells, silence of transposon, formation of heterochromatin, DNA integrity of germ cells, and so on. It contributes to steady heredity of hereditary substance. As small interfering RNA (siRNA), microRNA (miRNA) and piRNA is a kind of non-coding small RNAs founded in recent years. However, they are different in functions, gene distributions and characteristics. piRNA is essential for physiological modulation ofspermiogenesis. The research of piRNA was further investigated, such as structural features, distribution and interactions with PIWI proteins. Furthermore, establishment of piRNA database will facilitate scientific research of piRNA.【总页数】5页(P576-580)【作者】赵鸿娟;王亚楠;高树军;张媛媛;李光鹏;王煜【作者单位】010050 呼和浩特,内蒙古医科大学附属医院;内蒙古大学实验动物中心;内蒙古大学生命科学学院;内蒙古大学生命科学学院;内蒙古大学实验动物中心;010050 呼和浩特,内蒙古医科大学附属医院【正文语种】中文【相关文献】1.piRNA/PIWI 在肝癌发生发展中的机制研究进展 [J], 周代兵;张凌云;许国雄2.piRNA在生殖系统中的功能研究进展 [J], 张燕;樊伯珍;童晓文3.女性生殖系统肿瘤患者的微生物群在肿瘤中的作用的研究进展 [J], 唐杰;何京4.piRNA在阿尔兹海默症中的研究进展 [J], 孙添怡5.PIWI/piRNA在妇科恶性肿瘤中的研究进展 [J], 许瑞雪;毛奕文;马洋洋;蒋学风因版权原因,仅展示原文概要,查看原文内容请购买。

piRNA的生物合成及其在生殖细胞中的功能Carla Klattenhoff and William Theurkauf*小干扰RNA和微小RNA是由双链的RNA前体经核酸内切酶Dicer切割生成的,并与Argonaute家族蛋白共同作用破坏转录物或沉默翻译。
一类清楚的RNA核苷酸长度为24-30个,通过Dicer依赖型机制生产,与Argonaute蛋白家族中的Piwi蛋白结合。
关于苍蝇、鱼和小鼠的研究暗示了Piwi蛋白结合RNAs(piRNA)在生殖细胞发育、沉默自私DNA元件和维持种系DNA完整性中的功能。
然而,无论是piRNA染色质主要控制机制、基因转录、RNA稳定性或RNA翻译,还是piRNA的生物合成都不是很清楚。
在这里,我们回顾了近期的关于piRNA生成和功能的研究,并讨论关于这个耐人寻味的新型小RNA的悬而未决的问题。
前言1993年,安布罗斯和他的同事发现,线虫的lin-4基因通过负调控编码一个小调控RNA并与lin-14的转录单元互补(Lee等人,1993)。
这些开创性的研究确定了第一个微小RNA(miRNA)。
在动物和植物实验室中,非编码的小RNA随后成为强大的实验工具和关键的发育调节者(Baulcombe,2004;汉农,2002;Kloosterman和Plasterk,2006;梅洛和康特,2004)。
目前,21个核苷酸(nt)的小干扰RNAs(siRNAs)被频繁用于实验性的操纵基因表达,它是通过Dicer核酸内切酶处理长双链RNA(dsRNA)的前体得到的,随后形成中间体RNA-蛋白质复合体。
该中间体取代RNA的其中一条链(被称为“过客链”),并产生成熟的RNA诱导的沉默复合体(RISC),其中包含一条能够与Argonaute蛋白家族结合的单链(“引导链”)。
当siRNA的引导链与靶RNA完全互补时,Argonaute蛋白识别特异性序列并切割(Hannon,2002;Meister和Tuschl,2004)。
pirna名词解释
PIRNA是指小干扰RNA(PIWI-interacting RNA)的一类非编码RNA分子。
它们是一类长度为24-32个核苷酸的小分子RNA,在生物体内广泛存在。
PIRNA主要与PIWI蛋白相互作用,形成PIWI-PIRNA 复合物,参与调控基因表达和维持基因组的稳定性。
PIRNA在生物体内起着重要的生物学功能。
首先,PIRNA参与调控基因表达。
它们通过与PIWI蛋白结合,能够识别和沉默转座子(一类可移动的基因片段),从而抑制转座子的活性,维持基因组的稳定性。
此外,PIRNA还能够通过与mRNA结合,诱导mRNA的降解,从而抑制基因的表达。
其次,PIRNA在生殖细胞发育中起着重要的作用。
在生殖细胞中,PIRNA通过与PIWI蛋白形成复合物,参与调控基因组的去甲基化和染色质重塑等过程,维持生殖细胞的正常发育和功能。
PIRNA 的异常表达或突变可能导致生殖细胞的发育障碍和不育。
此外,最近的研究还发现PIRNA在肿瘤发生和发展中可能发挥作用。
一些研究发现,PIRNA在某些肿瘤中的表达水平异常,与肿瘤的增殖、转移和耐药等现象相关。
进一步研究PIRNA在肿瘤中的
作用机制,有助于深入了解肿瘤发生的分子机制,并为肿瘤的诊断和治疗提供新的思路和靶点。
总之,PIRNA是一类重要的非编码RNA分子,参与调控基因表达、维持基因组稳定性和调控生殖细胞发育等生物学过程。
对PIRNA的研究有助于揭示生物体内基因调控的复杂机制,以及相关疾病的发生与发展。
反向标记哨兵向导(最新版)目录1.反向标记哨兵向导的定义与作用2.反向标记哨兵向导的种类与特点3.反向标记哨兵向导的应用领域4.反向标记哨兵向导的优势与局限性5.我国在反向标记哨兵向导方面的研究进展正文哨兵向导是一种能够在生物体内传递信息的分子,它们在生物体内起到调控基因表达、细胞生长、分化和迁移等重要生物学过程的作用。
近年来,随着研究的深入,科学家们发现哨兵向导不仅可以从前往后传递信息,还可以从后往前进行反向标记。
这种反向标记哨兵向导在生物学研究中具有广泛的应用前景。
一、反向标记哨兵向导的定义与作用反向标记哨兵向导是指一类能够在生物体内从后往前传递信息的非编码 RNA 分子。
与传统的哨兵向导不同,它们能够与靶向 RNA 结合,并调控其功能。
反向标记哨兵向导在调控基因表达、细胞生长、分化和迁移等生物学过程中发挥着重要作用。
二、反向标记哨兵向导的种类与特点根据结构和功能的不同,反向标记哨兵向导可分为以下几类:1.microRNA(miRNA):一类长度约为 20-22 个核苷酸的小 RNA 分子,主要通过与靶 mRNA 结合,从而抑制其翻译或降解 mRNA,进而调控基因表达。
2.长链非编码 RNA(lncRNA):一类长度超过 200 个核苷酸的非编码RNA 分子,主要通过与染色质重塑因子、RNA 结合蛋白等相互作用,影响染色质的结构和功能,进而调控基因表达。
3.小干扰 RNA(siRNA):一类长度约为 20-22 个核苷酸的双链 RNA 分子,主要通过引导核酸酶剪切靶 mRNA,从而抑制基因表达。
4.Piwi-interacting RNA(piRNA):一类与 Piwi 蛋白相互作用的小RNA 分子,主要参与生殖细胞的发育和基因组稳定性的维护。
三、反向标记哨兵向导的应用领域反向标记哨兵向导在多个生物学领域具有广泛的应用前景,包括但不限于:1.基因表达调控:研究反向标记哨兵向导与基因表达的关系,有助于深入理解生命过程中的基因调控机制。
收稿日期:2014-07-14*通信作者:E-mail: mfliu@PIWI/piRNA “机器”与雄性生殖细胞发育戴 鹏,苟兰涛,刘默芳*(中国科学院上海生命科学研究院生物化学与细胞生物学研究所,分子生物学国家重点实验室,上海市分子男科学重点实验室,上海 200031)摘要:PIWI (P-element-induced wimpy testis )蛋白在动物生殖系细胞中特异性表达,为动物生殖细胞发育分化所必需。
piRNA (PIWI-interacting RNAs )是最近在动物生殖系细胞中发现的一类非编码小分子RNA ,这类小RNA 特异性地与PIWI 家族蛋白相互作用。
PIWI/piRNA “机器”通过沉默转座元件和调控编码mRNA 等方式在动物生殖细胞发育分化过程中发挥重要作用。
本文围绕PIWI/piRNA “机器”的生物学功能及分子机制,对近期取得的相关研究进展进行了系统性总结。
关键词:PIWI ;piRNA ;转座元件;精子发生PIWI/piRNA machinery in spermatogenesisDAI Peng, GOU Lantao, LIU Mofang *(State Key Laboratory of Molecular Biology, Shanghai Key Laboratory of Molecular Andrology, Institute of Biochemistry and Cell Biology, Shanghai Institutes for Biological Sciences, Chinese Academy of Sciences, Shanghai 200031, China)Abstract: PIWI proteins are specifically expressed in animal germ cells, and have been well demonstrated to be essential for germline development and gametogenesis. Recently, PIWI-interacting RNAs (piRNAs), a novel class of germ-cell-specific small noncoding RNAs, have been found associated with PIWI proteins. PIWI/piRNA machinery silence transposable elements and regulate the expression levels of mRNAs during刘默芳,女,博士,中国科学院生物化学与细胞生物学研究所研究员,博士生导师。
2000年在中科院上海生化所获博士学位。
2000年至2006年分别在美国国家健康研究院国立癌症研究所(NIH/NCI )、约翰霍浦金斯医学院从事博士后研究、研究助理工作。
2006年起在中科院生化与细胞所工作。
获得2013年度国家杰出青年科学基金和2006年度上海市“浦江人才计划”等支持。
刘默芳研究组从事非编码RNA 功能机制研究,主要围绕piRNA 与哺乳动物精子发生、microRNA 与人类癌症等开展较系统的探索。
近期工作先后发现小鼠piRNA 及其结合蛋白MIWI 在后期精子细胞中协同降解的调控机制(Dev Cell 2013)、小鼠粗线期piRNA 指导父本mRNA 在精子形成后期大规模降解(Cell Res 2014);同时还发现microRNA 在炎症相关肿瘤发生中具有极其重要的调控作用,是联系炎症-癌症的新介质因子(Cancer Res 2014;Cell Res 2014;EMBO J 2012;Cell Res 2012;Cancer Res 2010)。
这些原创性研究成果揭示了小分子非编码RNA 的生理和病理功能机制, 可为男性不育症及肿瘤等疾病的诊治研究提供理论依据和相关基础。
戴鹏, 等. PIWI/piRNA“机器”与雄性生殖细胞发育· 457 ·PIWI(P-element-induced wimpy testis)蛋白是Argonaute蛋白家族亚家族成员,特异性地在动物生殖系细胞中表达,为动物生殖细胞发育分化所必需。
piRNA是最近在动物生殖系细胞中发现的一类非编码小分子RNA,因它们特异性地与PIWI 家族蛋白相互作用,所以被称为PIWI相互作用RNA(PIWI-interacting RNA),简称piRNA。
piRNA 起源于基因组中的反转座子、重复序列及其它被称为piRNA簇的区域,推测piRNA可能主要通过在表观遗传水平和转录后水平沉默转座子、反转座子等基因组移动遗传元件,维持生殖细胞自身基因组的稳定性和完整性,在配子形成过程中发挥重要作用。
目前,领域内对PIWI蛋白及piRNA的作用通路及功能已有越来越多的认识,但仍有许多科学问题还未被解答。
1 PIWI 蛋白Argonaute蛋白家族可分为AGO和PIWI两个亚家族成员,它们在物种间高度保守,并在小分子非编码RNA调控途径中发挥核心作用。
其中AGO 蛋白质成员特异性地与小分子干扰RNA(small in-terfering RNA, siRNA) 和microRNA(miRNA)结合,在多种组织器官中发挥重要功能[1]。
而PIWI蛋白质特异性地在动物生殖系细胞中表达,特异性地结合piRNA,在动物生殖细胞发育和配子生成过程中发挥多种重要功能[2-6]。
Argonaute家族蛋白质含有保守的PAZ(P iwi Ar-gonaut and Z wille)结构域和PIWI结构域。
结构及生化研究表明,AGO/PIWI蛋白质通过PAZ结构域与小分子RNA的3′末端结合,而PIWI结构域及MID结构域(the middle domain)结合RNA分子的5′末端[7-12]。
PIWI结构域含有RNase H的催化结构域,一部分Argonaute 成员具有核酸内切酶活性,可在对应于向导小RNA分子第10位与11位碱基之间切割靶RNA链[13-16]。
piwi是进化上非常保守的一类基因[17],最早在果蝇中被发现,对果蝇生殖干细胞的自我更新和维持是必需的[18]。
随后,研究人员通过功能缺失突变实验发现,piwi基因缺失也导致线虫、斑马鱼及小鼠等模式生物生殖细胞发育受阻[19]。
这些研究表明,PIWI蛋白主要在动物生殖细胞中表达,其功能与生殖事件相关。
在小鼠中,PIWI蛋白家族包括三个成员:MIWI2、MILI和MIWI,它们在小鼠雄性生殖细胞的发育分化过程中呈现高度时空特异性表达。
MIWI2 从胚胎期15.5 d开始出现,持续表达至出生后3 d。
miwi2的缺失突变导致生精细胞发育停滞在第一次减数分裂的细线期,并伴有精原细胞的大量凋亡、DNA双链断裂及DNA甲基化水平降低所致的转座元件表达升高[20,21]。
此外,支持细胞中也能检测到MIWI2的表达,但其对于生殖细胞的功能并非必需[20]。
MILI从胚胎期12.5 d的原始生殖细胞中开始表达,并持续到减数分裂前后,到球形精子细胞阶段结束。
mili基因的缺失突变导致生精细胞发育停滞在第一次减数分裂的偶线期或者早粗线期[22,23]。
MIWI在出生后14 d的睾丸组织中检测到,在粗线期精母细胞高表达,并持续到减数分裂后的球形精子细胞中,在延长形精子细胞和长形精子细胞中逐渐减少,在成熟精子中完全消失;miwi缺失突变造成小鼠精子形成阻断在球形精子细胞发育的早期阶段,与调控精子发生的关键因子—CREM(cAMP-responsive element modula-tor)的缺失突变小鼠的表型相类似[24]。
2 生殖细胞中的piRNA2006年,四个独立的研究小组几乎同时在果蝇、小鼠、大鼠和人等物种生殖系细胞中发现了一类特异地与PIWI家族蛋白质相互作用的新型小分子RNA,被命名为PIWI相互作用RNA(PIWI-in-teracting RNA),简称piRNA[2-6]。
而事实上,已有研究者最早在果蝇中发现,PIWI蛋白可以与一些来自逆转座子、异染色质区域重复元件的小RNA 特异性结合[25,26],这些小RNA被称为rasiRNA(re-peat-associated siRNA)。
进一步研究发现,这些ra-germline development and gametogenesis. In this review, we summarize the recent progress of the functions and mechanisms of PIWI/piRNA machinery.Key Words: PIWI; piRNA; transposable elements; spermatogenesis《生命的化学》2014年34卷4期· 458 ·专题:RNA研究siRNA仅与PIWI家族蛋白(Piwi、Aub、Ago3)结合,而不与AGO家族成员相互作用,故这些rasiR-NA即是piRNA[27,28]。
已有的实验证据表明,piRNA具有以下特性:其主要成簇分布在长度在20~90 kb的基因簇上;成熟序列可来源于基因间区域、内含子及外显子序列[2-4];其长度约为24~32 nt;可特异性地与PIWI家族蛋白质成员相互作用;它们的5′末端具有很强的U碱基偏好性[2,3,12];其3′末端被2′-O-Me修饰,以保护其免受核酸外切酶降解[29,30]。
3 PIWI/piRNA“机器”的功能与机制3.1 piRNA的生成机制通过对果蝇、小鼠等物种的piRNA序列分析比对,推测piRNA分子可能通过两种途径生成:初级加工途径(primary processing pathway)和“乒乓循环”扩增途径(Ping-Pong amplification loop)。
已有的证据表明,大多数piRNA的序列都对应于范围较小的基因组区段,这些区域被称为piRNA簇(piRNA cluster)[2,3]。
piRNA簇在基因组中的分布可从若干kb至200 kb以上,每一个piRNA簇都可产生多种序列的piRNA,有些簇可双向转录产生piRNA 前体,而有些簇只有一条DNA链可生成piRNA。
研究人员推测,这些piRNA簇经转录得到长单链piRNA前体,随后再经过不依赖于Dicer酶的未知加工机制,生成初级piRNA。
在此过程中,可能首先由一种未知核酸内切酶切割长单链piRNA前体,加工产生成熟的piRNA 5′单磷酸末端,该前体即被装载到Piwi或Aub蛋白上,再由一个假定的核酸外切酶Trimmer加工产生piRNA成熟的3′末端,最后由RNA甲基化酶HEN1对piRNA 3′进行甲基化修饰,产生2′-O-Me修饰[31,32]。